禽白血病病毒衣壳蛋白p15基因慢病毒表达载体的构建及其在鸡肝癌细胞系中的表达
2021-04-13沈逵何倩秦爱建钱琨
沈逵,何倩,秦爱建,3,钱琨,3*
(1.扬州大学教育部禽类预防医学重点实验室,江苏 扬州 225009;2.扬州大学江苏省动物预防医学重点实验室,江苏 扬州 225009;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
禽白血病病毒(avian leukosis virus,ALV)是一种能够引起宿主产生严重免疫抑制的反转录病毒,最终导致宿主产生多种恶性肿瘤[1]。严重的免疫抑制常常造成多种病原的混合感染,有研究表明,先天感染ALV是导致鸡马立克病疫苗免疫效果低下的主要原因之一[2],其与禽网状内皮组织增生症病毒共感染条件下可以促进彼此的复制[3-4],因此ALV对养禽业危害严重。
ALV的基因组具有典型的慢转化型反转录序列:5′-R-U5-gag-pol-env-U3-R-3′[5],主要编码各种结构蛋白(gag、pol、env),包括磷蛋白(如p19)、核衣壳蛋白(如p15、p27)、DNA聚合/整合酶蛋白(如p68、p32)、囊膜蛋白(如gp85、gp37)等。gag基因十分保守,主要编码12 kDa、15 kDa、19 kDa和27 kDa 4种蛋白质,它们分别命名为p12、p15、p19和p27,其中p15和p27为衣壳蛋白[6]。目前对病毒编码蛋白的研究主要集中在p27、gp85和gp37蛋白,已报道的研究发现,gp37在胞浆区域的C末端酪氨酸基序在体内外均可影响ALV-J的致病性[7],gp85含有病毒受体决定簇,其高变区和可变区决定了ALV的中和活性和特异性[8],p27存在多种抗原表位,基因组十分保守,是群特异性抗原,常被作为各亚群ALV的检测指标[9]。衣壳蛋白p15作为一种由124个氨基酸组成的蛋白酶,可对gag和pol基因编码的多聚蛋白进行切割,使其加工成为成熟的非糖基化蛋白和一些多肽。有研究表明,gag末端携带活化状态下的p15时,前体蛋白的成熟和释放过程将十分迅速,并且p15-蛋白N端的7个氨基酸组成的区域有增加病毒装配效率的作用[10]。但目前对于衣壳蛋白p15的生物学功能研究还知之甚少。
慢病毒载体作为一种十分灵活且强大的载体工具,可实现持续的基因传递、稳定地将载体整合到宿主基因组,在分裂和非分裂细胞中均可表达,其感染效率可达到80%以上[11]。近年来,慢病毒载体广泛应用于生物医学领域,在畜牧兽医领域也有大量报道。Kang等[12]构建了含有山羊chi-pri-mir-204基因的重组慢病毒载体pCDH-CMV-mir204-EF1-GreenPuro,包装产生的慢病毒可影响小鼠生精小管中Sirt1、Oct4和Plzf等相关基因的表达;庞中兵等[13]成功以慢病毒表达载体共表达Cas9和sgRNA,获得了一株敲除TLR4基因的DF-1细胞系。本研究尝试构建了禽白血病病毒p15基因的慢病毒表达载体,并检测p15蛋白在LMH细胞中的表达,为在禽源细胞中深入研究p15蛋白的生物学功能提供良好的生物材料。
1 材料与方法
1.1 细胞与质粒
人肾上皮细胞系(HEK 293T)、鸡肝癌细胞系(LMH)均由本实验室保存。真核表达的质粒pCAGGS-p15由实验室构建、鉴定、保存。慢病毒骨架质粒pLVX-IRES-ZsGreen1,辅助质粒慢病毒外壳蛋白表达质粒psPAX2(pHelper1)和慢病毒膜蛋白表达质粒pMD2·G(pHelper2)均由西北农林科技大学赵钦教授馈赠。DH5ɑ感受态细胞购自南京诺唯赞生物科技有限公司。
1.2 主要试剂
胎牛血清,DMEM-F12(1∶1)培养基,Opti-MEM培养基均购自GIBCO公司;双抗购自碧云天公司;T4连接酶购自Promega公司;RIPA细胞裂解液购于Cell Signaling Technology公司;兔源抗Flag多克隆抗体购自Proteintech公司;1 kb DNA Maker、预染蛋白质Marker购自康为世纪公司;ECL化学发光显色液购自Bio-Rad公司;山羊抗兔IgG Alexa 594购于Jackson公司;Hoechst 33342细胞核染色试剂、辣根过氧化物酶(HRP)标记的山羊抗鼠、抗兔IgG全分子抗体、聚凝胺(polybrene)均购自SIGMA公司;BCA蛋白定量试剂盒、高保真PCR反应试剂盒购自南京诺唯赞公司;限制性核酸内切酶XhoⅠ(FD)、EcoRⅠ(FD)、荧光定量反转录试剂盒SYBR Premix ExTaqTMⅡ 购于宝生物工程(大连)有限公司;转染试剂TransIT-X2购自Mirus公司,其他常用试剂均为国产分析纯产品。
1.3 引物的设计与合成
根据NCBI查到的ALV-J基因序列(GenBank No.Z46390.1)中p15片段序列设计引物序列,引物下游3′端融合有Flag标签。利用DNAStar设计PCR引物序列如下(下划线分别为EcoRⅠ和XhoⅠ酶切位点,斜体为Flag标签序列,扩增片段的长度为372 bp):
p15-F:CGGAATTCATGTTAGCGATGACAATGGAACATAA;
p15-R:GCCTCGAGTCACTTATCGTCGTCATCCTTGTAATCTAAATTTGTCAAGCGGAGCCCT。
1.4 慢病毒质粒的构建
以本实验室前期制备的真核表达质粒pCAGGS-p15为模板扩增目的片段。p15基因PCR扩增体系为:2×Phanta Max Buffer 25 μL,10 mmol/L dNTP Mix 1 μL,p15-F(10 μmol/L) 2 μL,p15-R(10 μmol/L) 2 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL,质粒pCAGGS-p15 2.4 μL,ddH2O 16.6 μL,共50 μL体系。反应程序为:95 ℃预变性3 min;之后95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s,共30个循环;72 ℃ 5 min,降至4 ℃。反应产物经核酸电泳鉴定,条带大小正确后切胶回收,用于酶切。
酶切反应均使用快切酶,分别酶切胶后,回收产物和慢病毒骨架质粒。反应体系为:10×Green Buffer 2 μL,EcoRⅠ(FD)1 μL,XhoⅠ(FD)1 μL,胶回收片段产物3 μL,ddH2O 13 μL,共20 μL体系。置于37 ℃水浴锅中反应15 min,将产物进行纯化并回收。骨架质粒plvx-IRES-ZsGreen1使用相同处理方法以获得黏性末端用于连接。
连接体系为:2×T4 DNA Ligase Buffer 5 μL,T4 DNA Ligase 1 μL,酶切骨架质粒plvx-IRES-ZsGreen 11 μL,酶切目的片段回收产物 3 μL,共20 μL体系。4 ℃过夜连接,将连接产物转化至DH5ɑ感受态细胞中,次日挑取单个菌落,抽提质粒,送至南京金斯瑞生物科技有限公司进行DNA测序。测序正确的质粒用于后续试验,并命名为plvx-p15-Flag。
1.5 慢病毒的包装和滴度测定
1.5.1 慢病毒的包装和收集
将3×107个HEK 293T细胞接种于T25规格细胞方瓶中,培养12 h,待密度达到约80%时进行细胞转染。
转染体系质粒总量为6 μg,质粒含量比例为:plvx-p15-Flag(慢病毒骨架质粒)∶psPAX2(慢病毒外壳表达质粒)∶pMD2·G(慢病毒膜蛋白表达质粒) = 5∶4∶1。转染体系为:3 μg plvx-p15-Flag+2.4 μg psPAX2+0.6 μg pMD2·G+18 μL TransIT-X2,转染过程按照TransIT-X2说明书进行。
于显微镜下观察共转染细胞,每隔12 h观察1次。待视野下自发荧光细胞数目达到50%以上时,冻融细胞,离心收取上清,置于-70 ℃保存备用。
1.5.2 慢病毒滴度测定
取HEK 293T细胞接种入12孔板中,每孔约9×105个细胞,培养过夜;次日,用梯度稀释法稀释pLvx-p15-Flag病毒液,以相应稀释倍数(100,10-1,10-3)稀释病毒液,每孔加入300 μL,感染293T细胞72 h后,在倒置荧光显微镜下观察,并计数绿色荧光细胞数,计算慢病毒滴度。病毒滴度(TU/mL)=绿色荧光细胞数量×病毒液稀释倍数/病毒液体积。
1.6 plvx-p15-Flag质粒的慢病毒感染及目的蛋白表达的鉴定
将293T细胞、LMH细胞接种于6孔细胞培养板中,每孔约120万个细胞,待细胞生长至80%~90%密度时,可用于感染。将冻存于-70 ℃的病毒上清液于室温融解,按照1 000∶1的比例与polybrene混合感染293T细胞和LMH细胞。每隔24 h于显微镜下观察。
1.6.1 激光共聚焦检测p15蛋白表达
LMH细胞接种于细胞飞片上,达到90%密度用于慢病毒感染,感染后培养至绿色荧光细胞数目达30%~40%。取出细胞飞片用4%多聚甲醛固定细胞10 min,0.25%的Triton X-100破膜作用约5 min,再使用1% BSA(含有1%~2%的山羊血清)于37 ℃下封闭30 min,PBS洗3遍。一抗使用兔源抗Flag多克隆抗体(1∶100稀释)37 ℃下作用45 min,二抗使用山羊抗兔IgG Alexa 594荧光二抗(1∶1 000稀释)37 ℃孵育35 min,染核使用1 μg /mL的Hoechst 33342,室温下作用5~8 min,用适量50%甘油封片,置于共聚焦荧光显微镜下观察。
1.6.2 Western blot检测p15蛋白的表达
向感染细胞中加入RIPA细胞裂解液(含1 mmol/L 蛋白酶抑制剂),置于冰上裂解,每10 min涡旋1次,共30 min,裂解后13 000 r/min离心15 min 收取细胞蛋白,经BCA定量后,进行SDS-PAGE蛋白分析。转膜完成后进入Western blot反应,一抗使用1 ∶2 000稀释的兔源抗Flag多克隆抗体,二抗使用1∶30 000稀释的HRP(辣根过氧化物酶)标记山羊抗兔IgG。最终使用ECL显色液进行显色分析。
1.6.3 实时荧光定量PCR检测病毒感染细胞中p15基因表达情况
将慢病毒感染293T、LMH细胞,待感染出现特异性荧光时,采用Axygen试剂盒提取细胞总RNA,按照Takara反转录试剂盒说明进行反转录,每个样品的反应体系为10 μL,5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,模板RNA 1 μg,42 ℃ 2 min;之后再每管加入PrimerScript RT Enzyme Mix 1 μL,RT Primer Mix 1 μL,5× PrimerScript Buffer2缓冲液4 μL,RNase free dH2O 4 μL,总体系20 μL,混匀后37 ℃ 15 min,85 ℃ 5 s,-20 ℃保存。以反转录cDNA作为模板,利用qRT-PCR检测细胞中p15表达水平,相关引物序列见表1。反应体系如下:SYBR Premix ExTaqⅡ 10 μL,cDNA 2 μL,Forward Primer和Reverse Primer(10 μmol/L)各0.8 μL,Rox Reference DyeⅡ 0.4 μL,添加RNase free dH2O至总体积20 μL;反应程序为95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;最后阶段为95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个样本独立做3个重复孔。

表1 qRT-PCR检测引物序列
1.7 数据的统计学分析
每个试验样本做3次独立重复,所有数据使用GraphPad Prism 8软件进行统计,分析不同试验样本的显著性差异变化。
2 结果
2.1 慢病毒表达质粒的构建与鉴定
利用设计的引物进行p15基因的PCR扩增,反应产物进行核酸电泳鉴定,在372 bp处可见目的条带(图1A)。p15双酶切后连接于载体质粒,将连接产物转化至DH5ɑ感受态细胞中,从单菌落培养物中抽提质粒,双酶切后用于核酸电泳鉴定,条带大小正确(图1B)。
2.2 慢病毒滴度测定结果
接种293T细胞于12孔细胞培养板,每孔细胞数约为9×105个,不同稀释倍数下病毒液感染细胞,通过荧光细胞计数,在10-3稀释度下绿色荧光细胞数目约为25%。计算可得慢病毒的病毒液滴度值约为9×105×25%×10-3/0.001=2.25×105TU/mL。试验结果表明,产生的慢病毒具有高效的细胞感染能力。
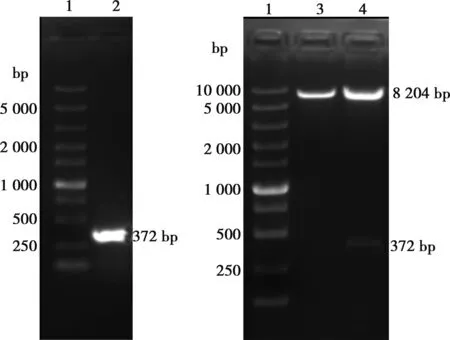
A.p15基因PCR产物;B.双酶切核酸电泳鉴定;1.Marker;2.p15基因的PCR产物;3.双酶切后pLVX-IRES-ZsGreen1空载体;4.双酶切含p15基因的骨架质粒plvx-p15-Flag图1 p15基因的PCR扩增及慢病毒骨架质粒的双酶切鉴定

A、B、C.慢病毒稀释倍数依次为1、101、103图2 不同稀释度的plvx-p15-Flag慢病毒感染293T细胞后GFP荧光表达(200×)
2.3 293T细胞中p15蛋白表达情况
慢病毒液感染细胞后,可以观察到特异性荧光,随着感染时间延长,孔内特异性细胞数目逐渐增多(图3A)。收集感染0 h,48 h,72 h,96 h的293T细胞RNA进行qRT-PCR检测p15基因的表达情况。结果显示,p15基因表达随着感染时间延长而不断升高(图3B);同时收集不同时间点的细胞蛋白进行免疫印迹,结果显示,病毒感染48 h、72 h和96 h均可检测出p15蛋白的表达(图3C)。
2.4 病毒感染LMH细胞中p15表达水平检测
接种LMH细胞于12孔细胞板,培养过夜。次日,按照1.6所述方法感染细胞,每24 h观察一次特异性荧光,并收集细胞RNA,用于qRT-PCR检测p15基因表达水平,检测结果显示随着感染时间延长,p15表达量显著上升(图4A)。可见慢病毒感染禽源LMH细胞可以高效表达外源基因。待感染组细胞自发荧光数目达到40%以上时,加入RIPA细胞裂解液,收集蛋白用于Western blot验证,结果显示病毒感染LMH细胞72和96 h可以检测出p15蛋白目的条带(图4B),病毒感染后96 h的共聚焦荧光观察结果也证实p15蛋白主要在病毒感染胞浆中表达(图4C)。

A.不同感染时间点特异性荧光细胞数目观察;B.qRT-PCR检测不同感染时间点p15基因表达情况;C.蛋白免疫印迹检测病毒感染后p15蛋白表达水平;*为P<0.05,**为P<0.01,***为P<0.001。下同图3 plvx-p15-Flag感染293T细胞中的基因和蛋白的表达

A.qRT-PCR检测慢病毒感染LMH细胞后不同感染时间点p15基因表达(*为P<0.05;**为P<0.01;***为P<0.001);B.蛋白免疫印迹检测p15的蛋白表达情况;C.慢病毒感染LMH细胞中p15蛋白表达及定位(红色荧光为Flag蛋白,绿色荧光为ZsGreen蛋白,双色荧光重合细胞为感染成功的LMH细胞)图4 plvx-p15-Flag感染LMH细胞中目的基因和蛋白的表达
3 讨论
在ALV的多个亚群中,不同亚群致病力有显著性差异[14],其中J亚群既可水平传播又可垂直传播,致病力最强,对肉鸡和蛋鸡危害严重[15-16],主要体现在致肿瘤和免疫抑制两个方面,给养禽业造成巨大的经济损失。近年来,国内外科学家对于禽白血病致病机理开展了大量研究工作,但对于病毒的致病机制仍知之甚少。
ALV-J基因组的编码区形成3个大的开放阅读框[17],其gag片段编码的衣壳蛋白p27是主要的群特异性抗原,现在已经作为疾病检测抗原被广泛认可[18]。对同为衣壳蛋白的p15蛋白酶的研究鲜有报道,通过比对A、B、E、J、K等多个亚群不同来源毒株的p15基因序列,发现其同源性在95%以上,其发挥怎样的生物学功能还未知。HIV作为典型的反转录病毒,其结构蛋白中也有类似p15蛋白酶的p6蛋白酶,仅有52个氨基酸,且Schmalen等[19]研究表明,HIV-1 p6对胰岛素降解酶(IDE)介导的降解的敏感性与p6的N端氨基酸有关,可通过N端的脯氨酸残基来阻止HIV-1 p6蛋白被IDE降解,p6稳定表达后可明显发现HIV-1复制能力降低且依赖于Env[20],而且其N端氨基酸的突变很大程度上决定了HIV在人和猩猩之间的传播[21]。从HIV-1 p6蛋白酶研究中获得启示,成熟的ALV-J p15蛋白在病毒复制、疾病的发生发展过程中发挥一定的作用与功能,但目前关于p15的研究工具十分匮乏,故本研究利用慢病毒载体可以高效表达外源基因的特点,首次构建ALV-J p15基因的慢病毒表达载体,并按照比例包装成为慢病毒感染系统,共聚焦免疫荧光、qRT-PCR和Western blot检测结果均证实,该系统可有效地介导p15基因在LMH细胞内表达。经蛋白定位的共聚焦荧光观察可明显发现p15蛋白主要在胞浆中表达,使用qRT-PCR可在48 h检测到LMH细胞中表达的p15基因,但在48 h的Western blot检测结果中却未见p15蛋白条带,这可能是由于人源启动子在禽源细胞中识别、表达缓慢造成的。下一步研究中,计划构建一株可稳定表达p15蛋白的LMH细胞系,在这种细胞模型基础上,研究p15蛋白的生物学功能,将十分便捷和高效。
综上所述,本试验成功构建了表达p15基因的慢病毒表达载体,这一工具将有助于揭示p15蛋白在ALV感染复制、免疫抑制以及相关免疫学信号通路中发挥的重要作用及其机制。
