添加乳酸菌对苜蓿青贮过程中总黄酮提取率、β-葡萄糖苷酶活性及主要黄酮苷元含量的影响
2021-04-13张嘉宾李苗苗靳思玉王立超黄秋连张爱忠
张嘉宾 李苗苗 靳思玉 王立超 周 昕 黄秋连 王 健 张爱忠 曹 阳
(黑龙江八一农垦大学动物科技学院,粮食副产物加工与利用教育部工程研究中心,黑龙江省寒区饲料资源高效利用与营养调控重点实验室,大庆163319)
苜蓿(MedicagosativaL.)为豆科苜蓿属多年生草本植物,营养丰富,常作为草食家畜重要的高蛋白质粗饲料,同时还因生物活性次级代谢产物含量高在诸多领域(医学、美容、农业等)备受青睐[1-2]。苜蓿中含有多种生物活性物质,其中黄酮是苜蓿主要的活性成分,黄酮在植物体内以糖苷和苷元2种形式存在,其中黄酮糖苷占总黄酮含量的97%左右,黄酮糖苷作为一类大分子物质,不易渗入上皮细胞,难以被机体胃肠道直接吸收,其生物利用率相应降低。通过一定技术手段将黄酮糖苷经去糖基反应转化为功能活性更高且可被机体直接吸收的苷元形式从而提高其利用率。研究证明,黄酮苷元具有抗炎抗菌、抗氧化、抗肿瘤、调节脂肪代谢及雌激素样等多种生理活性[3]。所以探索高黄酮提取率的苜蓿青贮技术,为家畜饲养提供功能性苜蓿青贮饲料、对家畜养殖中减少药物使用、为人类提供安全健康的畜产品具有重要意义。在苜蓿青贮中乳酸菌的添加导致多种活性物含量显著上升,包括多种游离氨基酸和多元醇[4],乳酸菌发酵法可使黄酮类化合物结构和组分发生改变,由糖苷转变为苷元形式[5]。多种动物试验表明,黄酮苷元的吸收程度远高于糖苷形式,因此结构的转变能促进其更好地发挥抗氧化和生物活性[6]。目前国内在苜蓿黄酮糖苷脱糖基转化成苷元方面的研究较少,主要集中于银杏及大豆异黄酮生物转化的研究。王洋等[7]报道,添加不同植物乳酸菌均能使苜蓿中黄酮提取率显著提高,其中以植物乳酸杆菌的效果尤为明显。黄酮生物转化酶主要包括β-葡萄糖苷酶、β-半乳糖苷酶和α-半乳糖苷酶[8],目前研究最多的为β-葡萄糖苷酶,除优越的生物转化功能外,β-葡萄糖苷酶还是重要的增香酶,它能通过催化水解芳香基和烃基原子团之间的糖苷键断裂产生葡萄糖和对应配基,从而释放芳香因子,常应用于食品工业果酒增香等[9]。因此,本试验拟通过分析苜蓿青贮过程中发酵品质、总黄酮提取率、β-葡萄糖苷酶活性及主要黄酮苷元含量,研究添加乳酸菌对苜蓿青贮过程中总黄酮提取率的影响,分析苜蓿总黄酮提取率与发酵产物的关系,明确苜蓿青贮过程中总黄酮提取率的影响因素,探索减少苜蓿青贮中黄酮损失的青贮调制技术。
1 材料与方法
1.1 苜蓿及添加剂制备
苜蓿于初花期刈割,颜色为绿色,茎叶分明,由黑龙江省蓬勃牧草有限公司提供,预干至含水量约50%并切碎至1~2 cm作为青贮原料,其常规化学成分见表1。试验选用的乳酸菌制剂为日本国立畜产研究所提供的植物乳杆菌Master-LP(Lactobacillusplantarum,日本雪印种苗株式会社生产),使用方法和剂量依据其包装说明书,青贮原料中菌剂浓度为25 mg/kg,活菌数105CFU/g以上。

表1 青贮原料常规化学成分(干物质基础)
1.2 试验设计
采用双因素(添加×时间)完全随机试验设计,将苜蓿原料分别进行乳酸菌添加及无添加处理(对照),添加乳酸菌是将菌粉与无菌水以1∶400比例混合制备成菌液,并以菌液形式按1∶100添加于青贮原料中,菌剂最终添加量为0.002 5%,活菌数为105CFU/mL。称取200 g以上处理的样品装入聚乙烯袋(16 cm×25 cm),使用真空包装机(AT-620;Jodpack Co.,Ltd.,北京)真空密封,每个处理50个重复,置于避光处贮藏,贮藏温度为(24±2) ℃,经过0、1、3、5、7、15、22、39、46、53、60、67、74 d发酵后,各处理分别开封3袋,进行相关指标的测定。
1.3 化学成分及发酵品质
根据AOAC[10](1990)中的方法,通过电热恒温鼓风干燥箱(DGG-920B,上海森信实验仪器有限公司)测定干物质(DM)含量;茂福炉(SX2-4-10,天津中环实验电炉有限公司)测定有机物(OM)含量;利用凯氏定氮仪(K1100F,济南海能仪器股份有限公司)测定粗蛋白质(CP)、总氮含量;利用索氏提取器测定粗脂肪(EE)含量。中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量通过纤维分析仪(ANKOM A200i,美国安康)依据Van Soest等[11]的方法进行分析。根据冯宗慈等[12]的分光光度计法,利用紫外可见分光光度计(UV-6100A,上海元析仪器有限公司)测定氨态氮的含量。
取20 g苜蓿青贮样品装入聚乙烯袋中,并加180 mL灭菌蒸馏水,利用均质器(BagMixer-400VW;Interscience,法国)拍打90 s使袋中样品充分混合制成青贮浸提液。采用便携式pH计(FG-2;Mettler Toledo,上海)测定青贮浸提液pH。取袋中部分混合液用4层纱布过滤,所获得滤液经高速低温离心机(6 500×g,4 ℃)离心5 min,再经0.45 μm滤膜过滤,利用高效液相色谱仪(HPLC;JascoCorp,日本)分析测定乳酸、乙酸、丙酸及丁酸的含量。
1.4 总黄酮提取率
参照刘香萍等[13]的方法,采用超声波辅助法提取苜蓿青贮样品所含黄酮类化合物。以纵坐标为吸光度(A),横坐标为芦丁质量浓度(C,mg/g)绘制标准曲线,本试验标准曲线为Y=12.06X+0.011(R2=0.999 9)。取2 mL提取液测定510 nm处吸光度,按照标准曲线计算苜蓿总黄酮提取率:
总黄酮提取率(mg/g)=(C×N×V)/m。
式中:C为曲线质量浓度(mg/mL);N为提取液稀释倍数;V为最初提取液定容体积(mL);m为样品质量(g)。
1.5 β-葡萄糖苷酶活性
参考Funamoto等[14]和Kaewsuksaeng等[15]的方法制得酶粗提液,使用酶联免疫吸附试验(ELISA)试剂盒(上海源叶生物科技有限公司)对酶粗提液进行β-葡萄糖苷酶活性的测定。
1.6 槲皮素、山奈酚、异鼠李素含量
根据黄宁[16]的方法分析槲皮素、山奈酚、异鼠李素的含量。本试验采用高效液相色谱仪对苜蓿青贮中3种黄酮苷元含量进行定量分析。试验参照党亚锋等[17]方法,色谱条件:c18硅胶柱(4.6 mm×250 mm,5 μm);柱温25 ℃;流动相,乙腈:0.25%磷酸水溶液(50∶50);检测波长360 nm;进样量10 μL;单次分析时间10 min。
1.7 数据统计分析
试验数据经Excel 2010整理,根据双因素完全随机设计模型,使用SAS 9.0的GLM程序分析数据:
Yijl=μ+αi+βj+(α×β)ij+eijl。
式中:Yijl代表青贮发酵品质;μ为总体平均值;αi为添加处理i(i=1,2)的效应;βj为发酵时间处理j(j=0,1,3,5,7,15,22,39,46,53,60,67,74)的效应;(α×β)ij为添加处理与发酵时间处理的互作效应;eijl为试验误差。采用Tukey法鉴定比较均值差异显著性(P<0.05)。
采用SPSS Statistics 21软件对有机酸含量、总黄酮提取率进行相关性分析,P<0.05为显著水平,P<0.01为极显著水平;采用中线性回归分析程序逐步回归分析,在P<0.05水平下,建立回归方程。
2 结 果
2.1 添加乳酸菌对苜蓿青贮常规化学成分的影响
由表2可知,随着发酵时间延长,粗脂肪含量呈现逐渐增加的趋势,干物质、有机物、粗蛋白质、酸性洗涤纤维、中性洗涤纤维含量均呈现逐渐降低的趋势。添加乳酸菌组干物质含量在发酵第0、1、3、15、22、39、60、74天显著高于对照组(P<0.05),有机物含量在第3、5、39、46、74天显著高于对照组(P<0.05),粗蛋白质含量在第22、46、53、60、67、74天显著高于对照组(P<0.05),粗脂肪含量在第1、3、5、7、15、22、46、53天显著高于对照组(P<0.05),添加及时间处理在各指标上均表现出显著的交互作用(P<0.05)。

表2 添加乳酸菌对苜蓿青贮常规化学成分的影响(干物质基础)
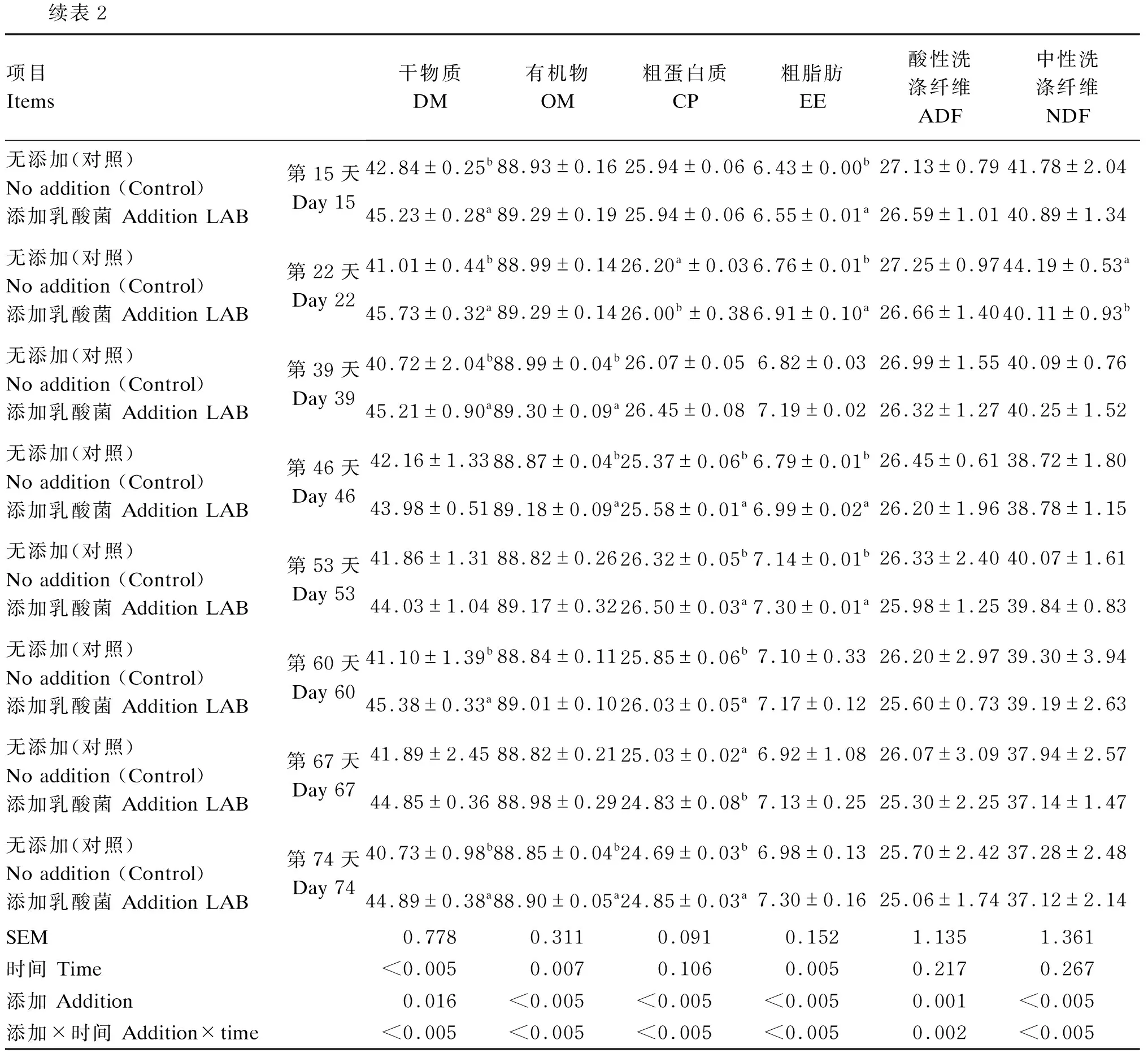
续表2项目 Items干物质DM有机物OM粗蛋白质CP粗脂肪EE酸性洗涤纤维ADF中性洗涤纤维NDF无添加(对照) No addition (Control)添加乳酸菌 Addition LAB第15天Day 1542.84±0.25b88.93±0.1625.94±0.066.43±0.00b27.13±0.7941.78±2.0445.23±0.28a89.29±0.1925.94±0.066.55±0.01a26.59±1.0140.89±1.34无添加(对照) No addition (Control)添加乳酸菌 Addition LAB第22天Day 2241.01±0.44b88.99±0.1426.20a±0.036.76±0.01b27.25±0.9744.19±0.53a45.73±0.32a89.29±0.1426.00b±0.386.91±0.10a26.66±1.4040.11±0.93b无添加(对照) No addition (Control)添加乳酸菌 Addition LAB第39天Day 3940.72±2.04b88.99±0.04b26.07±0.056.82±0.0326.99±1.5540.09±0.7645.21±0.90a89.30±0.09a26.45±0.087.19±0.0226.32±1.2740.25±1.52无添加(对照) No addition (Control)添加乳酸菌 Addition LAB第46天Day 4642.16±1.3388.87±0.04b25.37±0.06b6.79±0.01b26.45±0.6138.72±1.8043.98±0.5189.18±0.09a25.58±0.01a6.99±0.02a26.20±1.9638.78±1.15无添加(对照) No addition (Control)添加乳酸菌 Addition LAB第53天Day 5341.86±1.3188.82±0.2626.32±0.05b7.14±0.01b26.33±2.4040.07±1.6144.03±1.0489.17±0.3226.50±0.03a7.30±0.01a25.98±1.2539.84±0.83无添加(对照) No addition (Control)添加乳酸菌 Addition LAB第60天Day 6041.10±1.39b88.84±0.1125.85±0.06b7.10±0.3326.20±2.9739.30±3.9445.38±0.33a89.01±0.1026.03±0.05a7.17±0.1225.60±0.7339.19±2.63无添加(对照) No addition (Control)添加乳酸菌 Addition LAB第67天Day 6741.89±2.4588.82±0.2125.03±0.02a6.92±1.0826.07±3.0937.94±2.5744.85±0.3688.98±0.2924.83±0.08b7.13±0.2525.30±2.2537.14±1.47无添加(对照) No addition (Control)添加乳酸菌 Addition LAB第74天Day 7440.73±0.98b88.85±0.04b24.69±0.03b6.98±0.1325.70±2.4237.28±2.4844.89±0.38a88.90±0.05a24.85±0.03a7.30±0.1625.06±1.7437.12±2.14SEM0.778 0.3110.0910.1521.1351.361时间 Time<0.0050.0070.1060.0050.2170.267添加 Addition0.016 <0.005 <0.005 <0.005 0.001<0.005添加×时间 Addition×time<0.005<0.005<0.005<0.0050.002<0.005
2.2 添加乳酸菌对青贮发酵品质的影响
由表3可知,苜蓿青贮pH随着苜蓿青贮发酵时间延长显著降低(P<0.05),乳酸、乙酸含量及氨态氮/总氮均显著上升(P<0.05);添加乳酸菌组pH在第15、39、60、74天显著低于对照组(P<0.05),除第0、3、5天外,其他发酵天数乳酸含量显著高于对照组(P<0.05);除第0、3、74天外,其他发酵天数乙酸含量显著高于对照组(P<0.05);第3、5、7、15、22、39、53天丙酸含量显著高于对照组(P<0.05),第3、7、15、46、53、60天氨态氮/总氮显著低于对照组(P<0.05);所有样品中均未检出丙酸和丁酸。添加及时间处理在各指标上均表现出显著交互作用(P<0.05)。
2.3 添加乳酸菌对苜蓿青贮总黄酮提取率、β-葡萄糖苷酶活性、3种黄酮苷元含量的影响
由表4可知,随着发酵时间的延长,总黄酮提取率、β-葡萄糖苷酶活性呈先升高后降低的趋势,槲皮素、山奈酚、异鼠李素含量均显著上升(P<0.05);在整个发酵过程中,添加乳酸菌组的总黄酮提取率显著高于对照组(P<0.05),β-葡萄糖苷酶活性在第3、5、53天显著高于对照组(P<0.05),槲皮素含量在整个发酵过程均显著高于对照组(P<0.05),山奈酚含量除第1、15、22、46、67天外,其他天数均显著高于对照组(P<0.05),异鼠李素含量除第0、1、5、15天外,其他天数均显著高于对照组(P<0.05);添加及时间处理在各指标上均表现出显著交互作用(P<0.05)。
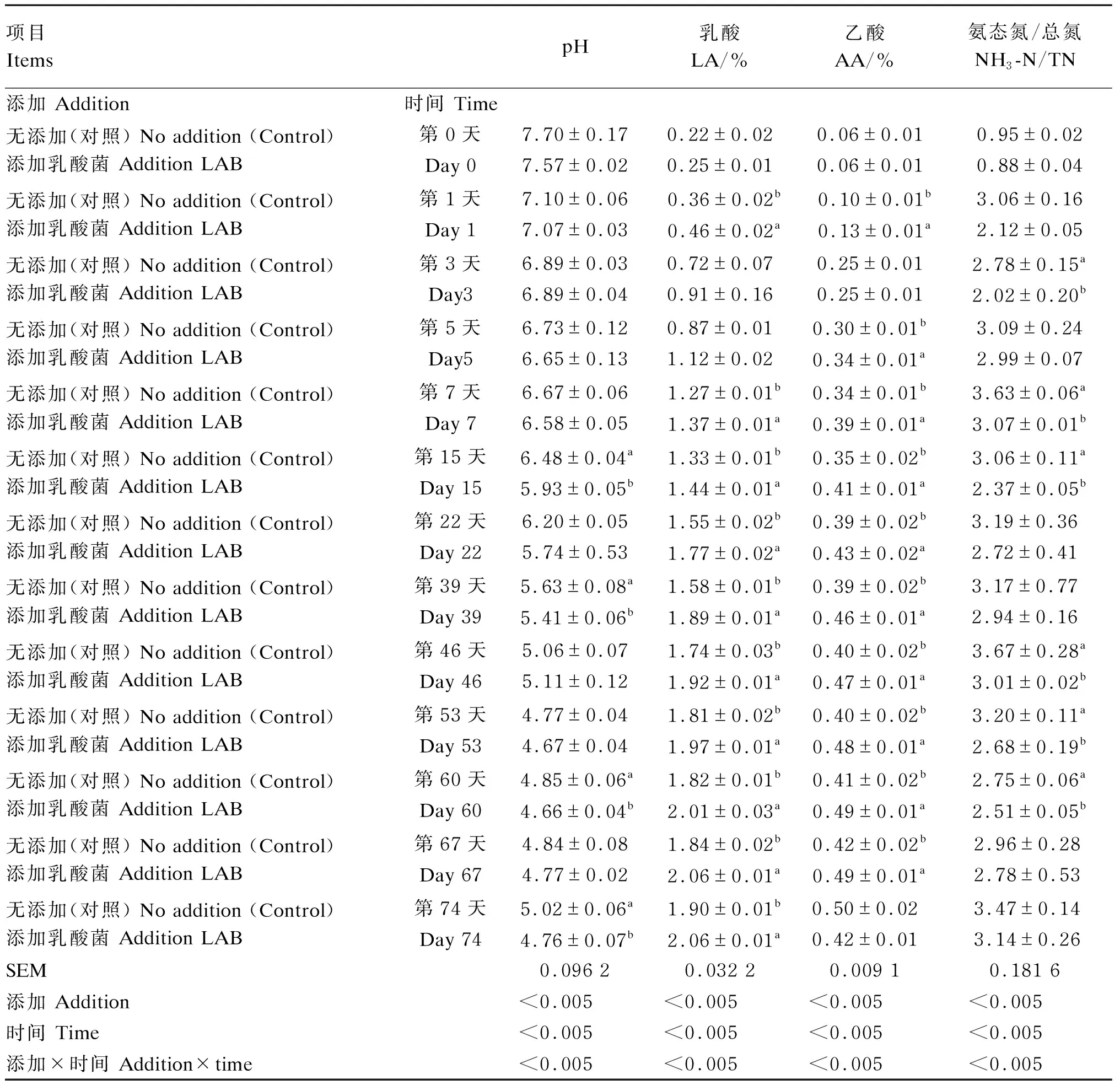
表3 添加乳酸菌对苜蓿青贮发酵品质的影响
2.4 总黄酮提取率与发酵产物的关系
由表5可知,总黄酮提取率与pH存在极显著负相关性(P<0.01),与乳酸含量存在极显著正相关性(P<0.01),与乙酸含量存在显著正相关性(P<0.05)。
2.5 总黄酮提取率、主要苷元的回归分析
选用处理(X1,对照组=0,LAB组=1)和天数(X2)为自变量,以总黄酮提取率(mg/g)为因变量(Y),建立回归方程:Y=4.958+0.692X1+0.022X2,其中,样本量n=3,相关系数R=0.733,添加和时间处理均对总黄酮提取率有极显著影响(P<0.01)。
选用处理(X1,对照组=0,LAB组=1)和天数(X2)为自变量,以槲皮素含量(μg/mL)为因变量(Y),建立回归方程为:Y=15.925X1+0.244X2-7.365,其中,样本量n=3,相关系数R=0.840,添加和时间处理均对槲皮素含量有极显著影响(P<0.01)。
选用处理(X1,对照组=0,LAB组=1)和天数(X2)为自变量,以异鼠李素含量(μg/mL)为因变量(Y),建立回归方程为:Y=1.669X1+0.174X2+1.564,其中,样本量n=3,相关系数R=0.982,添加和时间处理均对异鼠李素含量有极显著影响(P<0.01)。
选用处理(X1,对照组=0,LAB处理组=1),天数(X2)为自变量,以山奈酚含量(μg/mL)为因变量(Y),建立回归方程为:Y=55.338X1+3.489X2+157.752,其中,样本量n=3,相关系数R=0.842,添加和时间处理均对异鼠李素含量有极显著影响(P<0.01)。
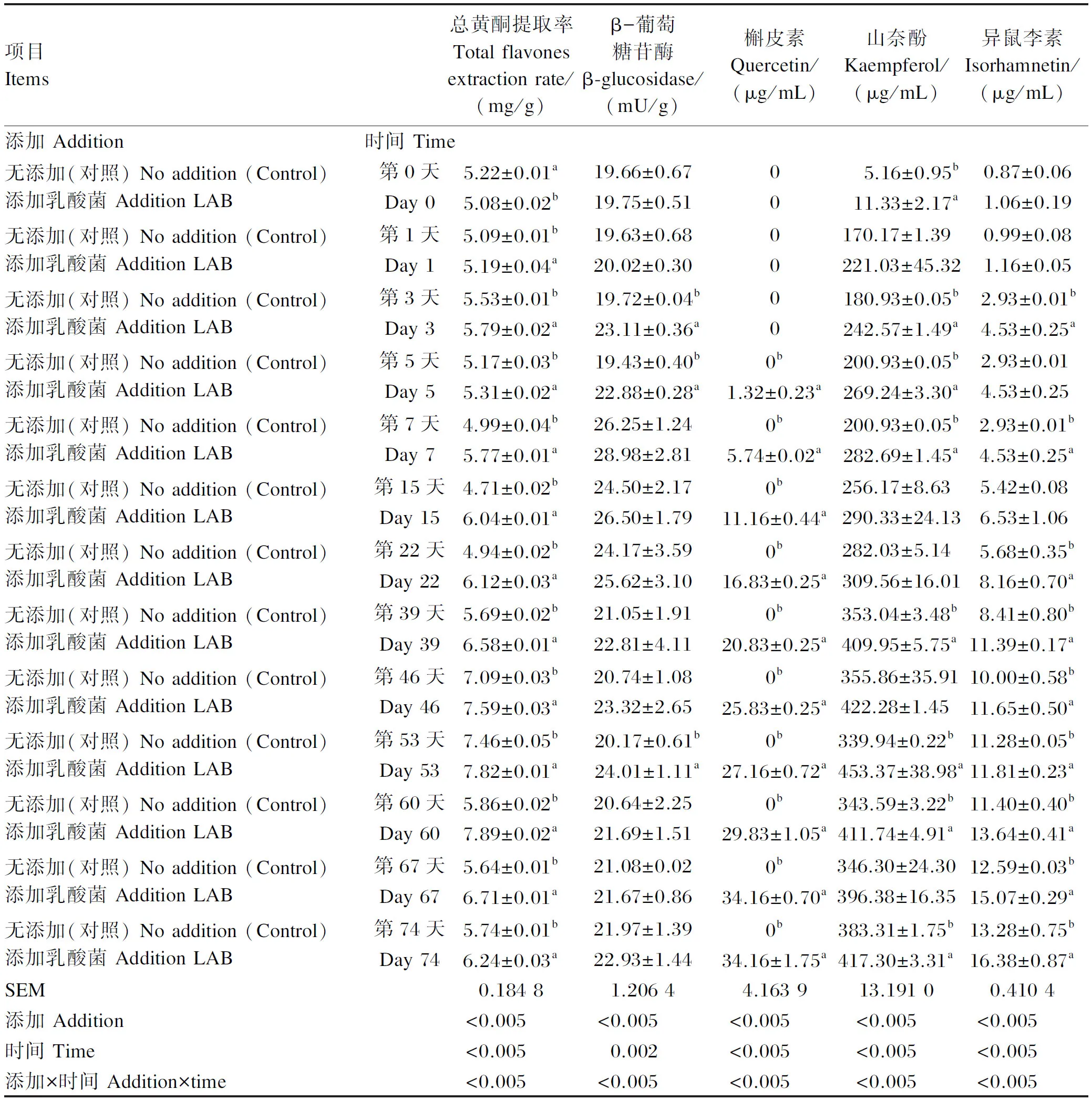
表4 添加乳酸菌对苜蓿青贮总黄酮提取率、β-葡萄糖苷酶活性、主要苷元含量的影响

表5 总黄酮提取率与pH及有机酸含量的相关性分析
3 讨 论
3.1 添加乳酸菌对青贮发酵品质的影响
氨态氮含量反映了青贮饲料蛋白质降解程度,被广泛应用于衡量青贮饲料发酵品质的好坏,其比值越大,说明被分解的氨基酸和蛋白质越多,青贮效果越差[18]。本研究中,添加乳酸菌组青贮的pH、氨态氮/总氮显著降低,乳酸、乙酸、丙酸含量显著增加;随着发酵时间延长,pH逐渐显著降低,氨态氮/总氮及乳酸、乙酸、丙酸含量均逐渐显著增加。王木川等[19]通过比较多种添加剂对苜蓿青贮品质,发现植物乳杆菌添加降低了苜蓿青贮的pH、氨态氮/总氮,提高了乳酸、乙酸含量,同时添加乳酸菌组未检出丁酸。王丽学等[20]比较植物乳杆菌、片球菌和芽孢杆菌对苜蓿青贮发酵品质及营养成分的影响,发现植物乳杆菌能显著降低pH,显著提高乳酸含量。
3.2 添加乳酸菌对苜蓿青贮总黄酮提取率的影响
类黄酮是苜蓿含有的主要活性生物成分之一,其含量受光照、温度、土壤及空气条件、生物因素的影响,苜蓿青贮中黄酮含量受发酵过程及添加剂的影响[21]。本研究中,乳酸菌的添加显著提高了苜蓿青贮总黄酮提取率,随着发酵时间的延长总黄酮提取率呈先升高后降低的趋势。pH与总黄酮提取率存在极显著负相关性,随着乳酸菌的添加和发酵天数的延长pH下降,总黄酮提取率也逐渐上升;乳酸、乙酸的逐渐产生也会造成pH的下降,所以乳酸、乙酸含量对总黄酮提取率存在显著正相关性。王洋等[7]分别以植物乳杆菌、干酪乳杆菌及戊糖片球菌为添加剂制作苜蓿青贮,分别在30、60 d测定总黄酮提取率,结果表明3种乳酸菌的添加均能显著提高苜蓿总黄酮提取率,其中植物乳杆菌添加效果最明显,同时各添加组60 d黄酮提取率均高于或等于30 d。姜义宝等[22]在苜蓿青贮中添加植物乳杆菌,分别在3、5、7、15、30、60 d测定总黄酮提取率,研究发现随着苜蓿青贮发酵时间延长总黄酮提取率逐渐增加,除3 d外其余发酵天数植物乳杆菌添加组黄酮提取率均高于对照组。
3.3 添加乳酸菌对苜蓿青贮β-葡萄糖苷酶活性的影响
β-葡萄糖苷酶是重要的纤维素水解酶,能水解类黄酮糖苷键将化合态黄酮糖苷转化为可被动物吸收利用的游离态黄酮苷元,常应用于类黄酮的生物转化。本研究中,乳酸菌的添加能显著提高β-葡萄糖苷酶活性,同时随着发酵时间的延长,β-葡萄糖苷酶活性呈现先升高后降低的趋势。曾子毅等[23]研究发现,5株植物乳杆菌均具有产β-葡萄糖苷酶特性,其酶活性为4.630~14.168 U/g。Donkor等[24]研究发现,嗜酸乳杆菌、乳酸双歧杆菌及干酪乳杆菌发酵大豆均能产生β-葡萄糖苷酶。因此,β-葡萄糖苷酶的活性在一定程度上与乳杆菌数量成正比,这与本试验结果一致。
3.4 添加乳酸菌对苜蓿青贮3种黄酮苷元含量的影响
黄酮类化合物的主要活性形式苷元仅占总黄酮含量的3%左右,因此将黄酮由结合态糖苷转化为游离态苷元的技术手段尤为重要[25]。本研究中,添加乳酸菌显著提高了槲皮素、山奈酚、异鼠李素3种黄酮苷元含量。随着发酵时间的延长,槲皮素、山奈酚、异鼠李素含量呈逐渐上升趋势。赖婷等[26]分别以7种不同乳酸菌为添加剂对桂圆肉进行发酵,并检测发酵前后结合态与游离态黄酮含量比值,发现7种乳酸菌均能不同程度增加结合态与游离态黄酮含量比值,其中植物乳杆菌转换能力最强。Wei等[27]采用5株不同乳酸菌对豆乳进行发酵并检测发酵前后游离态黄酮苷元含量,发现结合态至游离态转化率高达62%~96%。李俶等[28]利用嗜热链球菌和保加利亚乳杆菌对南酸枣进行发酵,发现发酵后南酸枣中游离黄酮含量提高1.1倍。
4 结 论
综上所述,添加乳酸菌可以显著提高苜蓿青贮的发酵品质,发酵品质良好的苜蓿青贮可以提高总黄酮提取率、β-葡萄糖苷酶活性以及槲皮素、山奈酚和异鼠李素含量。
