饲喂初乳对新生羔羊肠道渗透性及黏附微生物组成的影响
2021-04-13田全华贺志雄谭支良
杨 超 田全华 阳 利 程 艳 贺志雄* 谭支良
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,畜禽养殖污染控制与资源化技术国家工程实验室,湖南省畜禽健康养殖工程技术研究中心,农业部中南动物营养与饲料科学观测实验站,动物营养生理与代谢过程湖南省重点实验室,长沙410125;2.中国科学院大学,北京100049;3.武汉工程大学环境生态与生物工程学院,武汉430205;4.湖南农业大学动物科学技术学院,长沙410128)
新生反刍动物在最初24~36 h内,其肠上皮为具有从初乳中吸收大分子物质能力的胎儿型肠上皮,营养物质主要通过渗透作用被胎儿吸收,对新生胎儿后期的生长发育有重要的影响[1-3]。有研究报道,新生反刍动物在出生48 h后,其肠道逐渐趋于“关闭状态”,肠上皮逐渐由具备吸收大分子营养物质能力的胎儿型肠上皮更新为不能通透大分子物质的成年型肠上皮[4]。
初乳除了含有丰富的脂肪、蛋白质、乳糖和矿物质等营养物质外,还含有免疫球蛋白、维生素、激素、生长因子、细胞因子和酶等生物活性物质,具有促进动物生长发育、完善其免疫功能的作用[5]。新生动物及时摄入足量的初乳会尽快建立自身被动免疫,从而降低肠道和呼吸系统疾病[6-7]。肠道微生物按其黏附位置的不同可分为食糜黏附微生物和组织黏附微生物,其中组织黏附微生物数量远低于食糜黏附微生物,但其对幼龄动物的影响比食糜黏附微生物更为重要[8]。据报道,初乳可调控新生反刍动物肠道发育和肠道微生物的定植过程,例如,新生犊牛在出生后12 h内饲喂初乳显著提高了其小肠黏膜中双歧杆菌属(Bifidobacterium)的相对丰度,并阻止了大肠杆菌(Escherichiacoli)的定植[9]。对新生动物而言,小肠段主要负责营养物质的吸收,其中初乳中大分子营养物质主要通过空肠段吸收[10]。因此,本试验拟选择新生羔羊空肠为研究对象,探究饲喂初乳对其肠道渗透性及其黏附微生物组成的影响,以期为新生羔羊初乳饲喂策略的完善及健康养殖提供理论依据。
1 材料与方法
1.1 试验动物及饲养管理
本试验选取初生重[(1.99±0.08) kg]相近、健康状况良好、未采食母体初乳的新生赣西黑山羊16只,随机分为2组(每组8只),分别饲喂代乳料(代乳料组)和初乳(初乳组)。代乳粉购自北京精准动物营养研究中心,其营养成分含量见表1。代乳料按照代乳粉和温水1∶5的比例进行配制,搅拌混匀至充分溶解后,室温晾至40 ℃并用奶瓶进行饲喂。由于山羊初乳收集难度较大,加之山羊初乳由于羊关节炎-脑炎(caprine arthritis-encephalitis,CAE)病毒的污染,被新生山羊摄入后会导致其高发病率和致死率[11-12]。为减少疾病发生率,生产中通常使用牛初乳来饲喂新生山羊作为免疫球蛋白的供体,从而抵御CAE初乳的感染[13]。本试验所用初乳收集自湖南省优卓牧业牧场的5头奶牛(分娩后24 h内),所有初乳充分混匀后进行饲喂,初乳中免疫球蛋白G(IgG)含量为15.43 mg/mL,具体营养成分含量见表1。
羔羊在出生后迅速与母羊分离,用碘伏在脐带处消毒,并使用干毛巾擦拭完身上黏液,称量其初生重并做记录。新生羔羊分组后单栏饲养,使用保温灯进行保暖,并在出生后2 h内喂完代乳料或初乳。饲喂前对奶瓶进行清洗和消毒,晾干后使用。饲喂前后用湿毛巾将羔羊口部周围擦拭干净。代乳料组羔羊出生后2 h内饲喂5%体重的代乳料,初乳组羔羊在出生后2 h内饲喂5%体重的牛初乳,初乳饲喂量参照Moretti等[10]的报道。为测定羔羊肠道渗透性,分别从2组新生羔羊中随机选取6只,在代乳料和初乳中分别添加0.5 g甘露醇和1.0 g乳果糖进行饲喂,甘露醇和乳果糖饲喂量及血液采集时间点参照Minuti等[14]的报道。所有羔羊在出生后12 h屠宰取样。
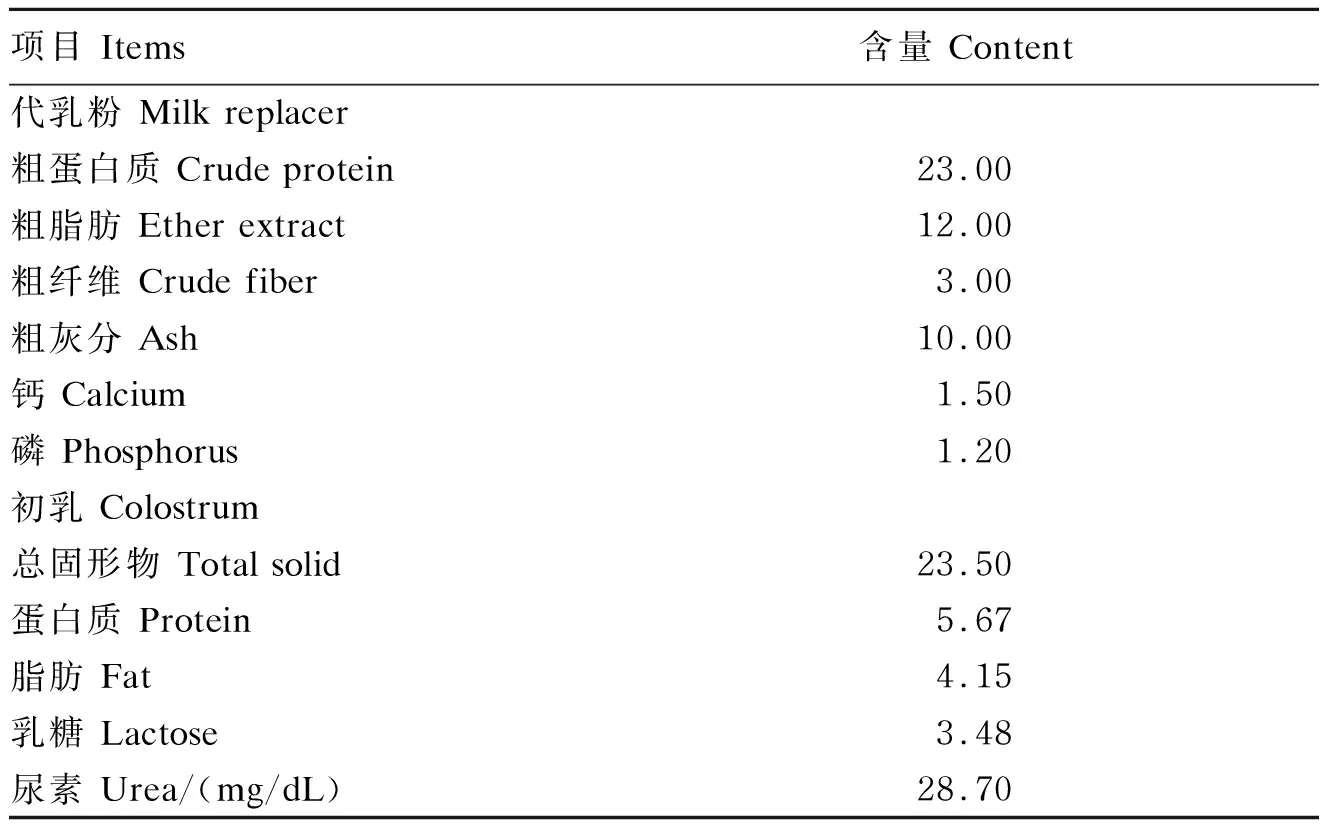
表1 代乳粉和初乳营养成分含量
1.2 样品采集
用于肠道渗透性检测的羔羊分别在喂完初乳或代乳料0、2、4、6、8、10 h时颈静脉采血,使用5 mL抗凝采血管收集血液,在室温下以3 000×g离心15 min分离血浆,置于-20 ℃保存用于后续肠道渗透性指标测定。所有羔羊经颈静脉放血致死后,迅速分离出空肠前段组织(距十二指肠5 cm处),截取1 cm×3 cm的组织块,用生理盐水冲洗干净内容物后置于-80 ℃保存,用于DNA提取。
1.3 肠道渗透性测定
将各时间点血浆样品在4 ℃融解后12 000 r/min离心10 min,吸取上清至新的1.5 mL离心管,随后取400 μL并加入25 μL内标蜜二水一糖溶液(80 μg/mL),再加入800 μL乙腈涡旋混匀,静置10 min以沉淀蛋白质;之后12 000 r/min离心10 min,小心吸取全部上清,并向沉淀中加入400 μL水,涡旋混匀后静置10 min,12 000 r/min离心10 min,吸取上清并将2次上清合并,使用离心浓缩仪(Christ RVC2-18 CD plus)浓缩离心至干。吸取300 μL衍生试剂(体积比为4∶1的吡啶-甲醇溶液,含有32 mg/mL盐酸羟胺和45 mg/mL 4-二甲氨基吡啶)加入衍生瓶,加盖密封后在75 ℃条件下加热30 min,其间振荡数次;冷却至室温后加入1 mL乙酸酐,密封后在75 ℃条件下再次加热20 min,待冷却至室温后加入1.5 mL二氯甲烷,充分振荡。最后清除过量的衍生试剂:1)加入1 mL 1 mol/L HCl,缓慢振荡30 s后移除水相,之后加入1 mL蒸馏水重复洗涤2次,在最后1次清洗过程中尽可能去除水相;2)剩余的有机相在40 ℃下离心浓缩挥干后,用200 μL的乙酸乙酯-正己烷混合溶剂(体积比为1∶1)溶解后,5 000 r/min离心5 min,转移全部上清至配有内插管的色谱进样瓶中,进行色谱-质谱分析。标准曲线配制方法、色谱条件及质谱图谱的数据读取等参照许丽卫等[15]的方法。
1.4 空肠黏附微生物多样性
空肠组织DNA提取使用动物组织DNA提取试剂盒(DP304,天根生化科技有限公司)进行,提取完成后在NanoDrop 2000上进行纯度和浓度测定,并使用琼脂糖凝胶(2%)电泳进行DNA完整性检测。采用细菌通用引物338F(引物序列为:5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(引物序列为:5′-GGACTACHVGGGTWTCTAAT-3′)对16S DNA“V3+V4”高度可变区进行PCR扩增。对上述PCR扩增产物进行纯化、定量和均一化后进行文库构建,质检合格的文库基于Illumina HiSeq 2500平台进行高通量测序。基于FLASH(v1.2.11)软件对测序得到的PE reads按照overlap长度进行拼接得到原始Tags,之后使用Trimmomatic(v0.33)和UCHIME(v4.2)软件对数据进行质控和过滤,区分样本后在相似度97%的水平上对序列进行操作分类单元(OTU)聚类分析和物种分类学分析。基于OTU对数据进行多样性分析,并基于分类学信息在门和属分类水平上对微生物组成进行统计分析。
1.5 数据统计与分析
血浆中甘露醇和乳果糖浓度变化相关指标的计算方法参照Fischer等[16]的报道,其中曲线下方正增量面积采用梯形法则进行计算,最大浓度变化量为最大浓度与初始浓度的差值。肠道形态学、渗透性指标以及微生物相对丰度等数据经Excel 2019进行初步整理后,采用SPSS 25.0软件的独立样本t检验进行统计学分析。试验结果以平均值和均值标准误表示,P<0.05表示差异显著。
2 结果与分析
2.1 肠道渗透性
代乳料组和初乳组新生羔羊血浆中甘露醇浓度随时间的变化趋势如图1所示,在各时间点2组新生羔羊血浆中甘露醇浓度无显著差异(P>0.05)。由表2可知,代乳料组新生羔羊血浆中甘露醇达到最大浓度的平均时间为3.67 h,最大浓度为2.80 μg/mL,最大浓度变化量为2.26 μg/mL,最大浓度与时间的比值为0.76;初乳组新生羔羊血浆中甘露醇达到最大浓度的平均时间为3.33 h,最大浓度为3.16 μg/mL,最大浓度变化量为2.69 μg/mL,最大浓度与时间的比值为0.95。2组新生羔羊血浆中甘露醇浓度变化相关指标[达到最大浓度的平均时间、最大浓度、最大浓度与时间的比值、2 h曲线下方正增量面积、6 h曲线下方正增量面积、10 h曲线下方正增量面积及最大浓度变化量]均无显著差异(P>0.05)。
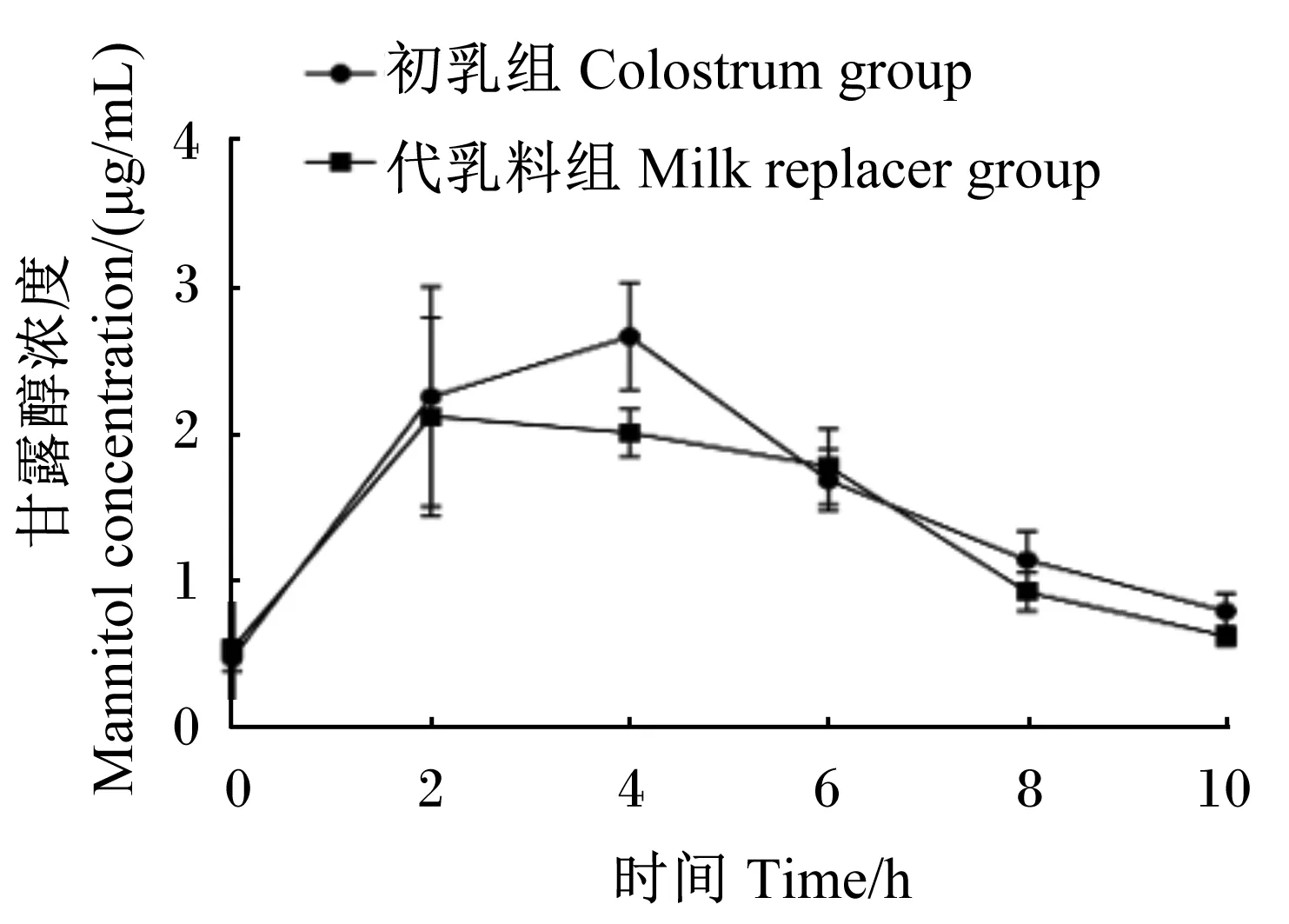
图1 新生羔羊血浆中甘露醇浓度变化
代乳料组和初乳组新生羔羊血浆中乳果糖浓度变化趋势如图2所示,在各时间点2组新生羔羊血浆中乳果糖浓度无显著差异(P>0.05)。由表3可知,代乳料组新生羔羊血浆中乳果糖达到最大浓度的平均时间为4.00 h,最大浓度为2.75 μg/mL,最大浓度变化量为2.27 μg/mL,最大浓度与时间的比值为0.69;初乳组新生羔羊血浆中乳果糖达到最大浓度的平均时间为5.00 h,最大浓度为2.02 μg/mL,最大浓度变化量为1.57 μg/mL,最大浓度与时间的比值为0.40。2组新生羔羊血浆中乳果糖浓度变化相关指标[达到最大浓度的平均时间、最大浓度、最大浓度与时间的比值、2 h曲线下方正增量面积、6 h曲线下方正增量面积、10h曲线下方正增量面积及最大浓度变化量]均无显著差异(P>0.05)。

表2 新生羔羊血浆中甘露醇浓度变化指标
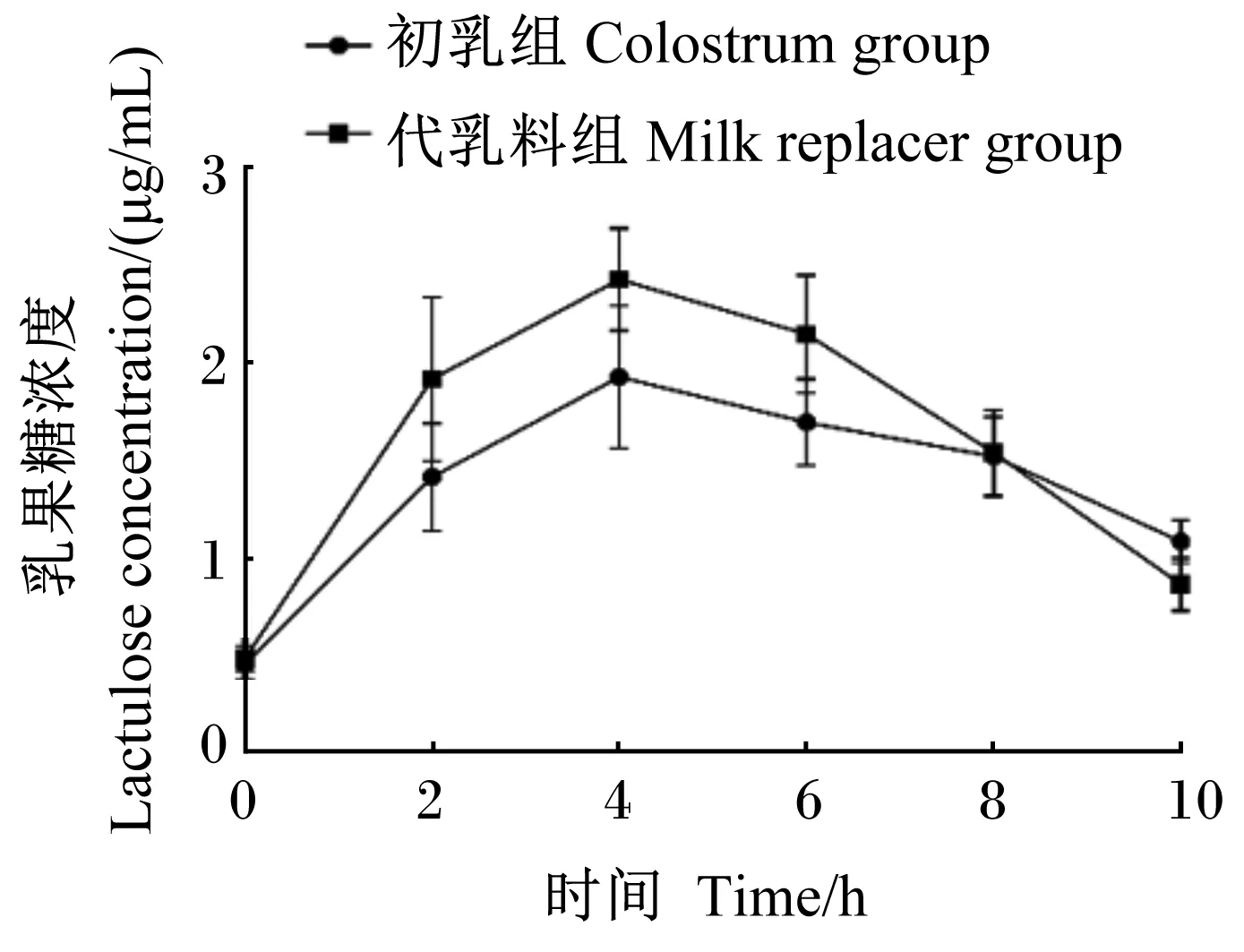
图2 新生羔羊血浆中乳果糖浓度变化
2.2 饲喂初乳对新生羔羊空肠黏附微生物组成的影响
2.2.1 α多样性分析
如表4所示,代乳料组与初乳组测序分别得到97%相似度的OTU 343.25和435.75个,差异不显著(P>0.05),测序样本覆盖度2组间差异也不显著(P>0.05)。基于OTU聚类结果进行α多样性分析,其中代乳料组ACE指数和Chao1指数低于初乳组,但2组间无显著差异(P>0.05);初乳组Shannon指数显著高于代乳料组(P<0.05),而Simpson指数显著低于代乳料组(P<0.05),表明饲喂初乳显著增加新生羔羊空肠黏附微生物多样性。
2.2.2 β多样性分析
β多样性分析结果可清晰显示不同组间样本微生物群落结构的差异。主坐标分析(PCoA)和非度量多维尺度(NMDS)分析2点间距离表示样本间微生物群落的相似程度,样本间距离越近,表明2个样本微生物组成相似性越高。如图3所示,2组样本未明显区分开,表明在OTU水平上代乳料组和初乳组新生羔羊的空肠黏附微生物群落组成相似性较高。
2.2.3 门水平上微生物组成
由表5可知,在门水平上变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)为两大优势菌门,二者之和在代乳料组和初乳组分别占总菌的81.43%和64.52%。初乳组新生羔羊空肠黏附微生物中变形菌门的相对丰度显著低于代乳料组(P<0.05),而厚壁菌门和Epsilonbacteraeota的相对丰度显著高于代乳料组(P<0.05)。
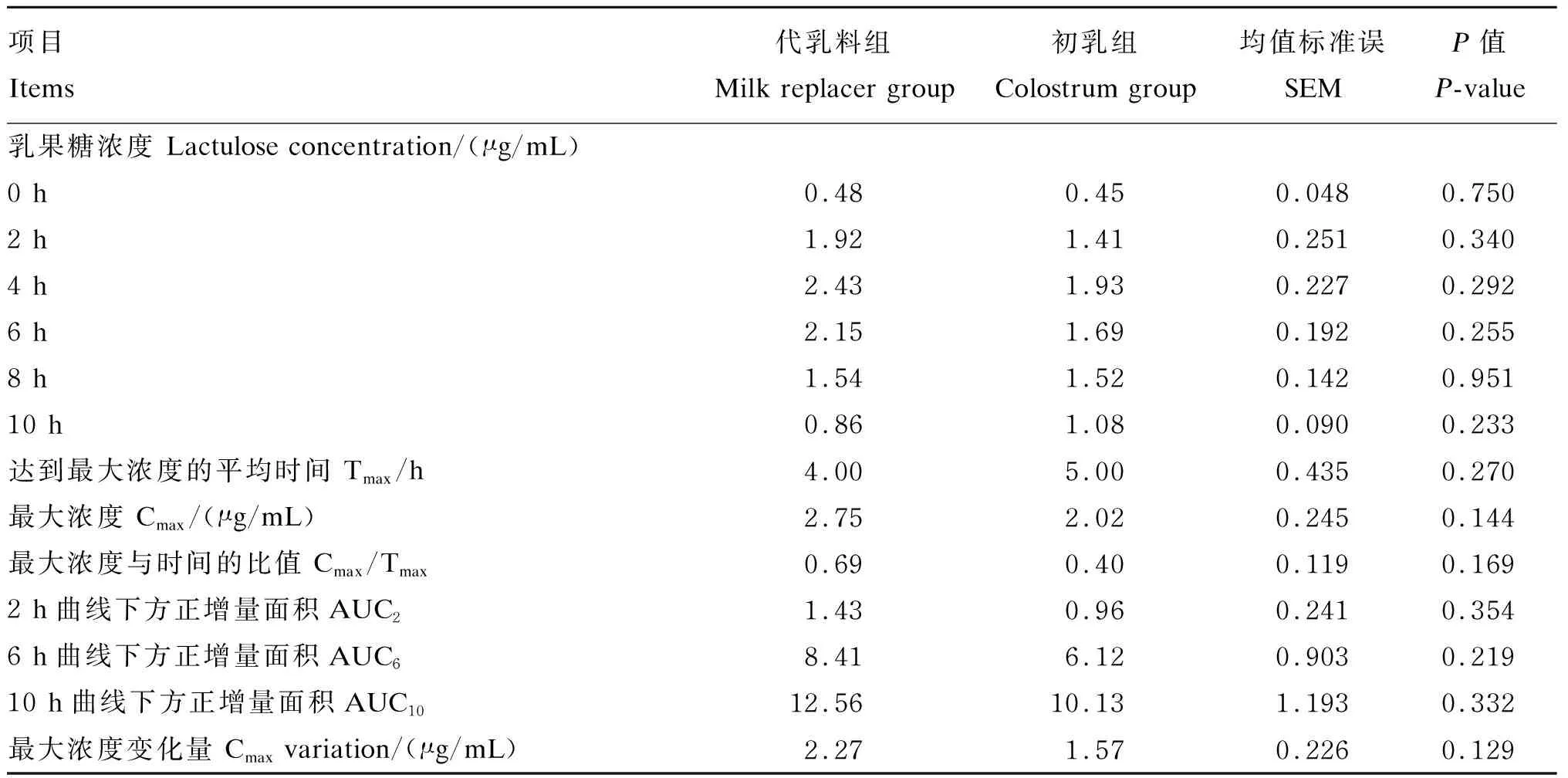
表3 新生羔羊血浆中乳果糖浓度变化指标
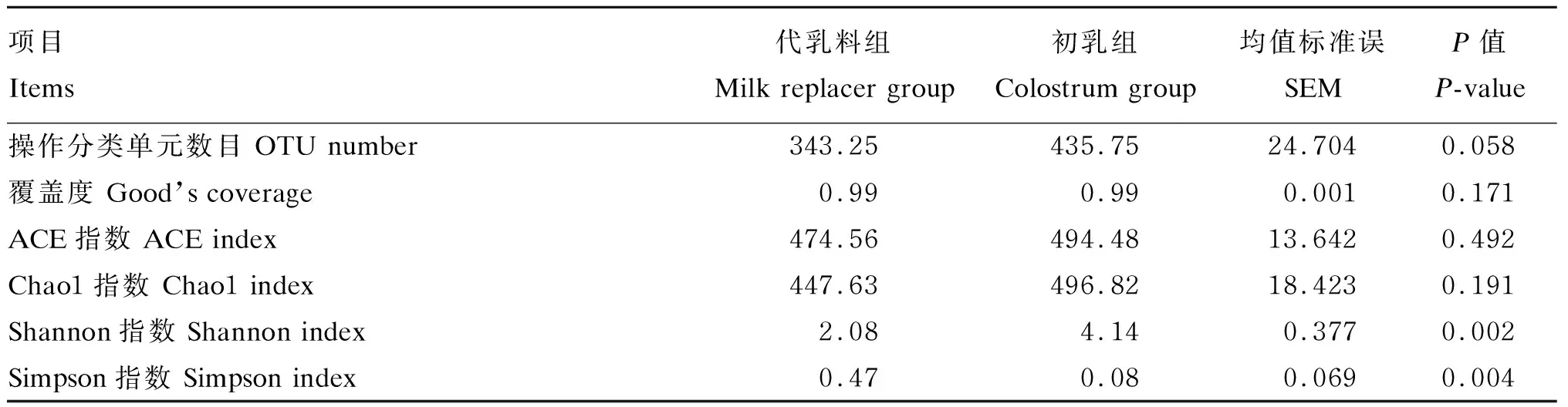
表4 饲喂初乳对新生羔羊空肠黏附微生物α多样性的影响
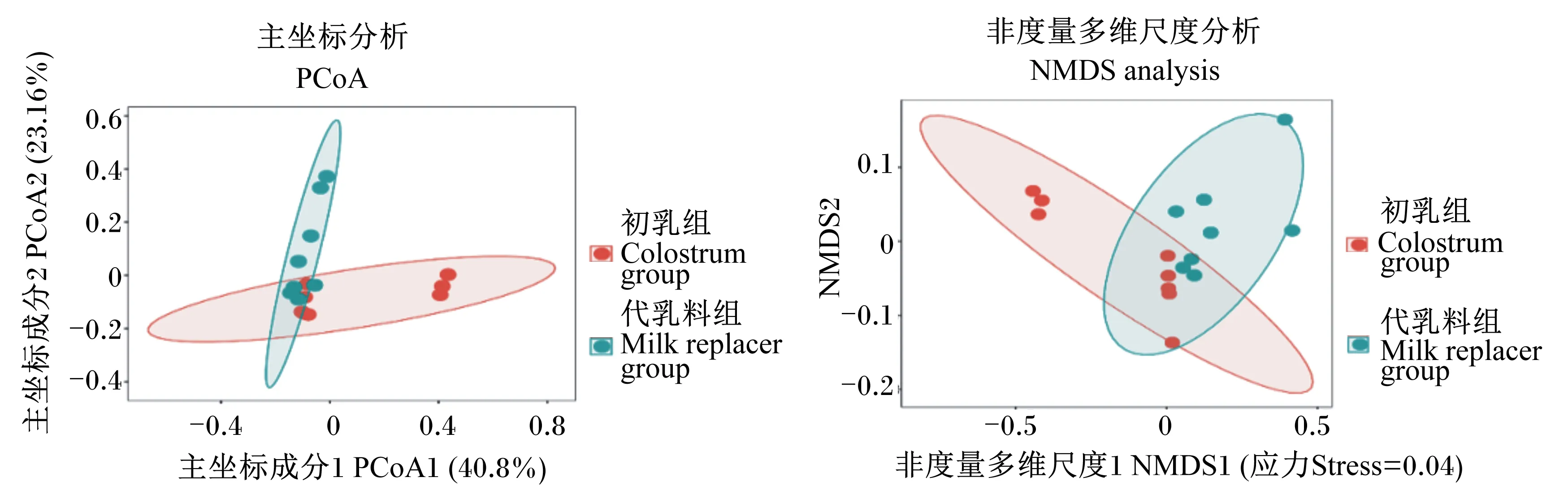
图3 新生羔羊空肠黏附微生物主坐标分析和非度量多维尺度分析

表5 空肠黏附微生物在门水平上的相对丰度
2.2.4 属水平上微生物组成
由表6可知,饲喂初乳可显著降低新生羔羊空肠黏附微生物中埃希氏菌-志贺氏菌属(Escherichia-Shigella)的相对丰度(P<0.05),而初乳组新生羔羊空肠黏附微生物中有益菌如乳杆菌属(Lactobacillus)和双歧杆菌属的相对丰度显著高于代乳料组(P<0.05)。此外,初乳组新生羔羊空肠黏附微生物中百伯史坦菌属(Bibersteinia)、毛螺旋菌科UGG-008(Lachnospiraceae_UCG-008)、螺杆菌属(Helicobacter)、脱硫弧菌属(Desulfovibrio)和未分类瘤胃球菌科相关菌属(uncultured_bacterium_f_Ruminococcaceae)的相对丰度显著高于代乳料组(P<0.05)。
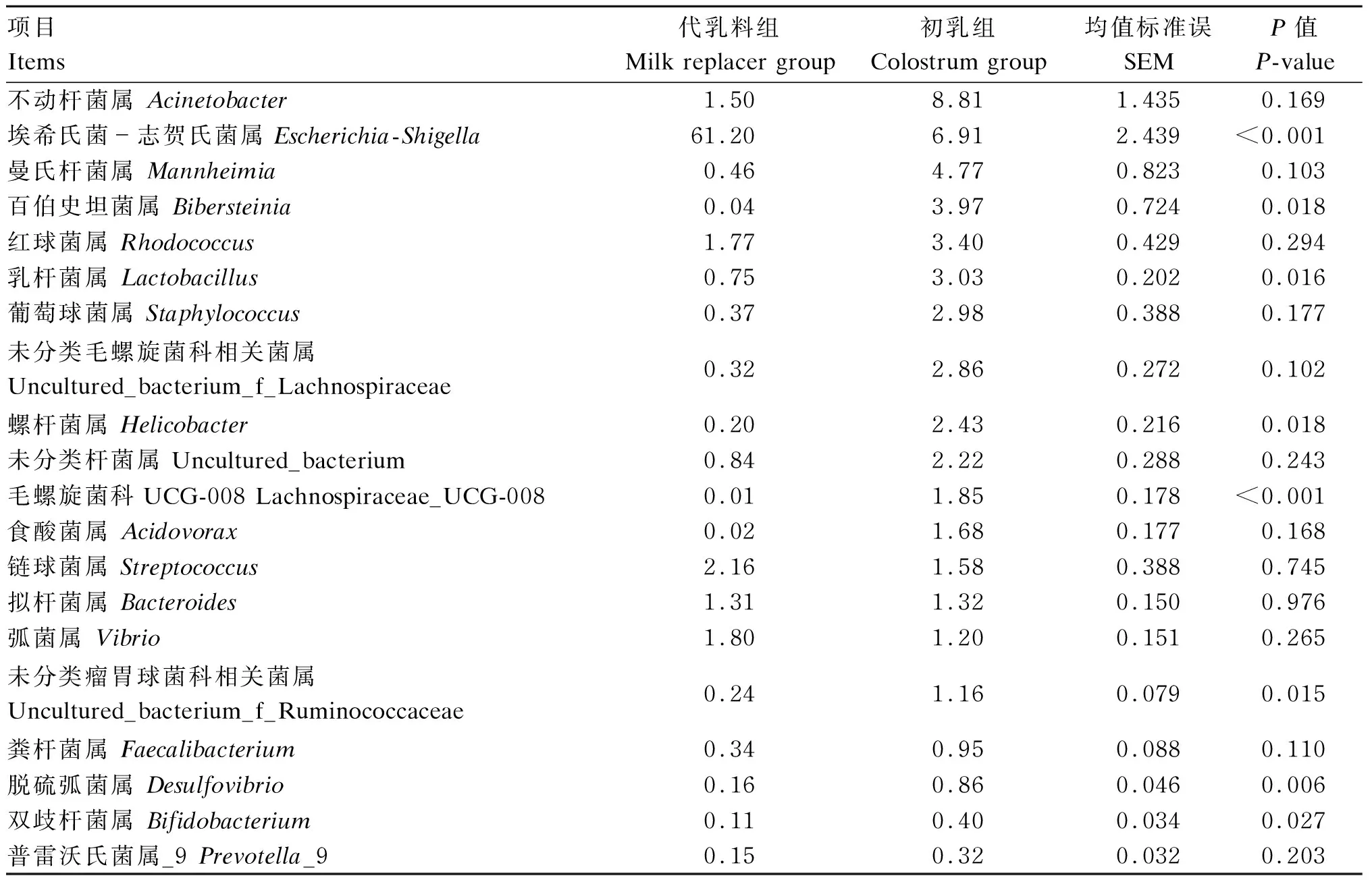
表6 空肠黏附微生物在属水平上的相对丰度
3 讨 论
新生反刍动物由于特殊的胎盘结构使其母体内的抗体不能转运至胎儿侧,出生后无被动免疫能力,容易受到外来病原菌的侵袭,从而威胁其生命。新生反刍动物只能通过及时从初乳中摄取免疫球蛋白来建立自身的被动免疫,以此抵御各类病原菌的侵袭[17]。据报道,在现代集约化生产中,约有50%的死亡新生犊牛是由腹泻引起的,56%的疾病由胃肠道状态紊乱引发[18-19]。因此,完善新生反刍动物饲养管理和初乳饲喂策略可极大提高其成活率。
初乳是新生反刍动物激素和生物活性因子的重要来源,与胃肠道的成熟和发育息息相关,其中除含有免疫球蛋白和营养物质外,还含有激素和促生长因子如胰岛素样生长因子(insulin growth factor,IGF)、表皮生长因子(epidermal growth factor,EGF)和转化生长因子-β(transforming growth factor-β,TGF-β)等[5,20-21]。研究发现,分娩后第1天内奶牛初乳和山羊初乳中总固形物、蛋白质、脂肪、乳糖、灰分等营养成分含量无显著差异[22]。奶牛和山羊分娩后第1次收集的初乳中IgG含量分别为59.8和41.9 mg/mL,免疫球蛋白M(IgM)和免疫球蛋白A(IgA)含量均较低且无显著差异[23-24]。由于奶牛初乳易采集、泌乳量较山羊多、营养价值较山羊初乳高等特点,其在生产中替代山羊初乳具有可行性。
肠道渗透性是指肠道黏膜上皮被某些相对分子质量大于150的物质分子以非载体或通道介导的被动扩散方式通过的特性,是检测肠道完整性的重要指标[25]。肠道渗透性主要受应激、致病菌和炎症等的影响,当机体发生应激、肠道受到致病菌侵袭或局部产生炎症时,其渗透性增加,破坏肠上皮的完整性,从而影响其屏障作用的发挥[26]。然而,新生羔羊在出生后的24~48 h内肠上皮类型为胎儿型,其主要特点是通透性大,可使大分子物质以被动扩散方式进入肠上皮而被吸收进入血液[4]。随发育时间的延长,羔羊肠道逐渐“闭合”,肠上皮逐渐转化为成年型肠上皮,对大分子物质的通透性降低,其屏障作用增强。本试验首次探究了山羊肠道渗透性的测定和分析方法以及初乳对其渗透性的调控作用,结果显示饲喂初乳并不能在短时间(12 h)内改变肠道渗透性,其通透性大小可能很大程度上与发育时间相关。
肠道微生物在宿主免疫系统发育、营养物质利用和整体生理方面起着至关重要的作用[27]。新生动物肠道微生物群落的建立与黏膜免疫系统和次级淋巴结构的发育有关,其中某些特定的细菌属能够为肠上皮细胞产生能量底物,出生后按时饲喂初乳可通过促进肠道微生物的定植,对新生动物的健康起重要作用[28]。本试验中,初乳组Shannon指数显著高于代乳料组,而Simpson指数显著低于代乳料组,Shannon指数越高且Simpson指数越低表明微生物群落多样性越高。α多样性分析结果表明,在出生后饲喂初乳可显著提高新生羔羊肠道微生物群落的丰富度,并可增加肠道微生物群落的多样性。在门水平上,新生羔羊空肠黏附微生物中变形菌门占比最高,其次为厚壁菌门和拟杆菌门,与Rey等[29]在犊牛上的研究结果一致。初乳组新生羔羊空肠黏附微生物中厚壁菌门的相对丰度显著高于代乳料组,表明其肠道微生物对碳水化合物和蛋白质的消化吸收能力更强[30]。变形菌门中包含多种病原菌,代乳料组新生羔羊空肠黏附微生物中变形菌门的相对丰度显著高于初乳组,表明饲喂初乳可抑制有害菌的定植。在属水平上,初乳组新生羔羊空肠黏附微生物中未分类瘤胃球菌科相关菌属、毛螺旋菌科UCG-008和脱硫弧菌属的相对丰度显著高于代乳料组,而瘤胃球菌通常被认为是机体内的有益菌[31]。毛螺旋菌科细菌通常参与动物体内糖代谢,尤其是多糖降解过程[32]。据Jiao等[33]报道,脱硫弧菌属的相对丰度与瘤胃氨态氮和挥发性脂肪酸含量呈正相关,表明其可能参与动物体内氨态氮和挥发性脂肪酸代谢过程。双歧杆菌属作为一种益生菌被广泛应用,可调节宿主免疫应答和免疫细胞表型,还可通过产生乙酸盐来保护宿主免受肠道致病菌的感染[34]。乳杆菌属可与肠道屏障发生相互作用,进而起到维护肠道免疫系统的作用[35]。Fischer等[16]研究发现,出生后尽快饲喂初乳可显著增加犊牛结肠黏膜中双歧杆菌属和乳杆菌属的相对丰度,而大肠杆菌的相对丰度显著降低,与本试验结果相似,表明出生后尽快饲喂初乳可促进有益菌定植,抑制有害菌定植,从而维持肠道健康。
4 结 论
新生羔羊出生后饲喂初乳对其肠道渗透性无影响,但可促进新生羔羊肠道乳酸菌和双歧杆菌等有益菌的定植,降低大肠杆菌等有害菌的定植,对维持肠道健康具有积极作用。
