褪黑素对模拟干旱胁迫下北美红栎幼树幼树光合性能及抗氧化酶系统的影响
2021-04-13汪俊峰余敏芬李东宾吴婷婷郑炳松闫道良
汪俊峰,余敏芬,李东宾, 吴婷婷, 郑炳松, 闫道良,*
褪黑素对模拟干旱胁迫下北美红栎幼树幼树光合性能及抗氧化酶系统的影响
汪俊峰1,余敏芬2,李东宾2, 吴婷婷1, 郑炳松1, 闫道良1,*
1. 浙江农林大学林业与生物技术学院, 杭州 311300 2. 宁波市林场, 宁波 315000
为研究干旱胁迫下施加褪黑素对北美红栎幼树光合性能和抗氧化酶系统的影响, 以当年生北美红栎幼树实生苗为试验材料, 利用不同浓度的聚乙二醇(PEG-6000)溶液模拟干旱,研究干旱胁迫对北美红栎幼树光合性能及抗氧化酶活性的影响。结果表明: 在PEG模拟的干旱胁迫下, 北美红栎幼树的光合作用受到抑制并破坏了体内的氧化还原平衡, 抗氧化物酶活性提高。在干旱胁迫开始前喷施100 μM的褪黑素能够提高北美红栎幼树清除活性氧的能力, 维持干旱胁迫条件下较高的净光合速率并能有效地缓解由于干旱胁迫对植物造成的损伤。试验结果为实践中栽培管理北美红栎幼树提供了参考。
褪黑素; 干旱胁迫; 北美红栎幼树; 光合性能; 抗氧化酶
0 前言
我国的干旱、半干旱地区面积约占国土面积的26.73%, 干旱已经成为限制我国林业发展的重要因素之一。干旱胁迫下植物细胞会产生更多的活性氧, 使细胞膜受损、蛋白质降解和酶失活[1], 植物正常生理代谢受阻。干旱胁迫下, 一系列抗氧化酶活性的升高, 是提高植物抗旱性的有效机制之一[2], 包括超氧化物歧化酶、过氧化氢酶、过氧化物酶、抗坏血酸过氧化物酶和谷胱甘肽还原酶等[3]。
褪黑素(N-乙酰-5-甲氧基色胺)是一类重要的吲哚类激素物质, 在植物体内具有多种生理功能, 如保护叶绿素分子、调节光周期、增强体内抗氧化物酶活性等[4]。褪黑素可以缓解植物由干旱[5]、重金属[6]、高温[7]、低温[8]和UV辐射[9]等胁迫引起的损伤。褪黑素也可以提高逆境胁迫下植物的净光合速率, 这可能与其具有保护叶绿素[10]、维持植物光系统II(PSII)正常功能[11]和提高植物体内多种抗氧化物酶的活性有关[12]。
北美红栎(Linn.)是壳斗科的一种落叶乔木, 原产于美国东部及加拿大东南部。北美红栎具有优良的生态价值、景观价值和经济价值。其抗逆境能力强, 对土壤及其他生态环境要求不高, 可用于干旱半干旱地区的绿化种植及林地恢复; 北美红栎为秋季彩叶树种, 是城市美化的优良树种, 同时也是优质的材用树种。目前, 对北美红栎抗逆性的研究鲜有报道, 为更好地向干旱地区引种推广, 本研究利用褪黑素溶液对北美红栎叶面喷施预处理, 再对北美红栎进行模拟干旱胁迫, 试验结果旨在了解褪黑素缓解北美红栎干旱胁迫机制, 同时也为北美红栎向干旱地区引种栽培提供参考。
1 材料与方法
1.1 试验设计
选取长势一致的一年生北美红栎幼树移栽至内径13 cm, 高为17 cm的塑料盆中, 盆内基质为沙土, 基质保持田间持水量的80%—85%。7月中旬开始对北美红栎幼树进行预处理: 每隔一天喷施一次100 μM褪黑素溶液, 共5次, 喷施时间为17:00—18:00, 每次以叶面和叶背均沾湿且滴水为准, 另一组使用蒸馏水代替褪黑素溶液执行同样操作。最后一次喷施褪黑素或蒸馏水的次日以不同浓度的PEG(使用1/2霍格兰特营养液配置)溶液对北美红栎幼树进行模拟干旱试验, PEG浓度分别为: 5%PEG(轻度干旱P1)、15%PEG(中度干旱P2)和25%PEG(重度干旱P3)。设置8个处理组: 仅进行褪黑素喷施预处理的对照组(M)、轻度干旱组(M-P1)、中度干旱组(M-P2)、重度干旱组(M-P3)及仅进行蒸馏水喷施预处理的对照组(CK)、轻度干旱组(P1)、中度干旱组(P2)、重度干旱组(P3)。每处理3个重复, 每重复5盆(每盆1株)。
1.2 生理生化指标测定
采用叶绿素测定仪(SPAD-502, Spectrum Technologies, Plainfield, IL, USA)测定叶片叶绿素相对含量。参照朱晓霞等[14]和史海涛等[15]的方法测定SOD和POD活性。硫代巴比妥酸法测定叶片中的丙二醛(MDA)含量[16]。茚三酮法测定叶片脯氨酸(Pro)含量[17]。
1.3 光合作用指标测定
选取叶位一致的北美红栎幼树叶片, 利用Li-6400便携式光合测定系统(LI-COR, Inc., Lincoln, USA)测定北美红栎幼树叶片气体交换参数。测定时间为AM 8:00—11:00, 测定时的叶室温度设置为大棚温度约30 ℃, 叶室CO2浓度约为400 μmol·mol-1, 叶室气体流速为500 μmol·s-1, 光合有效辐射(PAR)为720 μmol·m-2·s-1。测定的气体交换参数包括叶片净光合速率(Pn)、气孔导度(Cond)、胞间CO2浓度(Ci)和蒸腾速率(Trmmol)等。每个处理选3枚叶片, 10次重复测定, 并计算植物叶片的水分利用效率(WUE)[18]。
利用便携式调制叶绿素荧光仪(PAM-2500, Walz, Germany)测定叶绿素荧光参数。叶片暗适应25 min后, 测得初始荧光(F0)、最大荧光(Fm)和光系统II的实际光合效率(Y(II))等荧光参数[19]。
1.4 数据分析
试验中所有数据均用Microsoft Excel、SIGMAPLOT 12.5软件进行数据统计分析及作图。使用最小显著差异(LSD)方法进行多重比较(< 0.05)。所有数据是3次重复数据的均值±标准差。
2 结果与分析
2.1 褪黑素对不同干旱胁迫下北美红栎幼树叶绿素含量的影响
由图1可知, 30 d时, 无论是否喷施褪黑素, 叶绿素含量均随着干旱程度的加深而不断下降; 但M、M-P1、M-P3处理组相较于CK、P1、P3处理组的叶绿素含量分别提高了6.3%、13.1%和28.1%, 表明喷施褪黑素可以有效缓解干旱胁迫对叶绿素的破环作用。
2.2 褪黑素对不同干旱胁迫下北美红栎幼树气体交换参数的影响
2.2.1 褪黑素对干旱胁迫下北美红栎幼树净光合速率的影响
由图2可知, 0 d时, 喷施褪黑素的处理组整体净光合速率高于喷施蒸馏水的处理组。21 d后, 无论是否喷施褪黑素, 净光合速率均随着干旱程度的加深而不断下降, 净光合速率与干旱胁迫程度表现负相关; 但M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组净光合速率分别提高了43.6%、18.0%、19.5%和27.5%。30 d后, 喷施和未喷施褪黑素处理组的变化趋势与21 d的相似, 其中M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组净光合速率分别提高了31.9%、9.0%、43.2%和30.2%。这些结果说明, 喷施褪黑素可以有效缓解干旱对叶片光合作用的抑制作用。
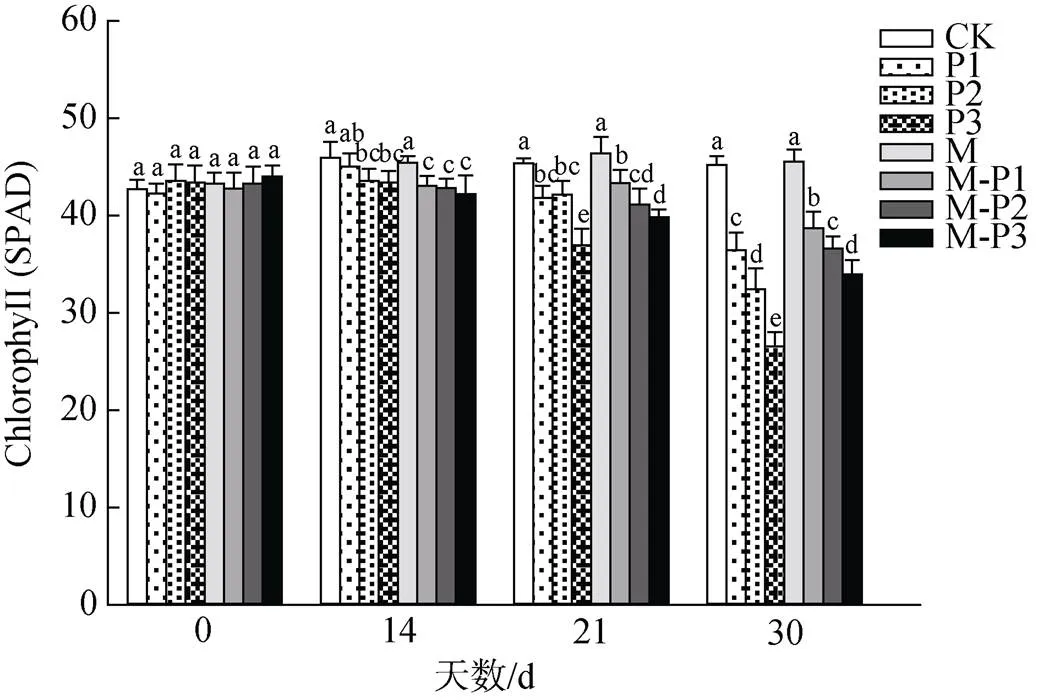
图1 褪黑素对干旱胁迫下北美红栎幼树叶绿素含量的影响
Figure 1 Effect of melatonin on chlorophyll content ofseedlings under drought stress
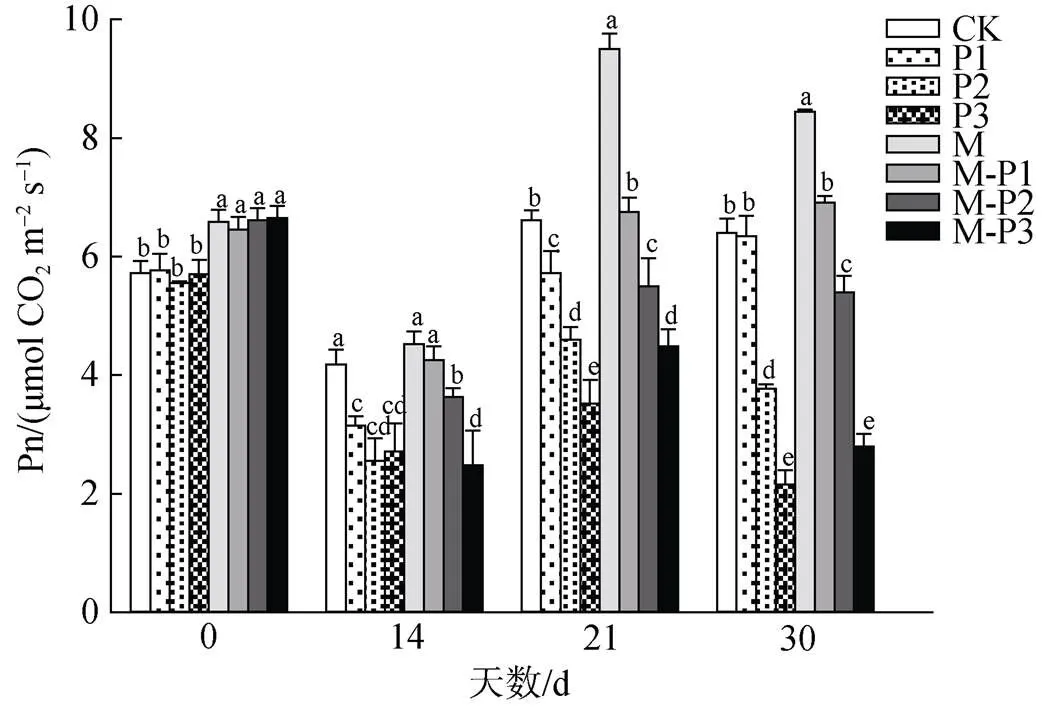
图2 褪黑素对干旱胁迫下北美红栎幼树净光合速率的影响
Figure 2 Effect of melatonin on net photosynthetic rate ofseedlings under drought stress
2.2.2 褪黑素对干旱胁迫下北美红栎幼树胞间二氧化碳浓度的影响
由图3可知, 14 d时, M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组胞间CO2浓度分别提高了34.9%、12.9%、21.3%和8.7%。21 d和30 d时无论是否喷施褪黑素, 相同干旱胁迫条件下的胞间CO2浓度间没有显著性差异, 说明在短期干旱胁迫下, 喷施褪黑素有利于维持北美红栎幼树叶片中较高的CO2浓度。
2.2.3 褪黑素对干旱胁迫下北美红栎幼树气孔导度的影响
由图4可知, 21 d时, 无论是否喷施褪黑素, 叶片的气孔导度均随着干旱程度的加深而不断下降。M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组的叶片气孔导度分别提高了45.8%、3.3%、7.5%和63.5%。30 d时, 喷施和未喷施褪黑素处理组的变化趋势与21 d的相似, 其中M、M-P1、M-P3处理组相较于CK、P1、P3处理组的叶片气孔导度分别提高了35.2%、8.78%和71.9%, 这些结果说明了干旱胁迫下喷施褪黑素可以提高叶片气孔导度, 有利于对CO2的吸收。
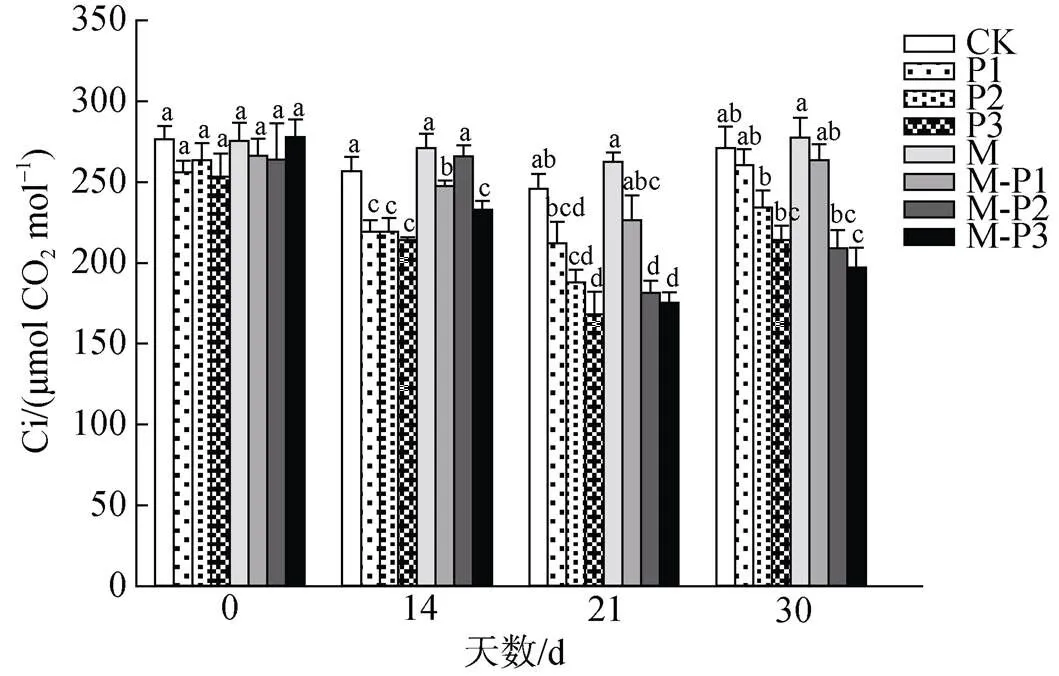
图3 褪黑素对干旱胁迫下北美红栎幼树胞间二氧化碳浓度的影响
Figure 3 Effect of melatonin on intercellular carbon dioxide concentration ofseedlings under drought stress
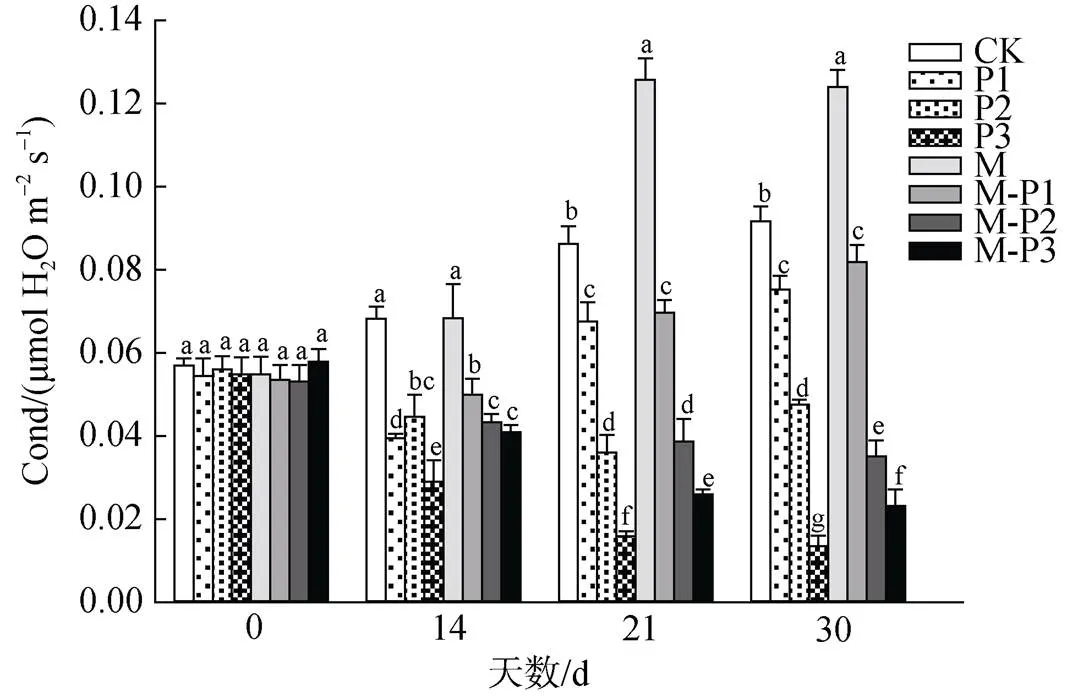
图4 褪黑素对干旱胁迫下北美红栎幼树气孔导度的影响
Figure 4 Effect of melatonin on stosmatal conductance ofseedlings under drought stress
2.2.4 褪黑素对干旱胁迫下北美红栎幼树蒸腾速率的影响
由图5可知, 21 d时, 无论是否喷施褪黑素, 叶片的蒸腾速率均随着干旱程度的加深而不断下降, 叶片的蒸腾速率随着干旱胁迫程度的加深显著降低; 但M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组的蒸腾速率分别提高了38.4%、4.4%、7.6%和63.5%。30 d时, 喷施和未喷施褪黑素处理组的变化趋势与21 d的相似, 其中M、M-P1、M-P3处理组相较于CK、P1、P3处理组的叶片蒸腾速率分别提高了34.4%、12.4%和85.3%。这些结果说明了干旱胁迫下喷施褪黑素可以维持植物进行正常的蒸腾作用。
2.2.5 褪黑素对干旱胁迫下北美红栎幼树水分利用率的影响
由图6可知, 21 d时, 无论是否喷施褪黑素, 叶片水分利用率均随着干旱程度的加深而不断下降, 但M-P1、M-P2、M-P3处理组相较于P1、P2、P3处理组的水利用效率分别提高了13.0%、11.1%和28.2%。30 d时, 喷施和未喷施褪黑素处理组的变化趋势与21 d的相似, 其中M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组的水分利用速率分别提高了1.8%、3.1%、6.9%和42.4%。这表明褪黑素可以提高干旱胁迫下北美红栎幼树的水分利用效率, 从而提高北美红栎幼树的耐旱程度。
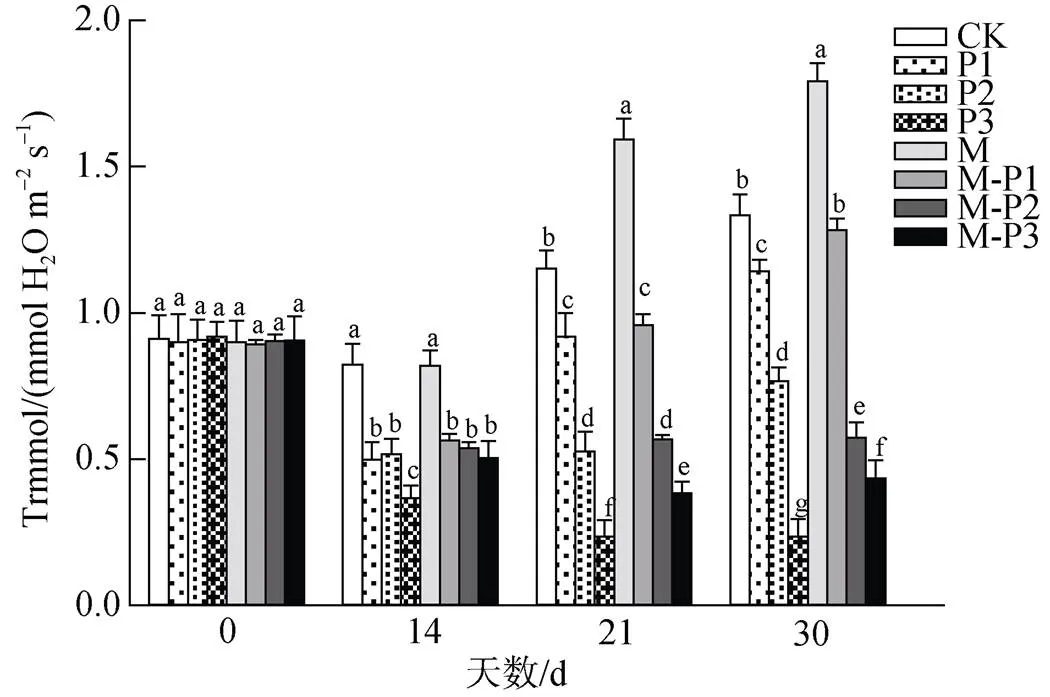
图5 褪黑素对干旱胁迫下北美红栎幼树蒸腾速率的影响
Figure 5 Effect of melatonin on transpiration rate ofseedlings under drought stress
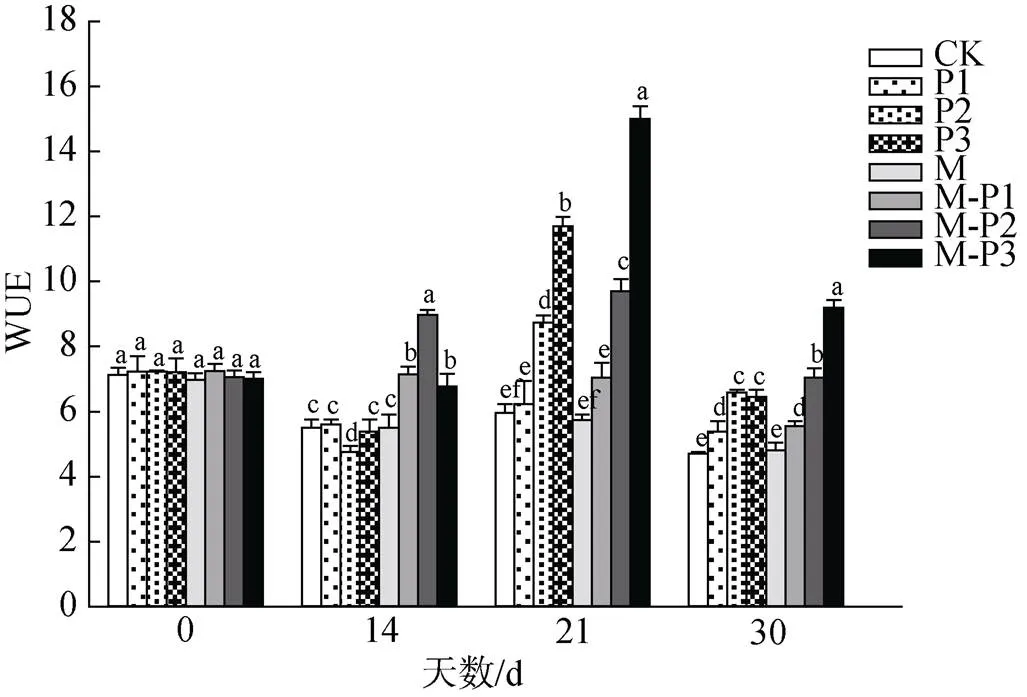
图6 褪黑素对干旱胁迫下北美红栎幼树水分利用率的影响
Figure 6 Effect of melatonin on efficiencyofwaterapplication ofseedlings under drought stress
2.3 褪黑素对干旱胁迫下北美红栎幼树叶绿素荧光参数的影响
由图7可知, 21 d时, 无论是否喷施褪黑素, 光系统II的实际光合效率均随着干旱程度的加深而不断下降, 但M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组光系统II的实际光合效率分别提高了13.0%、16.7%、12.3%和5.7%。30 d时, 喷施和未喷施褪黑素处理组的变化趋势与21 d的相似, 其中M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组的光系统II的实际光合效率分别提高了32.6%、16.4%、4.3%和4.3%。

图7 褪黑素对干旱胁迫下北美红栎幼树光系统II的实际光合效率的影响
Figure 7 Effect of melatonin on Y(II)ofseedlings under drought stress
由图8可知, 30 d时, 轻度和中度干旱胁迫下喷施褪黑素对光系统II的最大光合效率没有显著影响, 而重度干旱胁迫下喷施褪黑素能够显著地提高光系统II的最大光合效率。这些结果说明了干旱胁迫下喷施褪黑素可以在一定程度上保护植物光系统II。
2.4 褪黑素对干旱胁迫下北美红栎幼树叶片抗氧化酶活性的影响
由图9可知, 14 d时, 无论是否喷施褪黑素, 随着干旱程度的加深, 北美红栎幼树叶片的SOD活力均呈现出先上升后下降的趋势, 但是喷施褪黑素后干旱胁迫组叶片的SOD活力整体显著高于未喷施褪黑素的干旱胁迫组, 其中M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组SOD活力分别提高了2.3%、22.6%、9.6%和10.4%。21 d时, 无论是否喷施褪黑素, 叶片的SOD活力均随着干旱程度的加深而不断下降, 但M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组SOD活力分别提高了3.9%、4.4%、8.3%和23.3%。
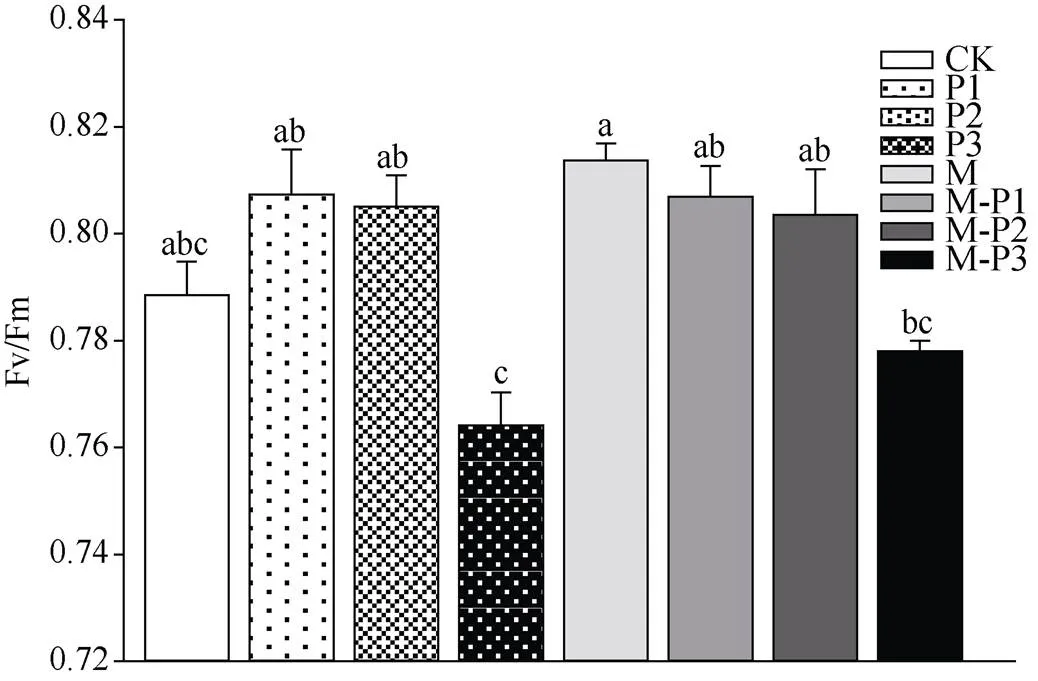
图8 褪黑素对干旱胁迫下北美红栎幼树光系统II的最大光合效率的影响
Figure 8 Effect of melatonin on Fv/Fm ofseedlings under drought stress

图9 褪黑素对干旱胁迫下北美红栎幼树超氧化物歧化酶的影响
Figure 9 Effect of melatonin on superoxidedismutaseactivity ofseedlings under drought stress
由图10可知, 14 d时, 无论是否喷施褪黑素, 随着干旱胁迫程度的增加, 北美红栎幼树叶片的POD活力均出现了不同程度的升高, 但是喷施褪黑素后的干旱胁迫组叶片POD活力整体显著高于未喷施褪黑素的干旱胁迫组, 其中M-P1、M-P2、M-P3处理组相较于P1、P2、P3处理组POD活力分别提高了3.9%、13.5%和1.6%。21 d时, 无论是否喷施褪黑素, 叶片的POD活力均随着干旱程度的加深呈现出先上升后下降的趋势, 但M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组的POD活力分别提高了7.7%、10.5%、11.3%和11.1%。30 d时, POD活力在喷施和未喷施褪黑素处理组中各个干旱梯度之间差异不显著。
2.5 褪黑素对干旱胁迫下北美红栎幼树叶片丙二醛和脯氨酸含量的影响
由图11可知, 21 d时, 无论是否喷施褪黑素, 随着干旱胁迫程度的增加北美红栎幼树叶片的MDA含量均出现了不同程度的升高, 但是喷施褪黑素后的干旱胁迫组叶片的MDA含量整体低于未喷施褪黑素的干旱胁迫组, M-P1、M-P2、M-P3处理组相较于P1、P2、P3处理组的MDA含量分别降低了4.6%、9.8%和11.7%。30 d时的变化趋势与21 d的相似, 其中, M、M-P1、M-P2、M-P3处理组相较于CK、P1、P2、P3处理组的MDA含量分别降低了8.2%、5.5%、7.2%和8.5%。这表明了褪黑素可以保护细胞膜系统, 缓解干旱致使的膜损伤。
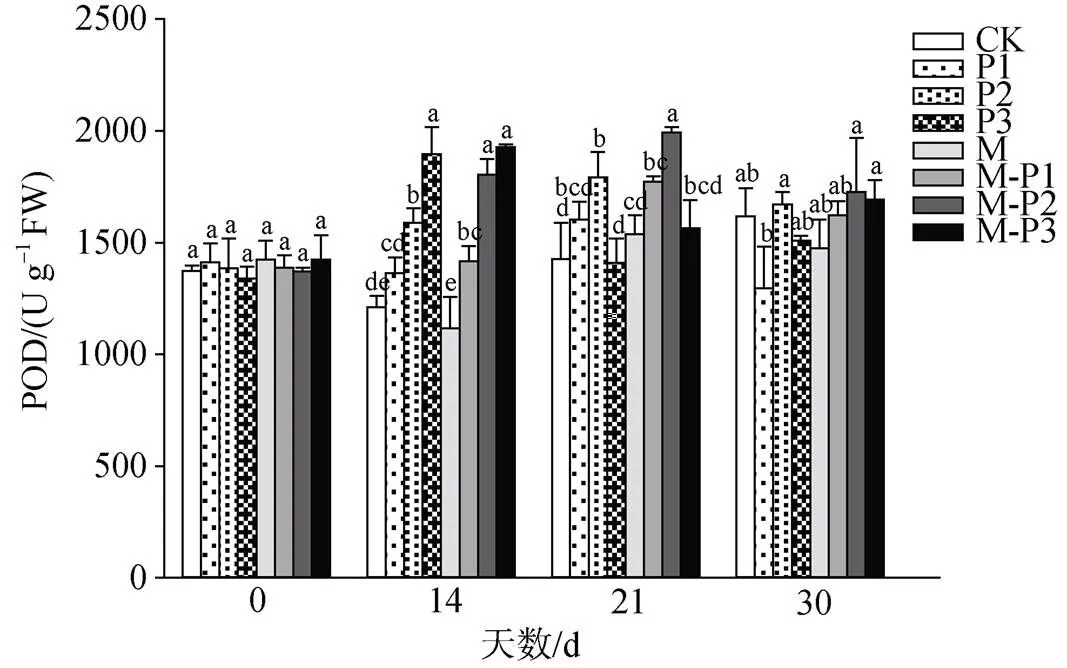
图10 褪黑素对干旱胁迫下北美红栎幼树过氧化物酶的影响
Figure 10 Effect of melatonin on peroxidaseactivity ofseedlings under drought stress
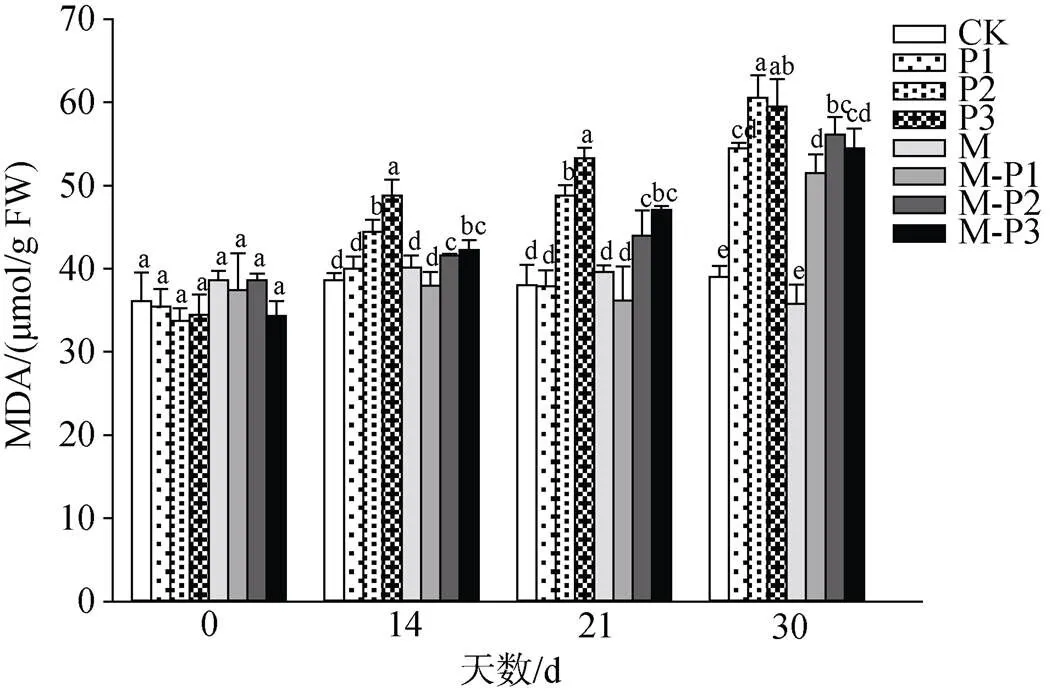
图11 褪黑素对干旱胁迫下北美红栎幼树过丙二醛含量的影响
Figure 11 Effect of melatonin on MDA contents ofseedlings under drought stress
由图12可知, 14 d时, 无论是否喷施褪黑素, 随着干旱胁迫程度的增加北美红栎幼树叶片的Pro含量均出现了不同程度的升高, 但是喷施褪黑素后的干旱胁迫组叶片Pro含量整体显著高于未喷施褪黑素的干旱胁迫组, 其中M、M-P1、M-P3处理组相较于CK、P1、P3处理组Pro含量分别升高了7.1%、26.9%和15.4%。21 d时, 喷施和未喷施褪黑素处理组的变化趋势与14d的相似, 其中M-P2、M-P3处理组相较于P2、P3处理组的Pro含量分别升高了6.5%和7.8%。这些结果表明了喷施褪黑素可以提高干旱胁迫下植物体内脯氨酸含量。脯氨酸的积累, 不但提高了细胞质内渗透调节物质的含量, 还能稳定生物大分子结构, 防止细胞脱水。
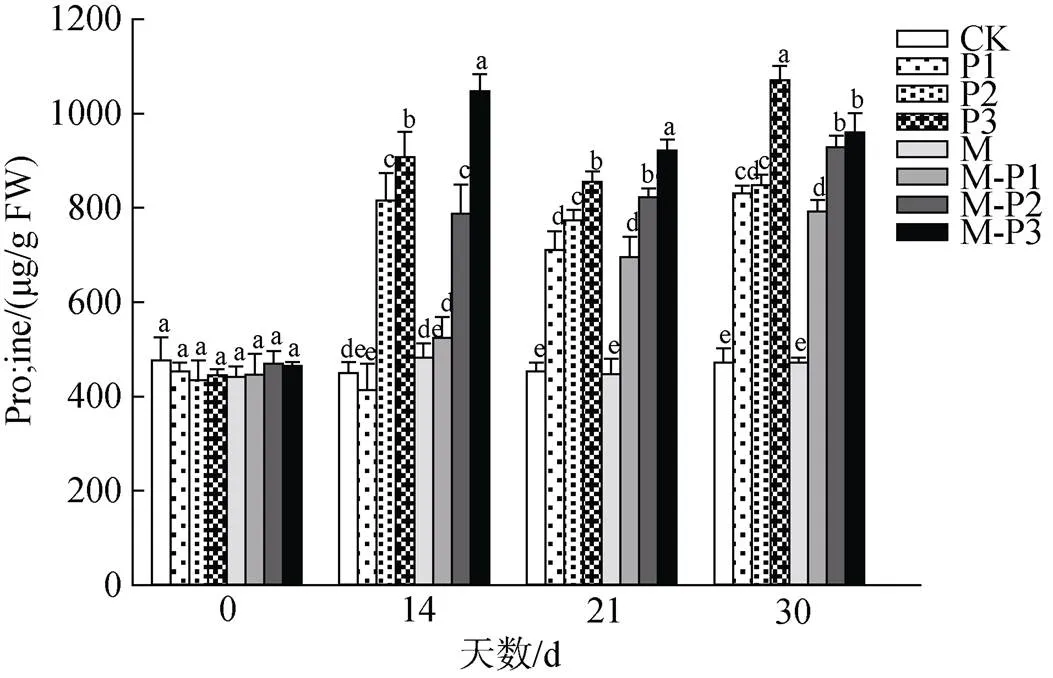
图12 褪黑素对干旱胁迫下北美红栎幼树脯氨酸含量的影响
Figure 12 Effect of melatonin on Proline contents ofseedlings under drought stress
3 讨论
3.1 褪黑素对干旱胁迫下北美红栎幼树气体交换参数的影响
干旱胁迫会抑制叶绿素合成从而降低植物的光合能力, 喷施褪黑素后可以有效地提高干旱胁迫下北美红栎幼树的叶绿素含量, 与前人的研究一致[20]。植物受到干旱胁迫时, 会通过降低叶片气孔导度, 从而减少水分散失, 同时CO2吸收也受到影响, 最终导致光合速率的降低[21-22]。本研究表明, 未喷施褪黑素处理组在短期干旱(14 d)时北美红栎幼树的Pn、Cond、Ci和Trmmol均显著下降, 但Pn的下降幅度在不同干旱胁迫程度下的差异不显著, 同样, WUE在CK、P1、P2、P3四个处理组中也没有较大差异。喷施褪黑素处理组在短期干旱(14 d)时北美红栎幼树的Pn、Cond、Ci和Trmmol均显著下降, 且随着干旱程度的不断加深而呈现不断下降的趋势; WUE在轻度和中度干旱下则呈现随着干旱程度不断加深而不断上升的趋势, 虽然在重度干旱条件下M-P3处理组的WUE没有继续上升, 但相较于未喷施褪黑素的干旱胁迫组仍处于较高水平。喷施褪黑素后, 植物可以对PEG引起的干旱环境进行较快地响应以减少干旱胁迫对植物光合系统及其功能造成的损伤[23]。当干旱胁迫持续到21 d时, 北美红栎幼树的Pn、Cond、Ci和Trmmol均显著下降, 而WUE显著上升; 而喷施褪黑素处理组的Pn、WUE、Cond、Ci和Trmmol整体上均高于未喷施褪黑素处理组, 其中喷施褪黑处理组Pn和WUE显著高于未喷施褪黑素处理组。试验结果表明, 干旱胁迫30 d时褪黑素的施加对增强北美红栎幼树的WUE效果低于21 d。这可能是由于本试验仅在干旱胁迫处理前对植物进行喷施褪黑素处理, 而在干旱胁迫开始后没有再进行喷施褪黑素而导致褪黑素对提高植物抗逆性的效能降低。
3.2 褪黑素对干旱胁迫下北美红栎幼树叶绿素荧光参数的影响
水分胁迫是抑制植物光合作用最重要的环境因素之一[25]。叶绿素荧光参数能更好地反映环境对植物光合作用过程内在影响。最大光化学效率(Fv/Fm)的变化量常用于判断植物叶片是否受到光抑制[26]。植物叶片Y(II)反映实际的光系统II反应中心进行光化学反应的效率[27]。干旱胁迫30 d时, 无论是否喷施褪黑素, 随着干旱胁迫程度的加深Fv/Fm逐渐下降。值得注意的是, 轻度和中度干旱对植物Fv/Fm的影响不显著, 但重度干旱对植物Fv/Fm的影响明显高于轻度和中度干旱。干旱胁迫14 d后, 无论是否喷施褪黑素, 随着干旱程度加深Y(II)均逐渐下降, 但喷施褪黑素后的处理组相较于没有喷施褪黑素的处理组在相同的干旱胁迫程度下Y(II)更高。
3.3 褪黑素对干旱胁迫下北美红栎幼树保护酶活性的影响
干旱胁迫下, 植物体内会产生更多的活性氧, 影响正常的生长代谢。由于干旱胁迫下植物的光合作用能力降低, 导致植物体内激发能过剩, 植物体内氧化还原平衡失调[28]。SOD和POD是植物体内最常见、最重要的抗氧化酶, 对维持植物体内正常氧化还原环境和防止植物受到自由基毒害有极其重要的意义。在干旱胁迫的第14 d和21 d时, 植株无论是否喷施褪黑素, 其SOD的活力随着干旱程度加深呈现先上升后下降的趋势。在干旱胁迫的第30 d, 无论是否喷施褪黑素SOD的活力呈现先上升后下降再持平的趋势。在干旱胁迫的第14 d时, 植株无论是否喷施褪黑素, 其POD的活力均随着干旱强度的增强不断上升。在干旱胁迫的第21 d和30 d, 植株无论是否喷施褪黑素, 其POD活力都随着干旱胁迫的不断增强呈现出先上升后下降的趋势。当干旱胁迫的强度在植物自身可承受范围内时, 随着干旱强度的增加, SOD和POD的活力不断增强以维持植物正常的生长代谢活动, 但当干旱胁迫的强度过强或干旱胁迫持续时间过长时, 植物的内环境恶化, SOD、POD活力降低。
3.4 褪黑素对干旱胁迫下北美红栎幼树丙二醛和脯氨酸含量的影响
逆境条件下植物细胞内的活性氧积累加剧, 植物细胞的膜脂过氧化程度增加, MDA含量升高, 植物细胞膜相对透性增大[29]。干旱胁迫下, 植物细胞水分缺失严重, 而脯氨酸作为重要的渗透调节物质可以提高植物干旱胁迫下的抗逆性[30]。所以MDA和Proline的含量可以有效的指示干旱胁迫下北美红栎幼树的损伤程度和抗逆强度。在干旱胁迫的第14 d、21 d和30 d时, 无论是否喷施褪黑素,植株的MDA和Proline含量均随着干旱程度加深呈现上升的趋势。干旱胁迫导致植物细胞的膜脂过氧化程度不断加深, 植物细胞膜的功能受到破坏。同时干旱胁迫条件下, 植物体内积累更多的Proline以增强植物在干旱胁迫条件下的抗逆性。而干旱胁迫前喷施褪黑素可以有效的降低干旱胁迫对植物体内MDA的含量和促进Proline的积累, 最终达到增强植物抗逆性的作用。
4 结论
在短期干旱胁迫条件下, 施加褪黑素主要通过: 一是提高北美红栎幼树体内抗氧化物酶的活性, 增强了清除活性氧的能力; 二是提高植物体内渗透调节物质脯氨酸的含量, 增强了水分利用效率; 同时叶片气孔导度增加, 促进了胞间CO2积累, 从而维持北美红栎幼树在干旱胁迫下有较高的净光合速率, 增强了其在干旱胁迫条件下的抗旱性。因此在种植北美红栎幼树过程中可以预先喷施外源褪黑素以提高其抗旱性, 在一定程度上缓解干旱对北美红栎幼树的不利影响。
[1] SAIRAM R K, SRIVASTAVA G C, AGARWAL S, et al. Differences in antioxidant activity in response to salinity stress in tolerant and susceptible wheat genotypes[J]. Biologia Plantarum, 2005, 49(1): 85–91.
[2] FAROOQ M, WAHID A, KOBAYASHI N, et al. Plant drought stress: effects, mechanisms and management[J]. Agronomy for Sustainable Development, 2009, 29(1): 185–212.
[3] LIMA A L S, DAMATTA F M, PINHEIRO H A, et al. Photochemical responses and oxidative stress in two clones of Coffea canephora under water deficit conditions[J]. Environmental & Experimental Botany, 2002, 47(3): 239–247.
[4] 左佳琦, 谢佳恒, 薛宇轩, 等. 褪黑素对缓解植物逆境胁迫作用的研究进展[J]. 基因组学与应用生物学, 2014, (3): 709–715.
[5] CUI Guibin, ZHAO Xiaoxiao, et al. Beneficial effects of melatonin in overcoming drought stress in wheat seedlings[J]. Plant Physiology and Biochemistry, 2017, 118: 138–149.
[6] JI Yanli, WANG Hua, MENG Can, et al. Melatonin alleviates cadmium-induced cellular stress and germ cell apoptosis in testes[J]. Journal of Pineal Research, 2011, 52(1): 71–79.
[7] MCLELLAN T M, GANNON G A, ZAMECNIK J, et al. Low doses of melatonin and diurnal effect on thermoregulation and tolerance to uncompensable heat stress[J]. Journal of Applied Physiology, 1999, 87(1): 308–16.
[8] BAJWA V S, SHUKLA M R, SHERIF S M, et al. Role of melatonin in alleviating cold stress in Arabidopsis thaliana[J]. Journal of Pineal Research, 2014, 56(3): 238–245.
[9] ANWAR M M, MOUSTAFA M A. The effect of melatonin on eye lens of rats exposed to ultraviolet radiation[J]. Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 2001, 129(1): 57–63.
[10] ARNAO M B, HERN ¡NDEZ-RUIZ J. Protective effect of melatonin against chlorophyll degradation during the senescence of barley leaves[J]. Journal of Pineal Research, 2010, 46(1): 58–63.
[11] ZHANG Na, SUN Qianqian, ZHANG Haijun, et al. Roles of melatonin in abiotic stress resistance in plants[J]. Journal of Experimental Botany, 2015, 66(3): 647–656.
[12] ABDULLAH, ARMAGAN, EFKAN, et al. Effects of melatonin on lipid peroxidation and antioxidant enzymes in streptozotocin-induced diabetic rat testis[J]. Asian Journal of Andrology, 2010, 8(5): 595–600.
[13] ZHU Xiaoxiao, HOU Lijuan, ZHANG Jian, et al. The structural and functional effects of fine particulate matter from cooking oil fumes on rat umbilical cord blood vessels[J]. Environmental Science & Pollution Research, 2016, 23(16): 16567–16578.
[14] HAITAO S, TIANTIAN Y, BAO Z, et al. AtHAP5A modulates freezing stress resistance in Arabidopsis through binding to CCAAT motif of AtXTH21[J]. New Phytologist, 2014, 9(7): 554–567.
[15] 赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[J]. 植物生理学报, 1994, (3): 207–210.
[16] BATES L S, WALDREN R P, TEARE I D. Rapid determination of free proline for water-stress studies[J]. Plant & Soil, 1973, 39(1): 205–207.
[17] NIJS I, FERRIS R, BLUM H, et al. Stomatal regulation in a changing climate: a field study using Free Air Temperature Increase (FATI) and Free Air CO2 Enrichment (FACE)[J]. Plant Cell & Environment, 2010, 20(8): 1041–1050.
[18] 陶文文, 蒋文伟, 赵丽娟. 3个钓钟柳品种叶绿素荧光特性比较[J]. 浙江农林大学学报, 2011, 28(3): 367–371.
[19] YE Jun, WANG Shiwen, DENG Xiping, et al. Melatonin increased maize (L.) seedling drought tolerance by alleviating drought-induced photosynthetic inhibition and oxidative damage[J]. Acta Physiologiae Plantarum, 2016, 38(2): 48.
[20] 王磊, 胡楠, 张彤, 等. 干旱和复水对大豆()叶片光合及叶绿素荧光的影响[J]. 生态学报, 2007, 27(9): 3630–3636.
[21] 刘明, 吕爱锋, 武建军, 等. 干旱对农业生态系统影响研究进展[J]. 中国农学通报, 2014, 30(32): 165–171.
[22] ZHANG Na, ZHAO Bing, ZHANG Haijun, et al. Melatonin promotes water-stress tolerance, lateral root formation, and seed germination in cucumber (Cucumis sativus L.)[J]. Journal of Pineal Research, 2012, 54(1): 15– 23.
[23] 赵燕, 王东华, 赵曦阳. 植物中褪黑素的研究进展[J]. 西北植物学报, 2014, 34(1): 196–205.
[24] MARIA S, MASSIMILIANO G. Assessing the poplar photochemical response to high zinc concentrations by image processing and statistical approach[J]. Photosynthesis Research, 2014, 122(3): 315–322.
[25] HERPPICH W B, PECKMANN K. Influence of Drought on Mitochondrial Activity, Photosynthesis, Nocturnal Acid Accumulation and Water Relations in the CAM Plants(ME-type) and(PEPCK-type)[J]. Annals of Botany, 2000, 86(3): 611–620.
[26] MART NEZ-CARRASCO R, S NCHEZ-RODRIGUEZ J, P REZ P. Changes in Chlorophyll Fluorescence During the Course of Photoperiod and in Response to Drought in Casuarina equisetifolia Forst. and Forst[J]. Photosynthetica, 2002, 40(3): 363–368.
[27] SOHRABI, HEIDARI, WEISANY, et al. Changes of antioxidative enzymes, lipid peroxidation and chlorophyll content in chickpea types colonized by different Glomus species under drought stress[J]. Symbiosis, 2012, 56(1): 5–18.
[28] HODGES D M, DELONG J M, FORNEY C F, et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta, 1999, 207(4): 604–611.
[29] VERBRUGGEN N, HERMANS C. Proline accumulation in plants: a review[J]. Amino Acids, 2008, 35(4): 753.
Effects of melatonin on photosynthetic performance and antioxidant enzyme system ofseedlings under simulated drought stress
WANG Junfeng1, YU Minfeng2, LI Dongbin2, WU Tingting1, ZHENG Bingsong1, YAN Daoliang1,*
1. College of Forestry and Biotechnology, Zhejiang A & F University, Hangzhou 311300, China 2. Ningbo Forest Farm, Ningbo 315000, China
In order to study the effects of melatonin onseedlings treated under simulated drought with different concentration of polyethylene glycol (PEG), we studied the photosynthetic ability and antioxidant enzyme system in the melatonin treated seedlings. The results showed that under the drought stress simulation, the photosynthesis ofseedlings was inhibited, the redox balance was destroyed and the activity of antioxidant enzymes increased. Spraying melatonin at 100ųM before the onset of drought stress can improve the ability ofseedlings to scavenge reactive oxygen species and maintain a higher net photosynthetic rate compared to the non-treated counterpart, indicating the melatonin application could effectively alleviate the damage caused by drought stress to plants.The results provide a reference for the cultivation and management ofseedlings in practice.
melatonin; drought Stress;seedlings; photosynthesis; antioxidant enzyme
10.14108/j.cnki.1008-8873.2021.02.021
Q142
A
1008-8873(2021)02-167-08
2019-09-18;
2019-11-02基金项目:宁波市科学技术局市级科技计划项目(CX-D01-科技富民项目2017C10014)
汪俊峰(1994—), 男, 安徽芜湖人, 硕士,主要从事植物逆境生理生态研究, E-mail:343781413@qq.com
闫道良, 男, 博士, 副教授, 主要从事植物逆境生理生态研究, E-mail: liangsie@zafu.edu.cn
汪俊峰, 余敏芬, 李东宾, 等. 褪黑素对模拟干旱胁迫下北美红栎幼树幼树光合性能及抗氧化酶系统的影响[J]. 生态科学, 2021, 40(2): 167–174.
WANG Junfeng, YU Minfeng, LI Dongbin, et al. Effects of melatonin on photosynthetic performance and antioxidant enzyme system ofseedlings under simulated drought stress[J]. Ecological Science, 2021, 40(2): 167–174.
