基于高通量测序技术大亚湾肥胖软箭虫(Flaccisagitta enflata)的食性分析
2021-04-13马婕李开枝邱大俊谭烨辉黄良民张俊彬
马婕, 李开枝, 邱大俊, 谭烨辉, 黄良民,3,* , 张俊彬
基于高通量测序技术大亚湾肥胖软箭虫()的食性分析
马婕1,2,4, 李开枝2, 邱大俊2, 谭烨辉2, 黄良民2,3,*, 张俊彬1,4,*
1. 国家实验渔业科学教育示范中心, 农业部水产遗传资源开发利用重点实验室, 上海海洋大学上海水产养殖工程研究中心, 上海 201306 2. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与生态重点实验室, 广州 510301 3. 中国科学院大学, 北京 100049 4.深圳大学生命科学与海洋学院, 深圳市海洋生物资源与生态环境科学重点实验室, 深圳 518000
采用Illuminate高通量测序技术分析了大亚湾肥胖软箭虫()的食性。在夏季(2017年8月)和冬季(2018年1月)对大亚湾内不同站位拖网采获的四组样品中, 分别挑取毛颚类优势种肥胖软箭虫进行18S rDNA V4区扩增; 通过高通量测序得到四组样品的序列, 经过处理每组样品得到约30,000条高质量序列。分析结果表明, 大亚湾肥胖软箭虫的食物来源于16个门类生物, 主要的优势类群分别来自于3个门类的浮游动物(刺胞动物门46.16%、节肢动物门的桡足类19.16%和栉水母动物门14.22%), 真菌类的2个门类(子囊菌门14.04%和担子菌亚门4.48%), 以及少量浮游植物类群的2个门 (褐藻门0.06%和隐藻门0.03%)。另外, 还检测出少量肥胖软箭虫可能摄食的纤毛虫、线虫、住囊虫、海葵等。夏季湾内肥胖软箭虫食物中子囊菌门贡献最高 (43.3%), 这与大亚湾海水养殖等人类活动影响有关; 夏季湾口外海水带来丰富的暖水性栉水母, 占肥胖软箭虫总食物丰度的55.25%。冬季湾内肥胖软箭虫摄食哲水蚤比例达49.94%, 而湾口肉质介穗水母占比高达85.3%。分析结果可见, 肥胖软箭虫的摄食具有偏好性, 且明显存在季节和区域差异。研究探讨了大亚湾不同环境下肥胖软箭虫食性转变及其食物来源的季节和区域差异, 为深入揭示浮游动物在海湾生态系统物质与能量传递过程的作用机制提供了重要基础资料。
肥胖软箭虫; 大亚湾; 高通量测序; 18S rDNA; 食性
0 前言
毛颚类属于海洋无脊椎肉食动物, 在数量上仅次于桡足类的第二大海洋浮游动物类群, 在分布上所有近岸、大洋和极地海区都有存在[1]。毛颚类是浮游动物的主要摄食者, 对生态系统起到重要的下行调控作用, 会对其摄食的浮游动物的群落结构动态产生影响, 是海洋生态系统物质循环和能量流动的关键[2]。肥胖软箭虫()是毛颚类在温带和热带海区的广布种, 也是大亚湾以至华南沿岸海区浮游动物的优势种[3]。目前对大亚湾肥胖软箭虫的研究主要集中在群落结构、分布格局、生活史、种群动态变化与物理环境之间的耦合关系等内容, 对其食性的报道还十分稀少。通过对肥胖软箭虫食性的研究, 将有助于深入了解浮游动物在大亚湾生态系统中物质与能量的递过程及其作用提供重要参考。
大亚湾(14°29′—114°49′E, 22°30′—22°52′N)是典型的半封闭海湾, 也是受人类活动与自然影响双重驱动的复合生态系统。自然影响主要体现在季节变化明显, 海洋环境主要体现在外海(南中国海)以及粤东上升流带来必要的营养盐。人类活动影响主要体现在核电站热效应和近岸营养盐与污染物质的大量输入[4]。周林滨等[5]发现大亚湾内部食物网结构异化, 从浮游植物到浮游动物的能量传递不畅, 效率降低。毛颚类作为捕食者能通过直接抑制草食浮游动物而间接提高浮游植物的多样性和生产力, 大亚湾生态环境的改变会直接或间接影响毛颚类的摄食, 进而通过食物链传递影响生态系统功能。
大亚湾浮游动物的优势类群毛颚类摄食受到环境因子与自身因素的影响, 包括温度、盐度、食物丰度、以及毛颚类自身种类、大小、生长阶段等。传统的摄食研究方法较难获得毛颚类食物组成的全面信息, 主要原因是毛颚类对食物的快速消化, 在28 ℃时消化时间仅为50分钟[6]。其大部分肠道中存在半消化态的食糜, 人工镜检难以获取真实摄食信息。饵料递减法、同位素示踪法都要依靠室内培养, 而室内培养环境难以全面还原大亚湾自然环境中毛颚类优势种肥胖软箭虫真实的摄食情况。近年来, 越来越多浮游动物摄食研究中运用了分子生物技术, 通常使用通用或特异性引物来对浮游动物肠道或粪便中食物残余进行DNA扩增, 对扩增出来的片段进行克隆和测序, 最终通过比对等实现对食物种类的确认[7-10]。然而, 通用引物易导致摄食者自身序列的大量扩增, 常因测样深度不够而屏蔽了部分食物信息。过去常使用特异性引物阻断摄食者自身序列的扩增的方法来化解该问题; 但特异性的引物针对的研究对象单一, 研究对象的改变需要重新设计该引物, 且阻断引物的验证过程费时费力, 限制了该方法在浮游动物食性研究中大量推广使用。与传统Sanger测序相比, 高通量测序更深, 可以避免传统方法中测样深度不够而产生的问题, 能够更全面的获取摄食者的食物信息。因为18S rDNA 的普遍性、保守性、与唯一性[11, 12], 在不同区域进化速度不同[13], 其中V4区域广泛应用于分子系统学和高级分类阶元, 因V4区碱基数少、序列变异系数大、且易于扩增, 适用于高通量测序, 可用于摄食关系等的研究, 对特定的食物种类或者组群的检测与鉴定[11, 12]。本研究选取了大亚湾受人类活动影响较大区域和影响较小区域的肥胖软箭虫, 利用18S rDNA的V4区域通用引物, 高通量测序的方法, 对比分析自然环境变化及人类活动对肥胖软箭虫现场食物组成和摄食偏好的影响, 旨在为阐释大亚湾生态系统功能中营养输送与食物链传递关键过程提供基础数据。
1 材料与方法
1.1 采样站点
2017年8月(夏季)和2018年1月(冬季), 在大亚湾14个站位采样, 如图1所示, 分为湾内站(S1、S2、S3、S4、S5、S6、S7、S11、S12)和湾口站(S8、S9、S10、S13、S14)。
1.2 样品采集
根据《海洋调查规范-海洋生物调查》, 使用浅水Ⅱ型网(孔径160 μm)垂直拖网采集浮游动物。不采用海水冲网, 防止毛颚类受惊吓排便。样品装入500 mL广口瓶中, 立即加入95%乙醇固定, -80 ℃冰箱保藏, 直至提取DNA。
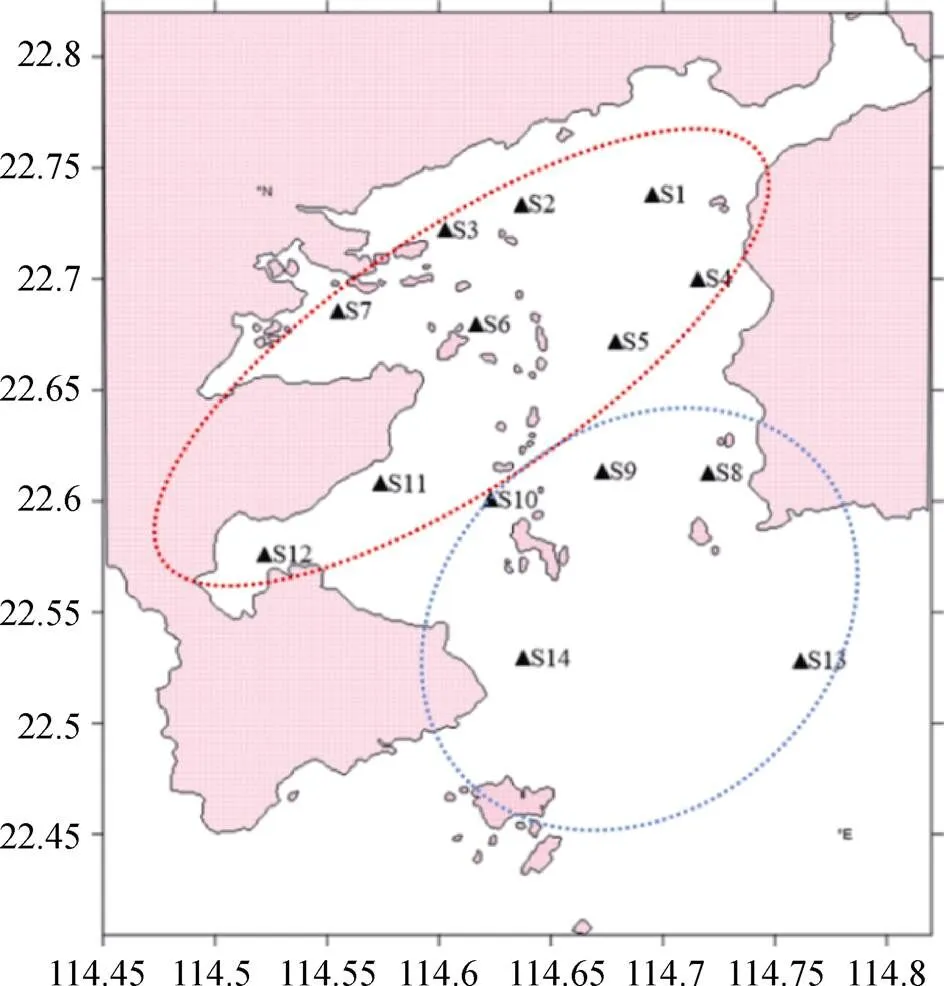
图1 大亚湾采样站位(▲)图。红色区域代表湾内站位, 蓝色区域代表湾口站位
Figure 1 Locating of sampling stations (▲) in Daya Bay. The red and the blue circle area represent in the bay and bay mouth stations, respectively.
SM-5测深仪测量站位深度, YSI 6600多参数水质检测仪检测水温、盐度和pH; 使用Niskin采水器采集表层水, 混匀后取500 mL用0.7 μm的纯玻璃纤维滤纸(GFF)过滤, 收集滤膜, -20 ℃避光保存以测量叶绿素值。
1.3 肥胖软箭虫的挑取与预处理
在湾内和湾口每个站位的浮游动物样品中, 依据《海洋浮游生物学》[1]在体视显微镜下挑出肥胖软箭虫3份, 每份15只。挑选过程中注意选取肠道食物充足, 体表颜色正常的成体。用灭过菌的 0.22 μm聚碳酸酯膜过滤海水, 得到无菌海水(FSW)对挑选好的肥胖软箭虫单独清洗, 至少清洗5遍, 去除表面附着物。用灭菌的解剖针将其肠道解剖分离, 为避免采样过程网囊中摄食对结果的影响, 只保留后2/3的肠道食物[14]。肠道一经采集, 立即使用液氮或者95%乙醇进行保存, 保藏在-80 °C, 此温度能降低核酸酶活性, 减少或完全抑制其对 DNA 的破坏。
1.4 PCR扩增与高通量测序
本实验根据天根试剂盒(DNeasy Blood&Tissue Kit)说明书提取毛颚类肠含物DNA, 利用通用引物TAReuk454FWD1: (5’-CCAGCASYGCGGTAATT CC-3’)和TAReukKREV3: (5’-ACTTTCGTTCTT GATYRA-3’)引物对18S rDNA V4区进行PCR扩增[15]。扩增体系为20 μL, 4 μL5*FastPfu 缓冲液, 2 μL 2.5 mmol·L-1dNTPs, 上下游引物各0.8 μL(5 μm), 0.4 μL FastPfu 聚合酶; 10 ng DNA模板, 0.2 μL牛血清蛋白, 11.8 μL ddH2O。扩增程序为: 95 ℃预变性5 min; 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 共27个循环, 最后72 ℃延伸10 min (PCR仪: ABI GeneAmp® 9700型)。用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 进行纯化, Tris-HCl洗脱。利用QuantiFluor™-ST (Promega, USA) 进行检测定量。根据Illumina MiSeq 平台 (Illumina, San Diego, USA)标准操作规程将纯化后的扩增片段构建PE 2*300的文库。构建文库步骤: (1)连接“Y”字形接头; (2)使用磁珠筛选去除接头自连片段; (3)利用PCR扩增进行文库模板的富集; (4)氢氧化钠变性, 产生单链DNA片段。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.5 高通量数据分析
高通量测序得到的原始序列首先使用Trimmomatic 软件进行质控: (1)设置50 bp的窗口, 如果窗口内的平均质量值低于20, 从窗口开始截去后端碱基, 去除质控后长度低于50 bp的序列; (2)条形码需精确匹配, 引物允许2个碱基的错配, 去除模糊碱基。其次, 过滤后获得的序列使用FLASH软件进行拼接, 设置碱基重叠区域大于10 bp, 去除无法拼接的序列。再者, 使用的UPARSE软件 (version 7.1 http://drive5.com/uparse/) , 根据97%的相似度对序列进行OTU聚类, 并进行稀释曲线划分; 再通过UCHIME软件剔除嵌合体。最后, 利用RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释, 比对Silva 数据库 (https://www.arb- silva.de/,Version 128), 设置比对阈值为70%。
2 结果与分析
2.1 肥胖软箭虫的自食现象
在本次研究中, 剔除了肥胖软箭虫自身的序列, 而在现场研究中我们观测到成年肥胖软箭虫捕食成年同类的现象(如图2)。曾有报道在食物并不缺乏的环境中, 浮游动物自食现象也很普遍[16]。Kehayias等[17]在地中海东部区域观测到肥胖软箭虫同类相食率最高达5.1%, 其原因需要进一步研究。本文探讨通过18S rDNA高通量检测得到的真核食物组成结果中不包括肥胖软箭虫的同类相食。

图 2 肥胖箭虫自食
Figure 2cannibalism
2.2 OTU丰度及多样性指数分析
剔除肥胖软箭虫自身的序列, 夏季湾内与湾口箭虫样品得到其有效食物序列分别为41216和33774条, 二者的OTU数量分别为47和18; 冬季湾内与湾口箭虫样品有效食物序列分别为39258和40299条, 二者的OTU数量分别为56和49(表1)。OTU的数量反映了肥胖软箭虫摄食的种类情况, 表明夏、冬季湾内肥胖软箭虫的食物丰度大于湾口, 而夏季湾口的肥胖软箭虫食物丰度最低, OTU数仅为18。图3显示所有样品OTU稀释曲线都趋于饱和。读数都在30000条以上, Alpha多样性覆盖率都在99.9%以上(表2)。通过测序深度曲线可判定其达到平台期, 可认为测样深度涵盖了肥胖软箭虫的主要食物种类。

表1 不同样品的原始序列、高质量序列和OTUs数
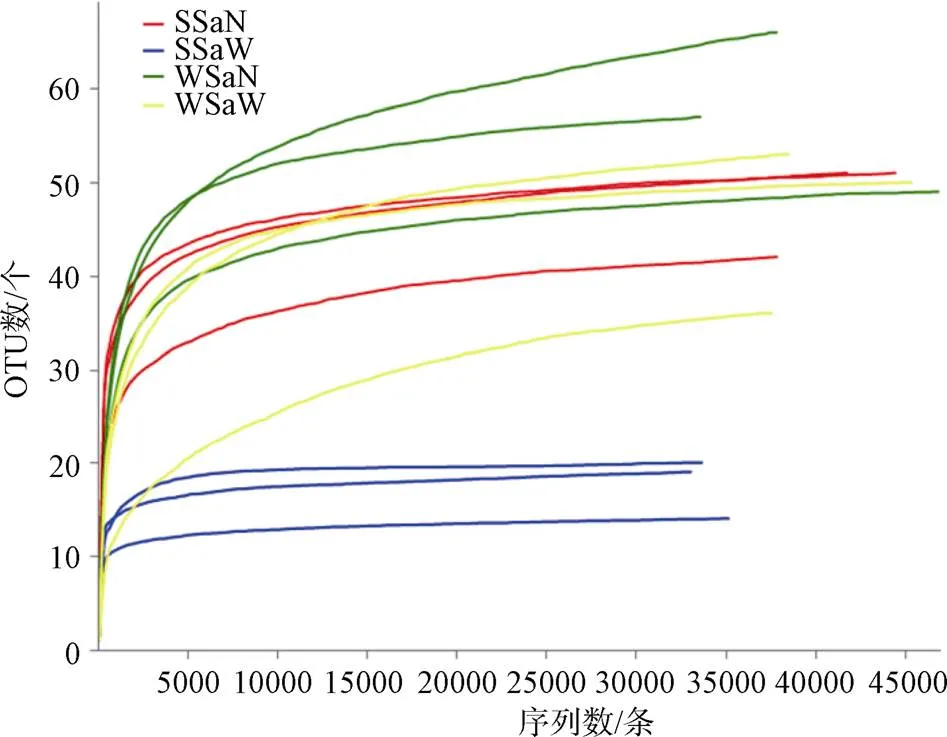
图3 各样品的稀释曲线
Figure 3 Rarefaction curve of each sample
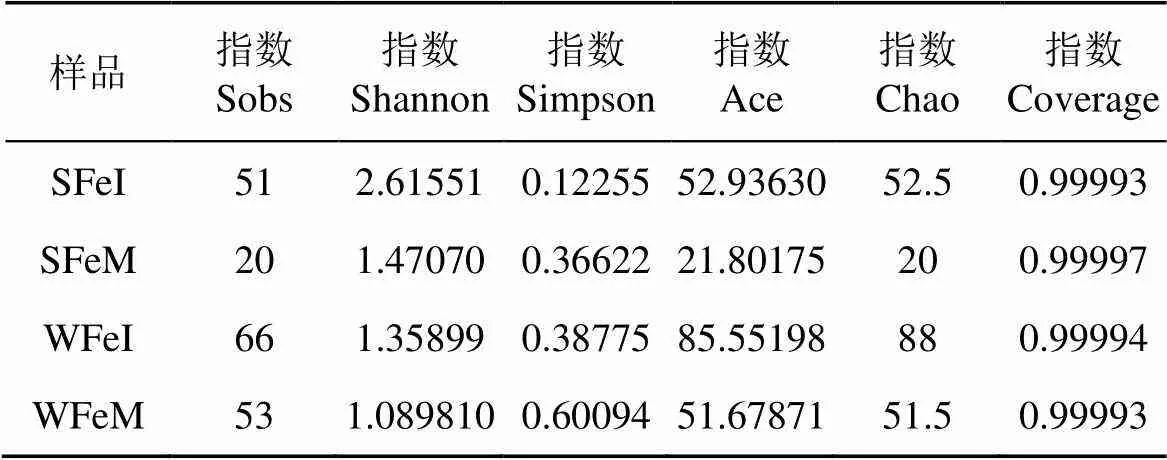
表2 不同样品摄食物种多样性指数
2.3 食物组成分析
大亚湾夏季和冬季湾内、湾口的肥胖软箭虫的食物组成共检测出16个门类的生物(刺胞动物门、节肢动物门、栉水母动物门、软体动物门、纤毛动物门、尾索动物门、线形动物门、双鞭毛虫门、原生动物门、子囊菌门、担子菌亚门、球囊菌门、壶菌门、拟杆菌门、褐藻门、隐藻门)(如图4), 其中有9个门类的生物为浮游动物, 5个门为真菌类, 2个门为浮游植物。发现不同季节不同区域, 肥胖软箭虫的食物组成存在着差异: 夏季湾内(SFeI)检测到13个门类生物, 夏季湾外(SFeM)6个门类, 冬季湾内(WFeI)10个门类, 冬季湾外(WFeM)9个门类。各个样品之间生物门类水平上的丰度差异显著, 其中刺胞动物门是肥胖软箭虫食物中丰度最高的门类, 占食物总量的46.16%, 其次是节肢动物门19.16%和子囊菌门14.04%。
如表3所示, 夏季湾内肥胖软箭虫食物中真菌占比为四组样品中最高, 占夏季湾内食物总丰度的55.6%(子囊菌门43.30%、担子菌亚门12.03%); 其次是刺胞动物36.95%和软体动物1.51%; 节肢动物只有0.33%丰度, 不及0.74%的原生动物; 极低丰度的线形动物0.01%、浮游植物(0.02%隐藻和0.06%褐藻)只出现在夏季湾内肥胖软箭虫的食物组成中。夏季湾口肥胖软箭虫几乎只摄食浮游动物, 超过一半为栉水母(55.25%), 其余依次是刺胞动物22.38%、节肢动物22.19%和原生动物0.06%。在冬季湾内, 肥胖软箭虫食物只有真菌和浮游动物两部分, 分别为9.6%和90.4%; 浮游动物中节肢动物相对丰度最高为50.47%, 其次是刺胞动物38.61%; 与夏季湾内占比近似的是冬季0.71%栉水母, 而纤毛动物只在湾内食物组成出现。在冬季湾外的食物组成中, 节肢动物减少到3.65%, 而刺胞动物增加到86.68%; 其余食物所占比例相比湾内都有所下降。在生物门类的水平上, 刺胞动物门、节肢动物门、子囊菌门、担子菌门、栉水母动物门是18S rDNA相对食物丰度较高的5个门类。4组样品中的刺胞动物门占比都大于20%, 刺胞动物门是大亚湾肥胖软箭虫的最主要食物成分。
肥胖软箭虫的摄食具有明显的季节偏好性与区域偏好性, 其最主要的两类食物是刺胞动物与节肢动物。其中刺胞动物中的珊瑚纲(Anthozoa)在冬季湾口肥胖软箭虫的摄食中出现, 占食物总量的0.07%; 节肢动物中的软甲纲(Malacostraca)在夏季湾口占1.34%, 在冬季湾内占0.18%; 其余食物成分主要为刺胞动物中的水螅水母纲与节肢动物中的颚足纲。图5展示了不同生物属或种水平的水螅水母与颚足纲的丰度变化。肥胖软箭虫的摄食表现出对季节变化的响应, 夏季肥胖软箭虫偏好摄食更多的暖水种浮游动物, 如钩手水母()为小型近岸水母, 广布于浅海区, 在暖水海区中密集成群, 占食物总丰度的33.3%。纺锤水蚤()也是大亚湾主要暖水种桡足类, 是夏季湾内肥胖软箭虫主要摄食的节肢动物(图5a)。夏季湾口肥胖软箭虫食物主要包括栉水母和哲水蚤, 且两者丰度接近(图5b); 冬季肥胖软箭虫捕食更多桡足类, 哲水蚤()丰度逐渐升高, 在冬季湾内肥胖软箭虫的食物谱中占比49.94%(图5c)。肉质介螅水母()为冬季肥胖软箭虫偏好摄食的水母之一(图5d), 在冬季湾内和湾口分别检测出31350和73455条序列, 占对应食物量的36.41%和85.3%。
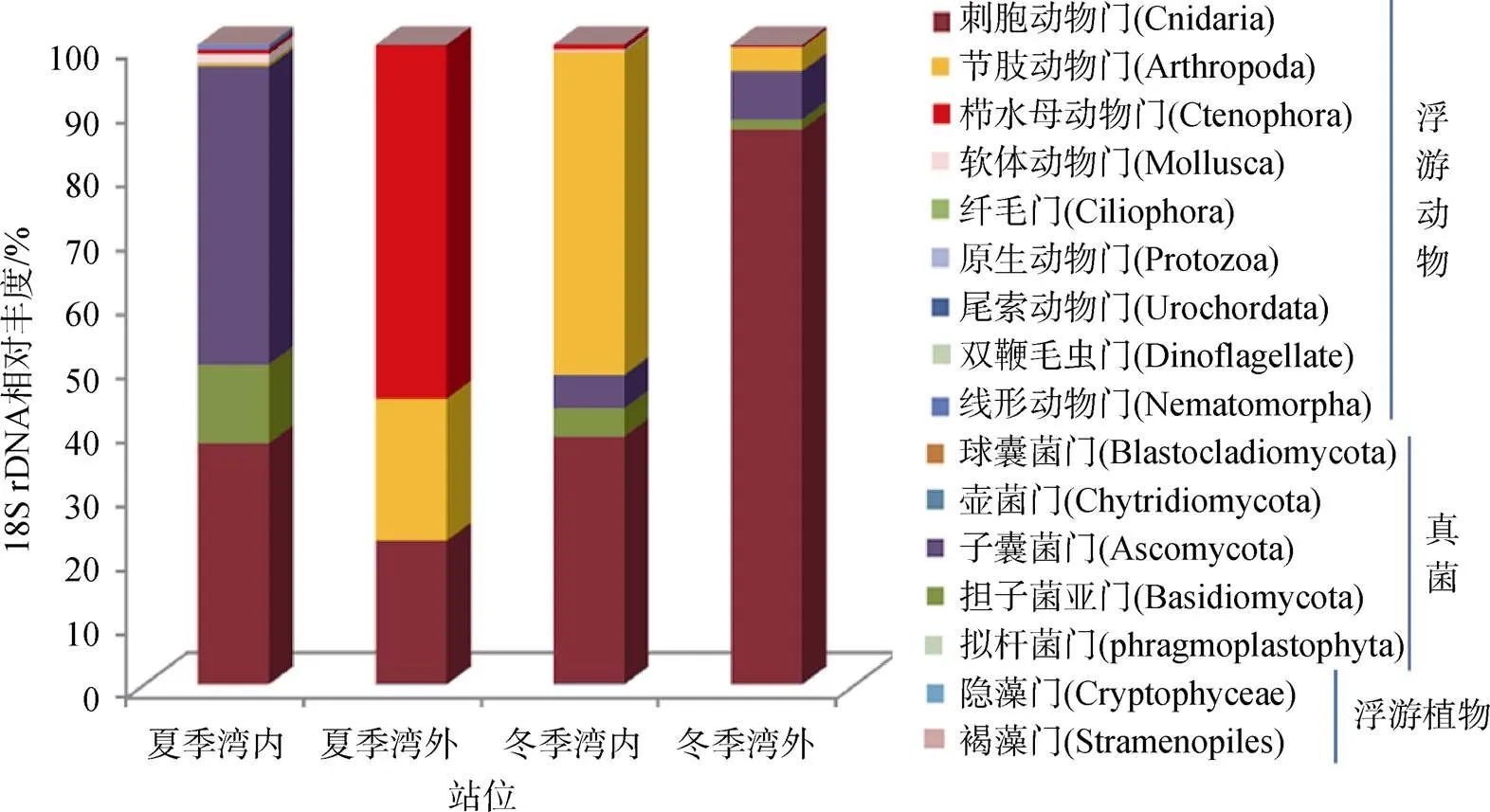
图4 各样品的食物组成在生物门类的分类水平上的18S rDNA相对丰度
Figure 4 Composition of each sample food at Phylum level
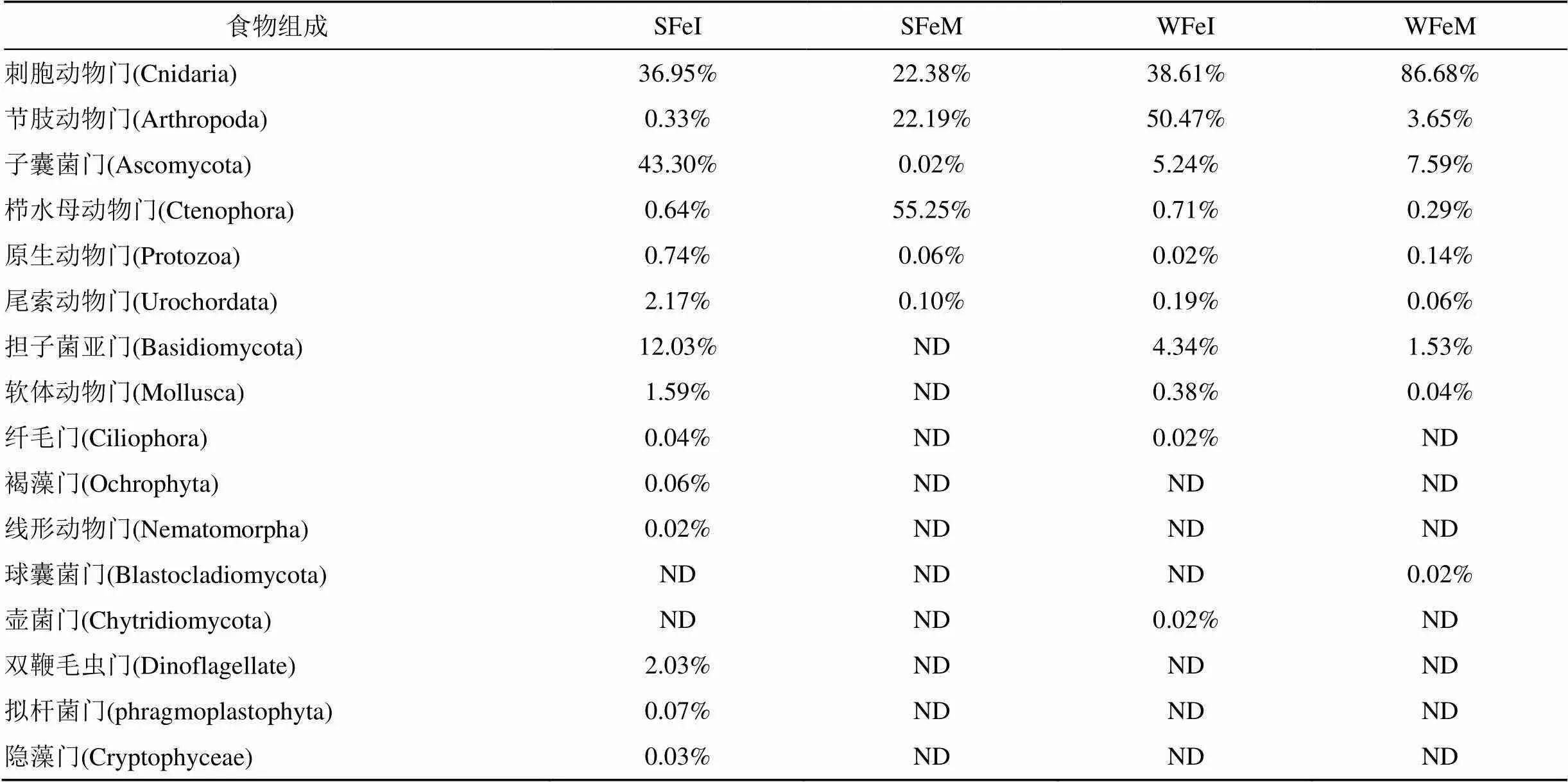
表3 肥胖软箭虫在门分类水平的样品食物组成
注: ND表示没有数据。
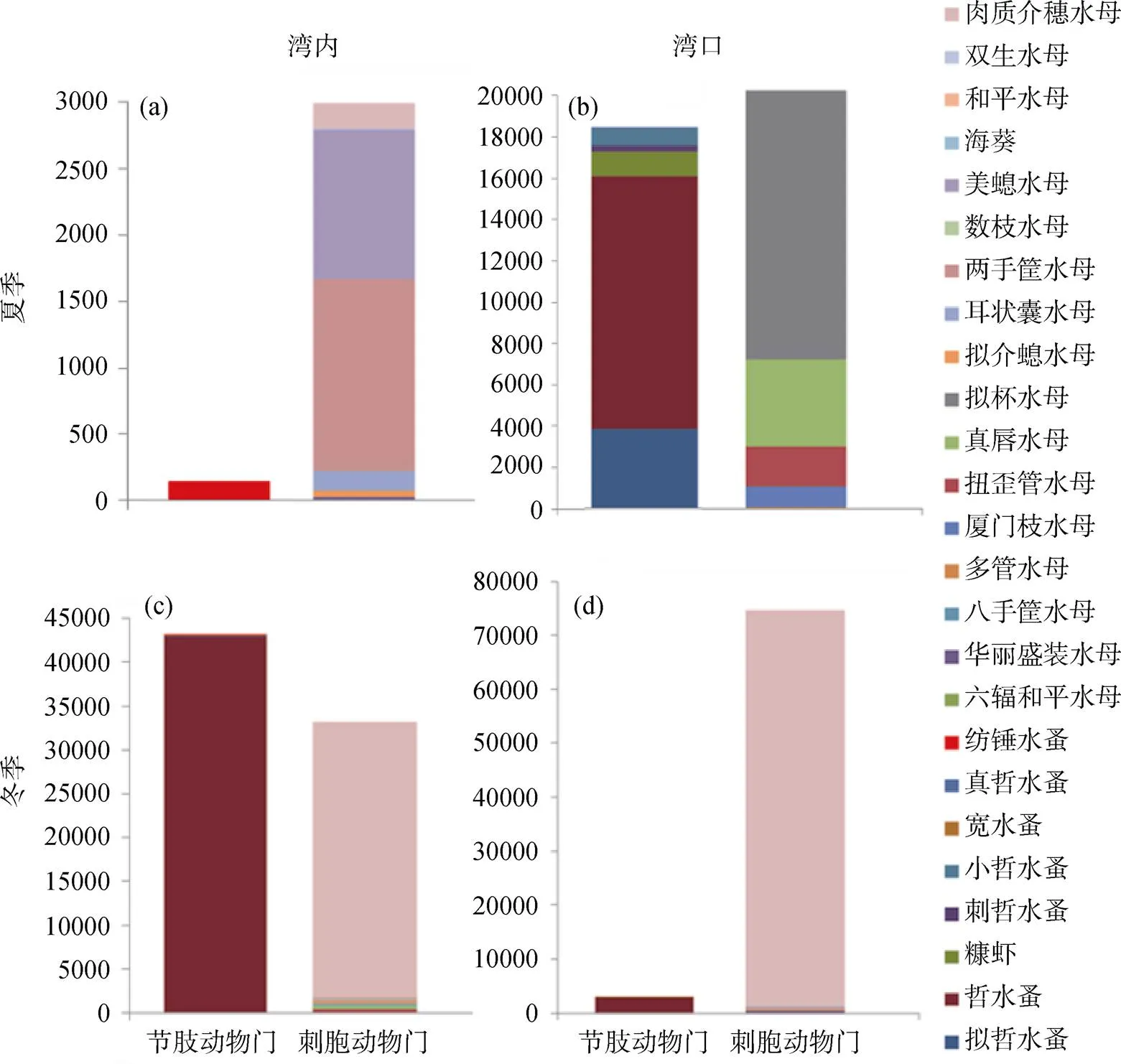
图 5 不同生物属或种水平食物组成中浮游动物占比最高门类的OTU丰度图
Figure 5 The OTU abundance of the highest phylum of zooplankton in horizontal food composition
为更直观的体现不同站位的肥胖软箭虫摄食食物组成的差异性和相似性, 构建了韦恩图(图6)。食物组成共分为243个OTUs, 4个样品组共有食物只有3个OTUs, 薮枝螅水母(spp.)、美螅水母()、真哲水蚤()分别占食物总丰度的0.078%、0.806%和0.102%。
3 讨论
毛颚类是肉食性动物, 一般认为肥胖软箭虫主要捕食桡足类、枝角类, 同时摄食砂壳纤毛虫、轮虫和其他中小型浮游动物[18]。本次实验在肥胖软箭虫的食物中没有发现枝角类, 这与Kehayias等[2]在北爱琴海的研究结果有所不同, 其原因可能为本通用引物不适应枝角类的扩增。通常认为桡足类是其主要食物, 甚至桡足类占毛颚类食物的94.8%[19], 本研究中肥胖软箭虫的食性第一组成却是水母, 其次才是桡足类、真菌和少量浮游植物。只在冬季湾内桡足类是肥胖软箭虫的主要食物49.94%, 而湾口和夏季大亚湾肥胖软箭虫食物组成中桡足类占比都没有超过水母(表3)。本研究中肥胖软箭虫摄食的水母多为沿岸暖水性小型水母, 其丰度大, 逃避能力较弱, 因而更易被捕获。有报道[20]南海水母的物种丰富度从近岸到近海地区增加, 夏季最丰富, 冬季最小; 夏季集中在近岸海区, 冬季节散落在近海海区, 为肥胖软箭虫摄食不同水母提供了有利条件。
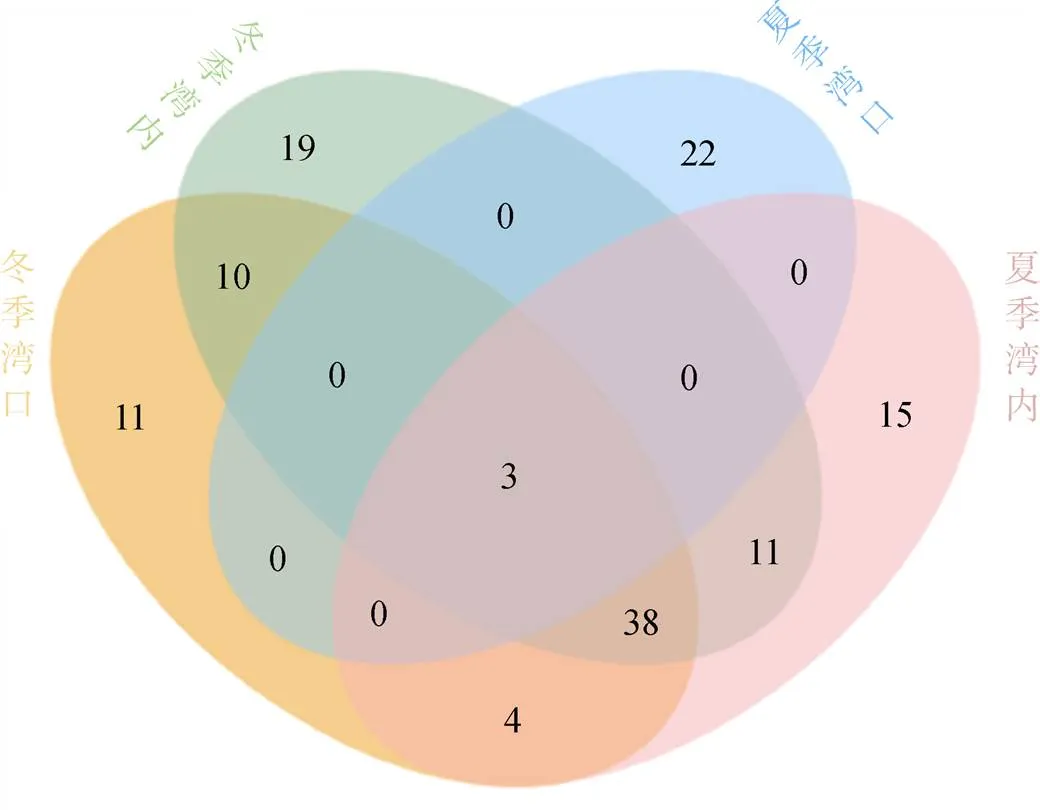
图6 样品中OTUs分布韦恩图
Figure 6 Venn diagram showing the unique and shared OTUs in samples
本次研究中在夏季湾内发现少量浮游植物序列, 其可能的原因是桡足类摄食了藻类细胞, 尚未消化的桡足类被肥胖软箭虫摄食, 二次摄食影响肥胖软箭虫真实的摄食情况。在夏季湾内肥胖软箭虫食物谱中检测出59.73%的真菌。在海洋生态系统中, 真菌是许多动植物重要的食物来源[21], 如海洋微生物壶菌是海雪的重要组成[22], 壶菌在大亚湾肥胖软箭虫冬季湾内食物组成中占0.02%。本次检测结果中, 夏季湾内肥胖软箭虫摄食真菌丰度远高于湾口, 此丰度变化与靳祖雷[23]报道的大亚湾湾内养殖区真菌数量比非养殖区平均高89.50%相吻合。还有真菌一般营腐食性的寄生或者共生, 它们寄生在海洋植物、海洋动物的体内以及营养丰富的底泥中[24], 真菌可能寄生在桡足类的体内, 也可能寄生在桡足类饵料食物体内并随着饵料生物被捕食进入桡足类体内, 从而检测到湾内多种海洋真菌类的基因序列。红纺锤水蚤()和住囊虫(spp.)是已知大亚湾夏季优势种, 肥胖软箭虫在夏季湾内更易捕食获得, 因此夏季湾内纺锤水蚤和住囊虫在肥胖软箭虫食物组成中比其他三组样品的高。夏季湾内肥胖软箭虫的食物多样性在四个样品中最高包括13个门类, 5个门类为夏季湾内特有, 包括线形动物门、隐藻门、褐藻门、双鞭毛虫门、拟杆菌门。湾内受河流影响, 高温低盐高营养盐水使得浮游动物多样性升高, 夏季湾内肥胖软箭虫摄食的高多样性与夏季大亚湾丰富的浮游动物种类相关[3]。
夏季湾口栉水母在肥胖软箭虫食物中占比高达55.25%, 因大亚湾夏季为西南季风期, 粤东沿岸上升流带来高盐外海水[25], 同时带来大洋暖水性生物类群栉水母中的优势种球形侧腕水母[26], 所以球形侧腕水母可能是夏季湾口肥胖软箭虫的重要食物。与连喜平等[3]报道的大亚湾栉水母种类只有球型侧腕水母()一致。
在冬季湾内肥胖软箭虫摄食节肢动物的比例明显升高, 节肢动物占食物总量的50.47%, 节肢动物门中的哲水蚤属为冬季湾内肥胖软箭虫食物中的优势种类, 有资料表明中华哲水蚤()只在大亚湾冬季出现[27]。可能随着季节的改变, 肥胖软箭虫需要更有价值的能量进行生殖和适应低温, 因而摄食更多并且更易获得的桡足类中的哲水蚤, 这是肥胖软箭虫做出的季节摄食响应和生存策略。
在冬季湾口, 源自东海的高营养浙闽沿岸水入侵大亚湾, 形成顺时针环流, 湾口有高营养盐水, 同时肉质介螅水母是大亚湾冬季优势种[28], 与冬季肥胖软箭虫摄食高丰度的肉质介穗水母结果(图5)对应。澳洲有学者研究[29]表明, 在较高盐度条件下水母发生出芽生殖产生的螅状幼体数量较多, 这给肥胖软箭虫提供了捕食水母螅状幼体的良好条件。
4 结论
通过对大亚湾夏、冬季湾内与湾口区域肥胖软箭虫的摄食组成分析, 发现肥胖软箭虫食物谱广泛, 从食物中共检测到16个门类生物, 9个门为浮游动物, 5个门属于真菌, 2个门为浮游植物。其中水母与真菌占比远超出传统摄食的认识。其中5个门(线形动物门、隐藻门、褐藻门、双鞭毛虫门、拟杆菌门)为夏季湾内特有。
大亚湾在人类活动影响较大的湾内, 尤其养殖区海水本身比湾口具有高丰度的真菌, 同时检测出夏季湾内肥胖软箭虫食物中真菌占55.4%; 在湾口高盐水区域, 水母是肥胖软箭虫的重要食物, 拟杯水母与肉质介穗水母分别是夏季与冬季湾口肥胖软箭虫的主要食物。
从季节变化来看, 大亚湾夏季肥胖软箭虫食物多样性明显高于冬季, 检测到13个门类的生物。夏季湾内肥胖软箭虫食物中子囊菌门贡献最高(43.3%), 夏季湾口外海水带来丰富的大洋暖水性栉水母, 占肥胖软箭虫总食物丰度的55.25%; 冬季桡足类占比高于夏季, 且食物多样性降低。冬季湾内肥胖软箭虫摄食哲水蚤比例达49.94%, 而冬季湾口肉质介穗水母占比高达85.3%。结果表明肥胖软箭虫的摄食具有偏好性, 且明显存在季节和区域差异。
致谢: 感谢国家重点基础研究发展规划项目组团队成员, 中国科学院南海海洋研究所黄小平研究员课题组为本实验样品的采集提供支持。感谢林强研究员与刘胜研究员课题组在高通量结果分析中给予的帮助。
[1] 郑重, 李少菁, 连光山. 海洋浮游生物学[M]. 北京: 海洋出版社, 1981.
[2] KEHAYIASG, MICHALOUDI E, KOUTRAKIS E. Feeding and predation impact of chaetognaths in the north Aegean Sea (Strymonikos and Ierissos Gulfs)[J]Journal of the Marine Biological Association of the United Kingdom, 2005, 85(6): 209–217.
[3] 连喜平, 谭烨辉, 黄良民, 等. 大亚湾大中型浮游动物的时空变化及其影响因素[J]. 海洋环境科学, 2011, 30(5): 640–645.
[4] 吴梅林, 王友绍, 林立, 等. 基于主成分分析研究大亚湾水质时空变化特征[J]. 海洋环境科学, 2009, 28(3): 279– 282.
[5] 周林滨, 谭烨辉, 黄良民. 微型浮游动物摄食实验——稀释法中浮游植物负生长的可能原因分析[J]. 热带海洋学报, 2013, 32(1): 48–54.
[6] LIEA, TSEP, WONGC. Diel vertical migration and feeding of three species of chaetognaths (,and) in two shallow, subtropical bays in Hong Kong[J]Journal of Plankton Research, 2012. 34(8):670–684.
[7] RIEMANNL,ALFREDSSON H,HANSENM, et al.Qualitative assessment of the diet of European eel larvae in the Sargasso Sea resolved by DNA barcoding[J]Biology Letters, 2010, 6(6): 819–822.
[8] MATTHIEUL,YANGY,MEYERP, et al.A new versatile primer set targeting a short fragment of the mitochondrial COI region for metabarcoding metazoan diversity: application for characterizing coral reef fish gut contents[J]Frontiers in Zoology, 2013, 10(1): 34–34.
[9] HU Simin, GUOZhiling, LI Tao, et al. DetectingCopepod Diet Diversity Using Molecular Technique: Development of a Copepod/Symbiotic Ciliate-Excluding Eukaryote- Inclusive PCR Protocol[J]Plos One, 2014, 9(7): e103528.
[10] ZHANG H,XU Qiang, ZHAO Ye, et al. Sea cucumber) eukaryotic food source composition determined by 18s rDNA barcoding[J]Marine Biology, 2016, 163(7):153.
[11] JARMAN S, DEAGLE B, GALES N. Group-specific polymerase chain reaction for DNA-based analysis of species diversity and identity in dietary samples[J]Molecular Ecology, 2010, 13(5): 1313–1322.
[12] SYMONDSON W, GLEND, IVESA, et al. Dynamics of the relationship brtween a generalist predator and slugs over five years[J]. Ecology, 2002, 83(1):137–147.
[13] 柳娟娟, 杨建全, 季清娥, 等. 18S rDNA的研究进展及其在膜翅目昆虫分子系统学中的应用[J]生物安全学报, 2007, 16(1): 18–25.
[14] KEHAYIAS G. Quantitative aspects of feeding of chaetognaths in the eastern Mediterranean pelagic waters[J]Journal of the Marine Biological Association of the UK, 2003, 83(3): 559–569.
[15] STOECK T, BASSD, NEBELM, et al. Multiple marker parallel tag environmental DNA sequencing reveals a highly complex eukaryotic community in marine anoxic water[J]Molecular Ecology, 2010, 19(S1): 21–31.
[16] WAHLSTRöM E,PERSSONL,DIEHLS, et al. Size-dependent foraging efficiency, cannibalism and zooplankton community structure[J]Oecologia, 2000, 123(1): 138–148.
[17] KEHAYIAS G, LYKAKIS J, FRAGOPOULUN. The diets of the chaetognaths,andat different seasons in Eastern Mediterranean coastal waters[J]Ices Journal of Marine Science, 1996, 53(5):837–846.
[18] SZYPER J. Feeding rate of the chaetognathin nature[J]Estuarine & Coastal Marine Science, 1978, 7(6): 567–575.
[19] FEIGENBAUM D. Daily ration and specific daily ration of the chaetognath[J]Marine Biology, 1979, 54(1):75–82.
[20] LI Kaizhi, J. YIN Jianqiang. HUANG Liangmin, et al. Spatio-temporal variations in the siphonophore community of the northern South China Sea[J]Chinese Journal of Oceanology and Limnology, 2013, 31(2): 312–326.
[21] MURUGAIYAN K. Marine Fungal Diversity and Bioprospecting[M]Berlin: Springer, Berlin, Heidelberg, 2015.
[22] BOCHDANSKYB, CLOUSE A, HERNDL J. Eukaryotic microbes, principally fungi and labyrinthulomycetes, dominate biomass on bathypelagic marine snow[J]The Isme Journal, 2017,11(2): 362–373.
[23] 靳祖雷. 大亚湾海水网箱养殖区真菌的生态特征[D]. 广州, 暨南大学, 2011.
[24] RICHARDS T, JONESA, LEONARDG, et al. Marine fungi: their ecology and molecular diversity[J]Annual Review Marine Science, 2012, 4(4):495–522.
[25] WU Meilin,WANGYoushao,SUN Cuici,et al.Monsoon-driven Dynamics of water quality by multivariate statistical methods in Daya Bay, South China Sea[J]Oceanological & Hydrobiological Studies, 2012, 41(4):66–76.
[26]伦凤霞, 王云龙, 沈新强, 等. 长江口及临近海域夏季水母类分布特征[J]. 生态学杂志, 2008, 27(9): 1510–1515.
[27] LI Kaizhi, YANYan, YIN Jianqiang, et al. Seasonal occurrence ofin the northern South China Sea: A case study in Daya Bay[J]Journal of Marine Systems, 2016, 159: 132–141.
[28] 廖秀丽, 李纯厚, 杜飞雁, 等. 2003~2005年大亚湾水螅水母类生态研究[J]. 海洋环境科学, 2006, 25: 48–51.
[29] WILLCOXS,MOLTSCHANIWSKYJ N, CRAWFORD C. Asexual reproduction in scyphistomae ofsp.: Effects of temperature and salinity in an experimental study[J]Journal of Experimental Marine Biology and Ecology, 2007, 353(1): 107–114.
Dietary analysis ofbased on high-throughput sequencing technology in Daya Bay, China
Ma Jie1,2,4, Li Kaizhi2, Qiu Dajun2, Tan Yehui2, Huang Liangmin2,3*,Zhang Junbin1,4*
1. National Demonstration Center for Experimental Fisheries Science Education, Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Agriculture, Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China 2. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China 3. University of Chinese Academy of Science, Beijing 100049, China 4.Shenzhen Key Laboratory of Marine Bioresource & Eco-environmental Science, College of Life Sciences and Oceanography, Shenzhen University, Shenzhen 518000, China
In this paper, the diet ofin Daya Bay was analyzed using Illuminate High-throughput Sequencing Technology. In summer (August 2017) and winter (January 2018), the four groups of samples taken from different trawls in Daya Bay were picked up for the 18S rDNA V4 region. The sequences of the four sets of samples were obtained by high-throughput sequencing, and about 30000 high-quality sequences were obtained after processing each set of samples. The results showed that the food ofin Daya Bay originated from 16 phyla. The main dominant groups were from the three phyla of zooplankton group (46.16% cnidaria, 19.16% copepod, 14.22% ctenophore); 2 phyla of fungi (14.04% ascomycetes, 4.48% basidiomycosis); and 2 phyla of a little of phytoplankton groups (0.06% stramenopiles and 0.03% cryptophyta). In addition, a small number of ciliates, nematodes, cysticercosis, and anemones that might be ingested bywere also detected. In the summer, the weight of the neutropha in the diet of thewas the highest (43.3%) within the bay, which was related to the impact of human activities such as marine aquaculture in Daya Bay. The seawater outside the bay was rich in warm water and jellyfish, which accounted for the total food of55.25% of the degree. In the winter, the proportion of Flaccisagitta enflata feeding on Calanus was 49.94%, while in winter, the proportion of Hydractinia in the bay mouth was as high as 85.3%. The results reveal the changes in the feeding habits ofin different environments, highlighting the important role ofin the feeding process and ecosystem, and will help to understand the important role of zooplankton in the process of matter and energy transfer.
; Daya Bay; high-throughput sequencing; 18S rDNA; diet
10.14108/j.cnki.1008-8873.2021.02.002
SQ178.1
A
1008-8873(2021)02-009-09
2020-01-03;
2020-03-03基金项目:国家973项目(2015CB452904); 国家自然科学基金重点项目(41130855)
马婕(1994—), 女, 硕士研究生, 主要从事海洋生态学研究, E-mail: 1355472619@qq.com
黄良民, 男, 研究员, 主要从事海洋生态学研究, E-mail: hlm@scsio.ac.cn
张俊彬, 男, 教授, 海水鱼类繁育生物学和分子生态学, E-mail: jbzhang30@163.com
马婕, 李开枝, 邱大俊, 等. 基于高通量测序技术大亚湾肥胖软箭虫()的食性分析[J]. 生态科学, 2021, 40(2): 9–17.
Ma Jie, Li Kaizhi, Qiu Dajun, et al. Dietary analysis ofbased on high-throughput sequencing technology in Daya Bay, China[J]. Ecological Science, 2021, 40(2): 9–17.
