次生林不同演替时间土壤微生物群落结构的变化
2021-04-13郑荧枫李雪万晓华邹秉章王思荣黄志群
郑荧枫,李雪,万晓华,邹秉章,王思荣,黄志群*
(1.福建师范大学 地理科学学院,福州 350007;2.上杭白砂国有林场,福建 上杭 364205)
0 引言
土壤微生物是土壤生态系统重要的功能组分,调控着许多生态学过程,如土壤有机质分解、土壤碳固存和养分循环等,在生态系统中扮演重要的角色[1]。植物光合产物和根系分泌物是土壤微生物最重要的碳源,对土壤微生物的繁殖具有重要的作用[2]。反过来,土壤微生物分解过程也调控着植物所需养分的有效性,从而对树木的生长产生影响。但是,植被生长过程中,微生物群落生物量和微生物群落组成的变化尚未得到深入研究。
土壤条件的变化,包括土壤水分、土壤养分和pH值均会影响土壤微生物群落[3-7]。土壤微生物群落组成与土壤含水量密切相关。由于革兰氏阳性菌比革兰氏阴性菌具有更薄的细胞壁和形成孢子的能力更强,因此,在干燥的条件下革兰氏阳性菌比革兰氏阴性菌更有优势[3]。土壤pH是影响微生物生物量的主要因子,有研究表明当pH的范围在4~8.3之间时,细菌生物量会随着pH增高而增加[4,7]。此外,土壤养分有效性也是影响微生物群落结构的重要因子。Zhou等[5]研究发现土壤碳氮比是影响土壤微生物群落的主要因子,随土壤碳氮比增加,土壤真菌比细菌值增加。土壤微生物生物量和群落结构对土壤环境变化反应敏感,而森林植被生长会影响植被组成,使植物丰富度逐渐增加[6],向土壤中输入的有机质数量增加,同时土壤环境也发生变化。有研究发现,随着林龄增加,土壤有机碳含量持续增加[3],pH值降低,含水量增加[8],进而可能会影响微生物群落。但是,国内外有关林龄对微生物群落影响的研究结果并不一致。Zhao等[9]对喀斯特地区不同演替阶段土壤微生物群落结构的研究发现微生物生物量随着林龄的增加而增加。但是,也有研究认为受中度干扰的影响在中林龄阶段土壤微生物生物量最高[10]。有研究发现自然恢复的天然次生林可以恢复退化的土壤特性并保持土壤肥力[11]。但是,随着次生演替的进行,土壤微生物群落结构特征如何发生变化尚不清楚。明确不同演替阶段次生林土壤微生物群落结构变化,有助于认识森林生态系统的稳定性和恢复力。
假设:(1)随着次生演替的进行,植物丰富度和土壤有机碳含量增加[5,8],微生物总量和各类群微生物生物量增加;(2)随着次生演替的进行,pH值降低、土壤含水量和土壤碳氮比增加[7,9],真菌细菌比值增加,革兰氏阳性菌与革兰氏阴性菌的比值降低。本研究在亚热带地区选取5个(4~5年、8~12年、18~22年、25~30年和35~40年)恢复阶段的天然次生林为研究对象,分析次生林恢复对土壤微生物生物量和群落组成的变化特征,以及探究影响其变化的主要因素,以期为亚热带地区森林管理提供科学依据。
1 研究区与研究方法
1.1 研究区概况
研究区位于福建省龙岩市上杭县白砂国有林场(25°04′~25°15′N,116°30′~116°38′E),属于中亚热带季风气候,海拔为400~800 m,山地坡度为10°~40°,多年平均气温为20.1 ℃,多年平均降雨量1 600 mm,无霜期270天左右。主要地貌类型为低山丘陵;土壤主要由花岗岩发育而成的红壤组成,主要为黏壤土,土层深厚,立地条件中等。天然次生林优势树种由早期的杉木(C.lanceolata)过渡到后期的栲树(Castanopsisfargesii),木荷(Schimasuperba)等当地优势树种组成。林下植被主要有狗脊(Woodwardiajaponica)、芒萁(Dicranopterisdichotoma)、定心藤(Mappianthusiodoides)、毛鳞省藤(Calamusthysanolepis)、短尾越桔(Vacciniumcarlesii)、少叶黄杞(Engelhardtiafenzlii)、油茶(Camelliaoleifera)、黧蒴锥(Castanopsisfissa)等。
1.2 试验地设置
2018年9月到2019年5月期间,选取4~5年、8~12年、18~22年、25~30年和35~40年的5个演替阶段天然次生林为研究对象。4~5年、18~22年、35~40年林分随机布设3个20 m×30 m的真重复样地作为试验小区,8~12年和25~30年林分随机布设4个20 m×30 m的真重复样地作为试验小区。相同林龄段样地之间的间隔>5 km,距离农田、道路或其他类型林地的边缘大于100 m。所选取的样地土壤结构一致,前茬树种均为成熟的天然常绿阔叶林。研究区土壤基本理化性质见表1。
1.3 土壤样品采集与测定
于2019年8月,在不同演替阶段天然次生林的每个试验小区内,用土钻(内径为3.5 cm)在各小区沿着对角线等距离选取10个点,取0~10 cm土层的土壤样品。同一小区的土壤样品均匀混合后装入自封袋中,放于冰盒内保鲜并及时运回实验室。在室内进行土壤样品前处理。剔除土壤样品中的碎石以及植物根系等杂质,然后过2 mm筛网。将土壤样品分为两部分:一部分土样储存在-20 ℃冰箱中,用于土壤微生物群落组成的测定;一部分储存在4 ℃冰箱中,用于土壤含水量、土壤pH、全碳含量等的测定。
土壤容重和含水量用烘干法测定;土壤pH采用土水比为1∶2.5测定;土壤全碳、全氮含量用元素分析仪(Elemental EL MAX CNS analyzer,德国)测定;土壤全磷的测定:用H2SO4-HClO4(4∶1)进行高温消解后,用连续流动分析仪(Skalar San++,荷兰)测定。土壤有效磷的测定在风干的土样中加入0.5 mol·L-1NaHCO3溶液,离心过滤后加入0.6 mL浓硫酸酸化,静置6 h再次过滤,用连续流动分析仪测定。铵态氮和硝态氮含量的测定用2 mol·L-1的KCl溶液浸提(土水比1∶4),用连续流动分析仪测定。
土壤微生物群落组成的测定采用White等[12]的磷脂脂肪酸(Phospholipid Fatty Acid,PLFA)分析法,脂肪酸提取主要过程为在离心管中取新鲜土样(相当于9 g干土重),加入23 mL磷酸缓冲液、三氯甲烷和甲醇(体积比0.8∶1∶2)的混合液,振动2 h,离心,为保证浸提彻底,此步骤重复一次。离心后上清液转移至分液漏斗静置过夜,将下层氯仿相收集并N2吹干。用硅胶柱分别萃取三氯甲烷、丙酮和甲醇的淋洗液,收集最后加入的甲醇相,氮气下吹干;然后进行皂化和甲基化,形成脂肪酸甲酯。PLFA含量用nmol·g-1表示。用气相色谱仪(Agilent 6890N,美国)结合MIDI微生物识别系统(MIDI,Inc.,Newark,DE)鉴定,异构(iso)和前异构(anteiso)甲基支链脂肪酸(i14∶0、i15∶0、i16∶0、i17∶0、a15∶0、a17∶0)指示革兰氏阳性细菌(Gram-positive bacteria,GN)。单一不饱和(monounsaturate-d)和环丙烷脂肪酸(cyclopropane)指示革兰氏阴性细菌(Gram-negative bacteria,GN;包括16∶1ω9c、16∶1ω7c、18∶1ω7c、18∶1ω5c、cy17∶0、cy19∶0ω8c)。18∶1ω9c和18∶2ω6,9c指示真菌群落(Fungi),16∶1ω5c指示丛枝菌根真菌(arbuscular mycorrhizae fungi,AMF),10Me16∶0、10Me17∶0、10Me18∶0脂肪酸标识放线菌(actino-mycetes,ACT)。PLFA的命名方式中i、a、cy和Me,分别表示异、反异、环丙基和甲基分枝脂肪酸;ω、c和t分别表示脂肪端、顺式空间构造和反式空间构造。

表 1 不同演替时间次生林土壤基本特征比Table 1 The comparison of soil basic characteristics of secondary forest among different succession time
1.4 数据处理
采用SPSS 22.0和Canoco 5.0软件对数据进行统计分析。利用单因素方差分析(one-way ANOVA)和LSD多重比较法检验不同林龄次生林土壤微生物特性的差异,显著性(α=0.05)。采用Pearson相关分析土壤理化性质与微生物生物量、真菌生物量、细菌生物量、革兰氏阳性菌生物量与革兰氏阴性菌生物量、放线菌生物量、真细菌比、革兰氏阳性菌与革兰氏阴性菌比值之间的关系。采用主成分分析(Principal Component Analysis,PCA)比较不同林龄次生林间土壤微生物群落结构的差异。采用冗余分析(Redundancy Analysis,RDA)确定影响土壤微生物群落组成的主要环境因素。利用Origin 9.0作图。
2 结构与分析
2.1 不同林龄土壤微生物群落结构特征

注:数据为“平均值±标准差”, 4~5年、18~22年、35~40年林分的样本量n=3;8~10年和 25~30年林分的样本量n=4,不同小写字母表示不同演替阶段次生林之间差异显著(P<0.05)。图 1 不同演替时间次生林土壤微生物结构Figure 1 The compositions of soil microbial community in different succession time of secondary forest

图 2 不同演替时间次生林磷脂脂肪酸的主成分分析 Figure 2 Principal component analysis of PLFAs structures in different succession time of secondary forest
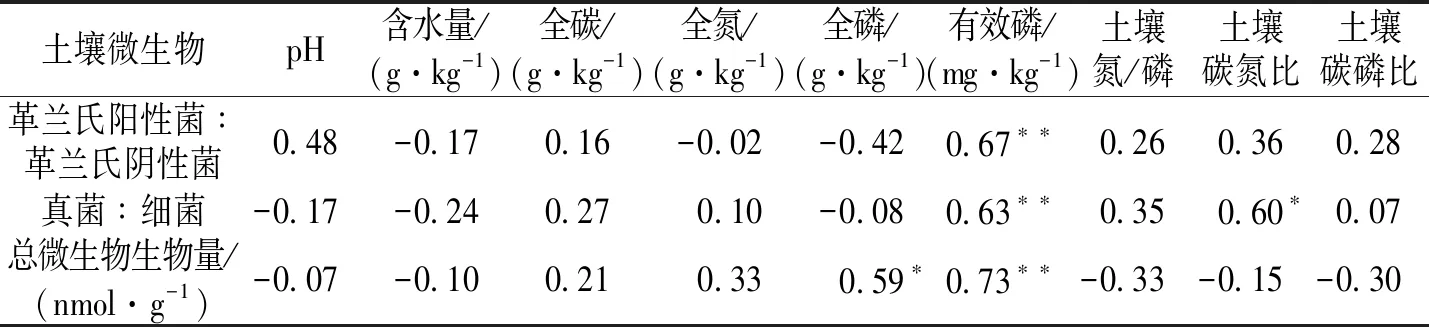
表 2 土壤微生物与土壤理化性质的Pearson相关分析 Table 2 Pearson correlations between microbial and soil physicochemical properties

图 3 土壤微生物群落组成与土壤理化性质冗余分析 Figure 3 Redundancy analyses for soil microbial community composition based on physicochemical properties
在所有演替阶段中,8~12年林分的微生物总量为18.33 nmol·g-1,显著高于4~5年和18~22年林分(图1a,P<0.05)。与之相同,真菌生物量在8~12年林分最高,显著高于4~5年和18~22年林分(图1b,P<0.05)。森林演替对细菌生物量、革兰氏阳性菌生物量和革兰氏阴性菌生物量均存在明显影响(图1c),且均表现为8~12年林分的生物量显著高于4~5年和18~22年林分(P<0.05)。但是,森林演替对放线菌的影响不显著(图1c,P>0.05)。4~5年林分的革兰氏阳性菌与革兰氏阴性菌比值最高,显著高于8~12年和25~30年林分(图1d,P<0.05)。并且,4~5年林分的真菌细菌比最高,显著高于8~12年林分(图1e,P<0.05),与其他演替阶段无显著差异。
不同演替阶段次生林的18种磷脂脂肪酸主成分分析表明,各演替阶段的微生物群落组成存在显著差异(图2)。第1、2主成分对微生物群落结构差异的贡献值分别为27.66%、23.35%。其中,4~5年林分次生林与25~30年林分次生林存在显著性差异(P<0.05)。
2.2 土壤微生物生物量、群落结构与土壤土壤理化性质关系
相关分析结果表明(表2),革兰氏阳性菌与革兰氏阴性菌比值与土壤有效磷极显著正相关(P< 0.01)。土壤真菌细菌比与土壤有效磷极显著正相关(P<0.01),与土壤碳磷比显著正相关(P<0.05)。总微生物生物量与全磷显著正相关(P<0.05),与土壤碳氮比极显著正相关(P<0.01)。冗余分析结果显示,土壤微生物群落结构与土壤碳磷比、pH、铵态氮、容重以及碳有关(图3)。其中,土壤碳磷比和真菌(18∶1ω9c,16∶1ω5c,18∶2ω69c)、放线菌(10Me17∶0,10Me18∶0)正相关,与革兰氏阳性菌(i15∶0,a15∶0)和革兰氏阴性菌(18∶1ω7c,16∶1ω7c,cy17∶0,cy19∶w8c,16∶1ω9c)负相关。pH与革兰氏阴性菌(18∶1ω7c,16∶1ω7c,cy17∶0,cy19∶w8c,16∶1ω9c)与放线菌(10Me17∶0,10Me18∶0)、革兰氏阳性菌(i14∶0,i16∶0,i17∶0,a17∶0)负相关。
3 讨论
土壤微生物几乎参与土壤中所有生态过程,微生物丰度的大小能反映土壤矿化能力的变化,是评价土壤活性的重要指标之一[10]。相关研究表明,不同发育阶段的林分土壤微生物生物量存在显著差异。刘顺等[16]对不同林龄陈山红心杉土壤微生物的研究发现,随着林分林龄的增加,土壤总磷酸脂肪酸含量及各类群微生物磷酸脂肪酸含量均呈现先降低后增加的变化趋势。这种趋势产生的原因可能是林分发育前期,树木生长需要大量养分导致微生物可利用的养分减少,林分发育到后期养分周转速率变慢,增加了土壤微生物可利用的养分,从而增加了土壤微生物生物量[17]。Zhao等[10]研究发现,在森林演替过程中土壤总磷酸脂肪酸含量、各类群微生物磷酸脂肪酸含量均呈现增加的趋势,这与不同演替阶段的植被组成有关。此结果与本研究不一致。本研究通过磷脂脂肪酸分析方法发现,磷脂脂肪酸总量、细菌生物量、真菌生物量、革兰氏阳性菌和革兰氏阴性菌生物量在8~12年林分最高,且显著高于4~5年和18~22年林分,与25~30年和35~40年林分间没有显著差异。与假设1不一致。相关分析结果显示,全磷、有效磷含量与总微生物生物量呈正相关。亚热带地区长期处于磷匮乏状态,土壤磷成为限制植物生长的关键因子。在次生林生长发育过程中,4~5年和18~22年林分土壤磷含量较低,可能不利于植物生长,从而导致土壤微生物的生长和代谢活动下降。因此,土壤磷含量有可能是限制微生物生长的主要因子。
土壤微生物对其生存环境的变化反应敏感,土壤微生物群落结构的变化反映了微生物与其环境之间相互作用的变化[18]。Kuramae等[19]对白垩草地各次生演替阶段土壤微生物群落结构的研究结果发现不同演替阶段土壤微生物群落结构相似。本研究结果表明,4~5年次生林与25~30年次生林微生物群落结构存在显著性差异,但其他林龄土壤微生物群落结构间均不存在显著性差异。冗余分析的结果表明,土壤碳磷比、土壤pH、铵态氮、土壤容重以及土壤碳是影响微生物群落结构的主要环境因子。但是,这些环境因子在次生林不同演替时间没有显著差异,即林龄对土壤微生物群落结构的影响并不明显,仅个别林分土壤微生物群落结构具有差异性。
研究结果表明,4~5年林分次生林真菌细菌比和革兰氏阳性细菌与革兰氏阴性细菌比均高于其他林龄林分。这与假设2不一致。有研究表明,真菌与细菌在森林生态系统有机质分解中具有十分重要的作用,细菌主导型分解途径通常在营养丰富(低碳氮比)的土壤占优势地位;而真菌主导型分解途径通常在低营养(高碳氮比)的土壤中占优势地位[5]。在一定程度上真菌与细菌比能够反映出土壤食物网的结构和功能对不同土壤条件的响应[20]。相关研究显示,不同林分发育阶段土壤真菌细菌比明显不同。Jia等[21]发现在中国半干旱黄土高原废弃地上的自然演替过程中真菌细菌比呈增加的趋势。产生这种结果的原因可能是随着森林的生长发育,土壤中的难分解有机质增加而易分解有机质减少,真菌相较于细菌具有更强的腐解能力,善于分解难分解有机质,因此,随着林龄的增加,真菌生物量在土壤中高于细菌生物量[22]。但是,Kuramae等[19]对草地上的自然演替研究发现,随着自然演替进行真菌细菌比降低。这与本研究相似。在本研究中,真菌细菌比在4~5年林分次生林中最高。相关分析结果显示,真细菌比值与土壤碳氮比、土壤有效磷含量呈正相关关系,这表明真菌细菌比受到土壤碳氮比和有效磷含量影响,在土壤碳氮比和有效磷含量较高的土壤中比值更高。此外,尽管革兰氏阳性细菌和革兰氏阴性细菌生物量随着次生林林龄增加的变化趋势相同。但是4~5年林分革兰氏阳性细菌与革兰氏阴性细菌比显著高于8~12年和25~30年林分。有研究认为革兰氏阳性细菌与革兰氏阴性细菌比在森林生长过程中与土壤含水率和土壤质量的变化有关[23]。Zhou等[5]人研究发现革兰氏阳性菌与革兰氏阴性菌比值与土壤碳氮比呈正相关,表明革兰氏阳性菌在高碳氮比土壤中更为普遍,而革兰氏阴性菌在低碳氮比土壤中占优势。但在本研究中,土壤碳氮比和土壤含水量对革兰氏阳性细菌与革兰氏阴性细菌比无显著影响,可能是由于本研究中土壤碳氮比和土壤含水量的变化范围较小,尤其是土壤碳氮比在不同林龄林分间未达到显著差异。在本研究中,革兰氏阳性细菌与革兰氏阴性细菌比值与有效磷含量呈正相关关系,因此,有效磷含量可能是导致4~5年林分革兰氏阳性菌与革兰氏阴性菌比高于其他林分的主要影响因子。
4 结论
本研究发现,土壤微生物群落组成受土壤特性(pH、土壤碳磷比等)的影响。随着次生林生长,土壤微生物总生物量和各类群微生物生物量的变化趋势基本一致,均表现为在8~12年林分最高,主要受到土壤磷含量的影响。在次生林演替过程中,土壤特性与微生物群落密切相关。
