SGLT1介导高糖诱导的心脏成纤维细胞激活
2021-04-13王平孟立平刘龙斌郭航远
王平,孟立平,刘龙斌,郭航远,3,4
1.绍兴市人民医院 浙江大学绍兴医院 心内科,浙江 绍兴 312000;2.绍兴文理学院附属医院 绍兴市立医院 心内科,浙江 绍兴 312000;3.温州医科大学 研究生院,浙江 温州 325035;4.绍兴文理学院医学院,浙江 绍兴 312000
糖尿病性心肌病(diabetic cardiomyopathy,DCM)是发生在糖尿病患者身上的一种独立于冠心病、心脏瓣膜病等心血管疾病的影响心脏结构和功能的病变[1]。糖代谢异常及微血管病变所引起的心肌细胞凋亡和心脏纤维化是DCM的主要病理特征,导致患者心功能损害,并最终进展为心力衰竭、心律失常及心源性休克。随着糖尿病的发病率在全球逐年增加,DCM的发病率也随之升高,已成为影响糖尿病患者生活质量以及预后的重要因素[2]。
心脏成纤维细胞的激活和心肌细胞的变性是心脏重构的细胞生物学基础,也是DCM形成的病理生理基础[2]。心脏成纤维细胞由静止型活化为激活型,增殖和迁移能力增加,并开始大量分泌细胞外基质,分泌MMP-2和TIMP-1等影响细胞外基质动态平衡的蛋白酶,造成心脏间质的纤维化,最终导致心肌重构[3-4]。
钠-葡萄糖协同转运蛋白(sodiumglucose cotransporter,SGLT)属于溶质载体5基因家族,以消耗能量的方式逆浓度梯度转运葡萄糖,在葡萄糖的主动转运过程中起着重要的作用[5]。我们过去的研究发现高糖可以促进心脏成纤维细胞中SGLT1和MMP-2的表达[6],但是高糖是否是通过诱导心脏成纤维细胞激活从而促进心脏的纤维化,SGLT1是否参与高糖诱导的心脏成纤维细胞激活尚未见研究报道。本研究拟通过细胞实验探索高糖是否能促进心脏成纤维细胞的激活以及SGLT1在其中的作用。
1 材料和方法
1.1 材料 葡萄糖购自美国Sigma公司;胎牛血清、胰酶以及青霉素和链霉素购自美国Gibco公司;DMEM培养基(用于后续实验)、DMEM高糖培养基(用于原代细胞培养)、PBS购自杭州吉诺公司;MTT、EdU购自美国Emresco公司;Transwell小室购自美国康宁公司;DAPI购自美国Rcohe公司;Lipofectamine 3000转染试剂和TRIzol RNA试剂盒购自美国Invitrogen公司;反转录试剂盒购自北京Promega公司;si-SGLT1购自上海吉凯生物公司;SGLT1抗体购自美国Abcom公司;辣根过氧化酶及FITC标记的二抗购自美国Jackson公司;蛋白免疫印迹相关试剂购自苏州碧云天生物技术研究所。
1.2 方法
1.2.1 分组及干预:为了探索高糖对心脏成纤维细胞激活的影响,用不同浓度的葡萄糖干预心脏成纤维细胞,将细胞分为4组,对照组(不加任何干预因素),5.5 mmol/L葡萄糖组,30 mmol/L葡萄糖组,100 mmol/L葡萄糖组。为了进一步探索SGLT1在高糖诱导的心脏成纤维细胞激活中的作用,将带有si-SGLT RNA的质粒转染进心脏成纤维细胞中抑制细胞中SGLT1的表达,将细胞分为3组,对照组(不加任何干预因素),高糖组(加浓度为30 mmol/L的葡萄糖),si-SGLT1组(在转染si-SGLT质粒之后,再加入30 mmol/L的葡萄糖)。
1.2.2 光镜下观察细胞形态:取4~7代培养细胞,0.25%胰蛋白酶消化单层心脏成纤维细胞,用含10%胎牛血清的DMEM培养基配成细胞悬液并计数,以每孔1×106个细胞接种于6孔培养板中。待细胞贴壁后,无血清培养基培养24 h使细胞同步化。各组细胞按上述分组分别干预,细胞于37 ℃、5% CO2孵箱培养24 h后,光镜记录各组细胞形态。
1.2.3 MTT法检测细胞增殖:每孔6×103个心脏成纤维细胞接种于96 孔板中。各组细胞按上述分组加入对应浓度的干预因子,每组设4个复孔,2个不加细胞的空白对照孔。细胞于37 ℃、5% CO2孵箱培养24、48、72 h。培养结束,每孔加入MTT液20 μL,37 ℃继续孵育4~6 h,终止培养,小心弃去培养上清液,每孔加入150 μL DMSO,震荡10 min,选择490 nm波长于酶联免疫检测仪测定各孔吸光值并记录。以时间为横轴,吸光值为纵轴绘制心脏成纤维细胞生长曲线。
1.2.4 EdU法测细胞增殖能力:将按上述分组要求处理的细胞调整浓度为1×104/mL,取100 μL接种于96孔板,用EdU孵育2 h后用多聚甲醛固定,流水冲洗后,用2 μg/mL的DAPI染核,PBS冲洗后,荧光显微镜下随机取5个视野计数穿膜细胞数和EdU染色阳性细胞数并记录。
1.2.5 细胞划痕实验测细胞迁移能力:细胞铺满板底后,无血清培养基培养24 h使细胞同步化,加入1.8 mmol/L羟基脲作用12 h抑制细胞增殖。用100 μL黄色枪头垂直于孔板制造细胞划痕,吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片。加入各组相应的干预因子,拍照记录0、12、24、48、72、96 h图片,用Image Pro Plus 6.0分析计算出细胞迁移的面积,细胞迁移的面积与最开始的划痕面积的比值表示迁移的多少。
1.2.6 Transwell法测细胞迁移能力:取4~7 代心脏成纤维细胞,血清饥饿使细胞同步化,加入1.8 mmol/L羟基脲作用12 h抑制细胞增殖,0.25%胰蛋白酶消化单层心脏成纤维细胞,用含有各组干预因子的DMEM培养基(无血清)配成细胞悬液并计数(3×104/mL)。各组24孔板配套的Transwell小室(0.8 μm)上室加入200 μL细胞悬液,下室加入含有10%胎牛血清的DMEM培养基500 μL,分别培养4、8、12、24、48 h。干预结束后以棉签轻轻擦去上层未穿透膜的细胞,取下Transwell半透膜,TBS洗涤3次,3.7%多聚甲醛室温固定5 min,流水冲洗后,用2 μg/mL的DAPI染核,PBS冲洗后,荧光显微镜下随机取5个视野计数穿膜细胞数并记录。
1.2.7 转染细胞株:si-SGLT1 质粒的构建:si-SGLT1质粒由上海吉凯公司设计合成,通过PubMed查找SGLT1基因的序列,引物根据GeneBank中SGLT1 mRNA序列设计引物。si-SGLT1基因和质粒DNA连接后,筛选重组质粒,测序验证。转染:将心脏成纤维细胞系接种至6孔板,生长至50%~70%密度时,以脂质体3000分别转染空质粒或si-SGLT1质粒各100 pmol 24 h后,提取总RNA/蛋白后,PCR/Western blot鉴定转染效率。
1.2.8 荧光定量RT-PCR检测基因表达:提取细胞中总RNA,将提取的RNA反转录成cDNA,反应体系为20 μL,反应条件为:16 ℃(30 min),45 ℃(30 min),85 ℃(5 min)。运用SYBR Green法检测SGLT1、SMα、Tcf21的表达情况,反应条件为:94 ℃(15 min),94 ℃(30 s),60 ℃(30 s),72 ℃(30 s),共循环40次;最后72 ℃延伸8 min。每次扩增设置无模板cDNA的阴性对照,内参基因GAPDH为阳性对照。每组样品重复3 次,试验重复3 次,使用2-△△Ct法计算各标本中mRNA的表达。
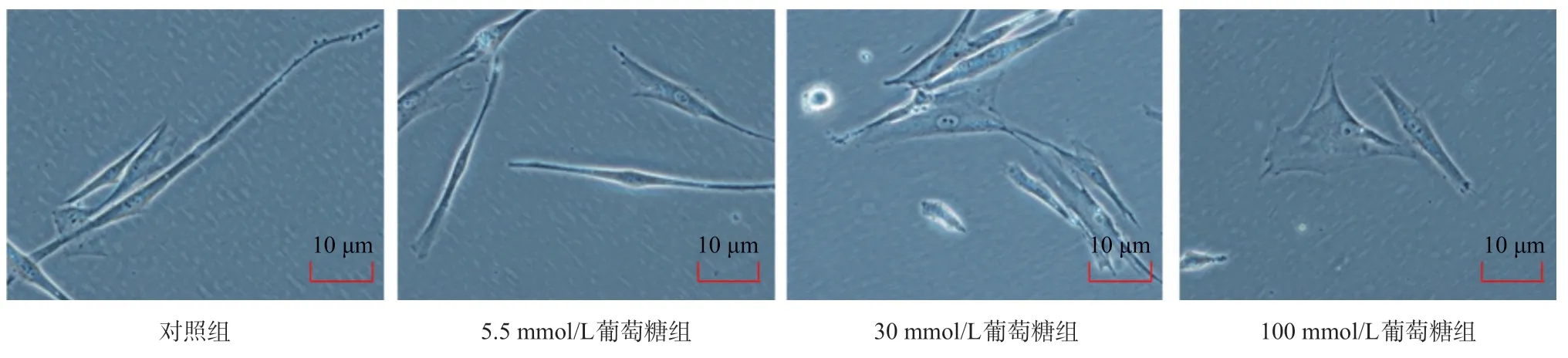
图1 高糖诱导的活化成纤维细胞的形态
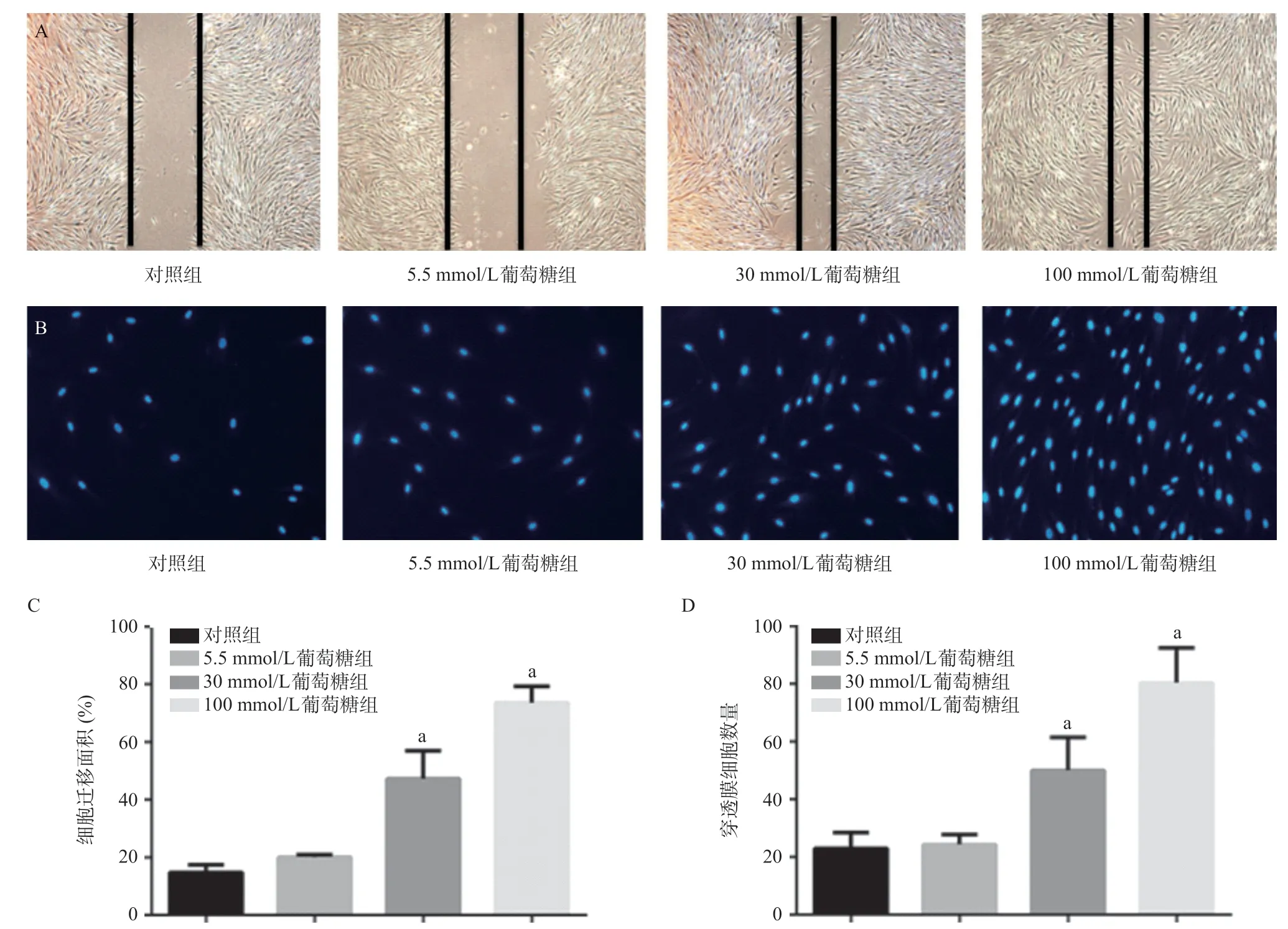
图2 高糖促进细胞迁移
1.2.9 Western blot测定心脏成纤维细胞中SGLT1的表达:各个干预因子干预48 h之后,裂解细胞提取蛋白,BCA法蛋白定量,SDS-PAGE胶每孔加入20 μL样品,80 V 30 min进行蛋白浓聚,120 V 2 h进行凝胶电泳,并用孔径0.45 μm硝酸纤维素膜250 mA 90 min进行转膜。转膜完毕经常温下TBST洗膜3次、脱脂奶粉封闭2 h后加入SGLT1一抗(1:1 000),4 ℃孵育过夜,常温下TBST洗膜3次,辣根过氧化物酶标记的二抗孵育后ECL化学发光法检测目标蛋白。暗室柯达胶片显影,Quantity One软件定量分析。

图3 高糖促进细胞增殖
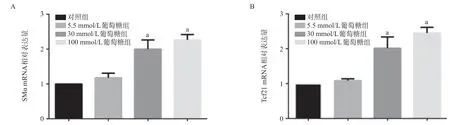
图4 高糖增加激活型成纤维细胞标志物的表达
1.2.10 免疫荧光法检测各组中SGLT1在细胞中的分布及表达:将细胞接种于96孔板,每孔3 000~5 000个细胞,待细胞贴壁后加入各组干预因子,在细胞融合之前进行检测。先PBS洗3遍,用4%多聚甲醛固定,0.25% Triton×100穿破细胞膜,山羊血清室温封闭1 h,加入稀释了250倍的anti-SGLT1抗体,4 ℃过夜,PBST清洗3遍之后加入结合有FICT或者FRICT的二抗,室温孵育1 h后PBST清洗3遍,荧光显微镜拍照后Iamge Pro Plus 6.0分析。
1.3 统计学处理方法 实验数据分析采用SPSS20.0软件分析。计量资料以±s 表示,每组实验重复3次,多组间比较采用单因素方差分析,两两比较采用SNK-q 法。P<0.05为差异有统计学意义。
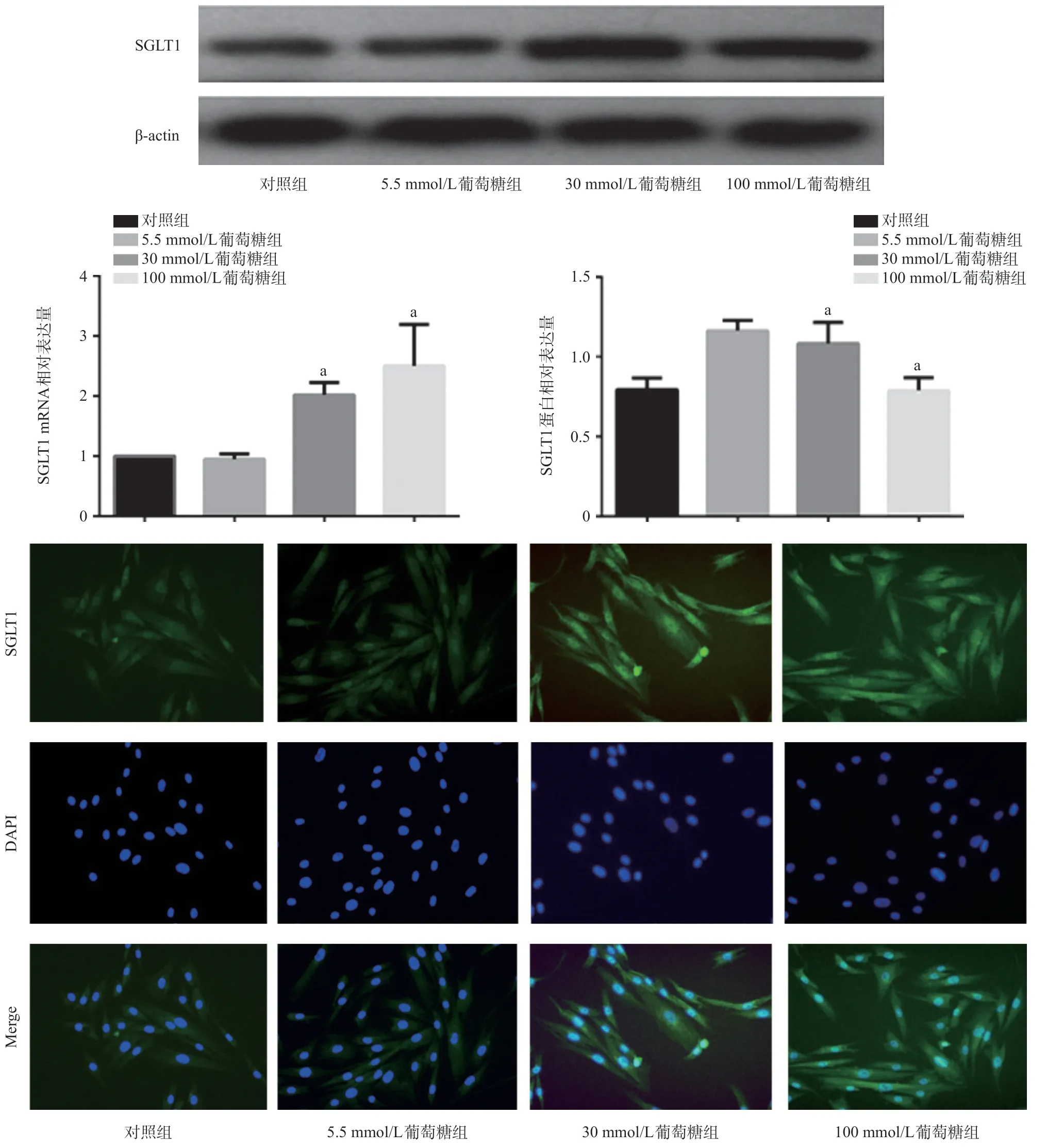
图5 高糖促进成纤维细胞中SGLT1的表达(免疫荧光,×100)

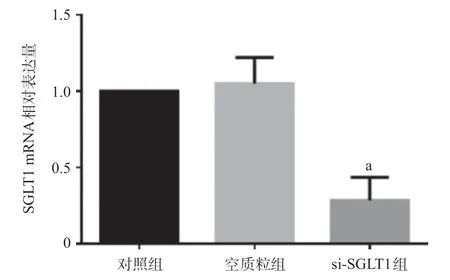
图6 si-SGLT1质粒转染入细胞的转染效率(×20)
2 结果
2.1 高糖对心脏成纤维细胞形态的影响 光镜下各组细胞的形态不同,对照组中的心脏成纤维细胞细长,呈典型的梭形,用不同浓度的高糖干预后,细胞失去细长的形态,逐渐变短,变圆,见图1。
2.2 高糖促进心脏成纤维细胞的迁移能力 划痕和Transwell实验结果显示在加入各组干预因素后,相比于对照组,30、100 mmol/L葡萄糖组细胞迁移能力增加(P<0.05),且随葡萄糖的浓度增加而增加,见图2。
2.3 高糖促进心脏成纤维细胞的增殖能力 EdU实验和MTT检测结果显示,30、100 mmol/L葡萄糖促进心脏成纤维细胞增殖(P<0.05),且随葡萄糖浓度增加而增强,见图3。
2.4 高糖促进心脏成纤维细胞中SMα、Tcf21 的表达 RT-qPCR结果显示,相比于对照组,30、100 mmol/L葡萄糖组细胞中SMα和Tcf21的表达增加(P<0.05),并与葡萄糖的浓度呈正相关,见图4。
2.5 高糖促进心脏成纤维细胞中SGLT1 的表达RT-qPCR和Western blot实验结果显示,相比于对照组,30、100 mmol/L葡萄糖组细胞中SGLT1在mRNA和蛋白水平的表达都增加(P<0.05);免疫荧光染色结果显示心脏成纤维细胞中有SGLT1的表达,SGLT1主要表达于细胞内而非细胞膜上,并且高糖可以增加细胞中SGLT1的表达。见图5。
2.6 荧光显微镜及PCR观察转染效率 质粒转染6 h后,于荧光显微镜下观察发现带有荧光的质粒转入细胞内,RT-qPCR进一步验证结果显示,si-SGLT1组细胞中SGLT1 mRNA表达降低(P<0.05),见图6。
2.7 高糖通过上调SGLT1促进心脏成纤维细胞激活相较于30 mmol/L葡萄糖组,si-SGLT1组细胞形态细长,细胞迁移能力和增殖能力减弱,细胞中SMα、Tcf21和SGLT1的表达降低(P<0.05),提示敲除SGLT1可以抑制高糖诱导的心脏成纤维细胞激活,见图7。
3 讨论
在正常心脏组织中,心脏成纤维细胞处于静息状态,主要起构成心脏网状纤维结构的作用。静止型心脏成纤维细胞外观呈梭形,增殖和迁移能力弱[7]。当受到各种炎症介质、细胞因子、物理张力等病理刺激的作用下,静止型的心脏成纤维细胞被激活,转化成激活型的成纤维细胞。激活型的细胞具有以下特点:①各种促炎和促纤维化因子表达水平升高,直接促成炎症细胞浸润和成纤维细胞增殖;②分泌高水平的MMP以促进成纤维细胞迁移;③促进胶原蛋白和其他细胞外基质蛋白的沉积,导致瘢痕形成;④表达SMα、Tcf21等特异性的标志蛋白[3,8-10]。在各种病理因子的刺激下,被激活的心脏成纤维细胞大量增殖迁移并分泌MMP-2等促进心脏重构的蛋白酶,最终导致心脏纤维化瘢痕组织的形成和心脏的重构。在本研究中,我们发现高糖可以改变心脏成纤维细胞形态,促进细胞的增殖和迁移,并且增加细胞中SMα和Tcf21的表达,上述结果表明高糖可以促经心脏成纤维细胞的激活。这可能是高糖引起心脏纤维化和心脏重构,最终导致DCM形成的病理机制。

SGLT1以消耗能量的方式逆浓度梯度将葡萄糖转运入细胞内,在机体的糖代谢中具有重要的作用。过去认为SGLT1只表达于小肠刷状缘和肾近曲小管,在人体其他器官没有表达,ZHOU等[11]的研究结果首次发现心肌细胞中也有SGLT1的表达,并且陆续有研究报道心脏中SGLT1的表达与一些心脏疾病密切相关。BANERJEE等[12]通过检测死亡患者的心脏标本,发现SGLT1在缺血性心肌病和扩张性心肌病患者心脏中表达增加。同样的,DI FRANCO等[13]通过检测9例缺血性心肌病和5例肥厚性心肌病患者的心脏组织,发现SGLT1的表达增加。我们过去的研究发现除心肌细胞之外,心脏成纤维细胞中也有SGLT1的表达[6]。但是,心脏成纤维细胞中的SGLT1是否参与DCM的进程,SGLT1在DCM的发生发展中起到了怎样的作用,目前尚未见有研究报道。
MARGOLSKEE等[14]发现高糖可以促进SGLT1在小肠上皮细胞中的表达,LEE等[15]发现葡萄糖还可以促进肾小管上皮细胞中SGLT1的表达。与上述研究结果相似,本研究用不同浓度的葡萄糖干预心脏成纤维细胞,发现高糖可以促进心脏成纤维细胞的激活的同时,也可以促进心脏成纤维细胞中SGLT1的表达。为了进一步验证SGLT1在高糖诱导的心脏成纤维细胞激活中的作用,我们使用si-SGLT1预先敲除细胞中SGLT1的表达,发现si-SGLT1可以抑制高糖诱导的心脏成纤维细胞激活,上述结果表明高糖通过上调SGLT1促进心脏成纤维细胞激活。
SGLT1是葡萄糖转运载体,在DCM的发展过程中,心脏一直处于高糖负荷状态,高糖上调的SGLT1可以将更多的葡萄糖转运入心脏成纤维细胞,增加细胞内葡萄糖和能量负荷,进一步引起细胞内的代谢紊乱,最终导致心脏成纤维细胞的激活[12,16-17]。基于以上分析,结合我们过去发现的SGLT1抑制剂可以降低高糖诱导的MMP-2的表达,恢复细胞外基质的动态平衡这一结果[6],推测抑制SGLT1可以减少高糖诱导的心脏成纤维细胞激活,对糖尿病患者来讲,SGLT1抑制剂具有心脏保护作用。
