ox-LDL刺激的巨噬细胞中circRNAs差异表达及功能预测
2021-04-13叶浡之梁晓荷赵翊含薛淇泽黄周青蔡雪黎
叶浡之,梁晓荷,赵翊含,薛淇泽,黄周青,蔡雪黎
1.温州市心血管疾病研究重点实验室,温州医科大学附属第一医院 心血管内科,浙江 温州 325015;2.温州医科大学 第二临床医学院,浙江 温州 325035
冠状动脉粥样硬化性心脏病(冠心病)是心血管系统常见疾病,是人类致死的主要原因之一[1]。在冠心病的早期阶段即动脉粥样硬化起始阶段给予干预是预防冠心病的有效策略[2]。单核细胞在趋化因子的作用下迁入内皮膜下活化为巨噬细胞[3],吞噬同样在内膜下积聚的氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL),促进早期斑块脂质条纹的形成,同时巨噬细胞释放大量炎性因子,在动脉粥样硬化的进程中持续发挥作用[4]。探索ox-LDL刺激下巨噬细胞的生物学活动有助于更好地理解动脉粥样硬化的病理生理机制。
环状RNAs(circRNAs)是近年来非编码RNA研究中的明星分子,能够在转录后水平调控mRNA的表达,进而在心血管疾病如高血压[5]、心力衰竭[6]、心肌梗死[7]过程中发挥重要作用,但circRNAs是否可以通过调控ox-LDL刺激下的巨噬细胞生物学活动参与动脉粥样硬化的进展尚未见报道。因此,本研究利用ox-LDL构建巨噬细胞炎症模型,通过基因芯片结合生物信息学分析,预测circRNAs在ox-LDL刺激下的巨噬细胞炎症反应中的潜在作用机制。
1 材料和方法
1.1 细胞培养及巨噬细胞炎症模型制备 THP-1细胞购于美国模式培养物集存库(American type culture collection,ATCC)。在37 ℃,5% CO2的细胞培养箱中使用1640完全培养基(含10%胎牛血清和1%青链酶素混合液)培养THP-1细胞。实验细胞分为对照组和ox-LDL组。将THP-1细胞以每孔1×106个接种在六孔板中,用终浓度为100 nmol/L的佛波醇12-十四酸酯13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)处理48 h,诱导THP-1分化为贴壁的巨噬细胞,并给予ox-LDL(50 μg/mL)刺激巨噬细胞24 h构建巨噬细胞炎症模型作为ox-LDL组[8]。对照组细胞诱导成巨噬细胞后,不给予ox-LDL刺激。
1.2 油红染色 细胞经过ox-LDL刺激24 h后弃细胞培养基,用PBS洗2遍,加固定液固定30 min。随后弃固定液,用蒸馏水清洗2遍,加入60%异丙醇浸洗5 min。弃异丙醇后根据油红染色试剂盒说明书(北京索莱宝科技有限公司)进行后续染色实验。封片后光镜下观察并拍照。
1.3 ELISA检测 细胞经过ox-LDL刺激24 h后收集细胞上清液,根据ELISA说明书(上海西唐生物科技有限公司)分别进行IL-1β、IL-6及TNF-α含量的检测。
1.4 RNA提取与芯片检测 细胞处理后弃上清液,用预冷的PBS洗涤后,用Qiagen试剂盒提取大于5 μg的总RNA样品,并用RNasey Mini Kit(Qiagen p/n74104)进行RNA的纯化。采用Quick Amp Labeling Kit,One-Color(Agilent p/n 5190-0442)对RNA样本进行荧光Cy3标记及效率控制。运用Agilent Gene Expression Hybridization Kit(Agilent p/n 5188-5242)将标记的RNA与circRNA芯片杂交。通过激光扫描仪[Agilent Microarray Scanner(Agilent p/n G2565BA)]对Cy3特异性荧光标记的图像进行采集,通过Agilent Feature Extraction软件对杂交图像进行数字化转换。
1.5 qRT-PCR 细胞处理完成后加预冷的PBS洗涤,用TRIzol试剂盒提取细胞内的RNA。根据反转录试剂说明书[宝日医生物技术(北京)有限公司]将RNA反转录为cDNA。随后利用qRT-PCR检测circRNA的相对含量。
1.6 差异circRNAs的筛选及基因本体(gene ontology,GO)分析 在使用Agilent Feature Extraction软件对杂交图像进行数字化转换后,进行数据分析,筛选差异表达的circRNAs。在进行数据处理时首先扣除背景,计算重复点平均值和标准偏差,然后通过LOWESS(Locally-Weighted Regression)过滤进行标准化。计算两组(对照组和ox-LDL组)检测信号的比值(log2)和t检验的P值。以P<0.05为显著差异性表达。数据处理结果进行均一化后,筛选出差异表达的circRNAs。对mRNA芯片结果中差异基因进行GO分析,以判断差异基因主要涉及的生物学功能。
1.7 基因共表达分析 基于circRNA和mRNA芯片结果,通过Genecards、PubMed等数据库及DAVID 6.7工具进行生物信息学分析,利用基因相关度筛选,将circRNAs及与其相关度高的mRNAs做共表达分析。1.8 circRNA靶基因预测 通过TargetScan和miRanda数据库以及Starbase软件预测与circRNA存在潜在结合的miRNAs。
1.9 统计学处理方法 使用GraphPad Pro Prism 7.0软件进行统计分析。所有实验结果至少重复3次,以±s表示,两组间比较采用Student’s t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 巨噬细胞炎症模型构建 ox-LDL刺激单核源巨噬细胞后,油红染色镜下观察到巨噬细胞中脂滴增多(见图1A),细胞上清中炎症因子IL-1β、IL-6和TNF-α含量在ox-LDL组中均有上调(P<0.05,见图1B-D),说明巨噬细胞炎症模型构建成功。
2.2 circRNAs芯片结果分析 细胞造模成功后,利用Arraystar Human circRNA芯片筛选差异表达的circRNAs,结果如图2A所示,在散点图中的纵坐标是样本归一化后的信号值(log2缩放),在顶端绿色折线和底端绿色折线之间的信号点是筛选后在对照组和ox-LDL组中差异表达大于1.5倍的circRNAs。统计学分析结果如图2B火山图所示,两条垂直的绿色折线对应于1.5 倍差异,水平绿色折线代表P值为0.05,可以看出其中有7条circRNAs在ox-LDL组中差异表达显著。图2C为芯片分析得出的7 条circRNAs在对照组与ox-LDL组中的相对表达量,其中绿色表示低表达量,红色表示高表达量,结果显示,5条circRNAs表达上调,2条circRNAs表达下调。

图1 ox-LDL刺激巨噬细胞的炎症模型构建

图2 芯片筛选ox-LDL刺激下巨噬细胞中差异表达的circRNAs
2.3 细胞内circRNAs表达量的验证 qRT-PCR检测7 条circRNA在细胞内的相对表达量,结果提示除circRNA_0026218 无变化外,其余4 条circRNAs(circRNA_0008896、circRNA_0007478、circRNA_0007085和circRNA_0092327)在ox-LDL刺激后的巨噬细胞中表达上调,2条circRNAs(circRNA_0048492和circRNA_0082139)表达下调,见表1。
2.4 GO分析 GO分析结果显示,ox-LDL刺激巨噬细胞的过程中具有差异表达的mRNAs与细胞因子、信号转导等方面密切相关,而其分子功能也涉及基因转录、受体活性调节等方面,细胞组分主要涉及脂蛋白颗粒。评分前十的结果见图3。

表1 ox-LDL刺激下巨噬细胞中差异表达circRNAs

图3 ox-LDL刺激下巨噬细胞中差异表达mRNAs的GO分析
2.5 circRNAs与mRNAs共表达分析 根据circRNA及mRNA芯片分析结果,将7 条差异表达显著的circRNAs与mRNAs做了共表达分析,结果如图4基因共表达网络图所示,与这7条circRNAs存在共表达的mRNAs参与动脉粥样硬化的进程。
2.6 CircRNA_0007478 的功能预测 目前对circRNAs研究较多的是circRNAs作为内源竞争RNA(ceRNA)竞争结合miRNA进而调控下游靶蛋白的表达,发挥效应。本研究选取了circRNA_0007478做进一步分析。如图5A所示,通过TargetScan和miRanda 数据库以及Starbase 软件预测发现,circRNA_0007478与5条miRNAs(miRNA-765、miRNA-412、miRNA-487a、miRNA-619、miRNA-651)存在碱基配对关系,可能为其靶基因,其中miRNA-765被报道与心血管疾病可能相关。对miRNA-765的下游靶基因进行预测分析,发现miRNA-765下游有多个靶基因与动脉粥样硬化相关。如图5B所示,将与circRNA_0007478共表达的mRNAs与miRNA-765潜在的靶mRNAs取交集发现,人RecQ解螺旋酶3(WRN)这个基因与circRNA_0007478 存在共表达,且是miRNA-765潜在的靶基因。
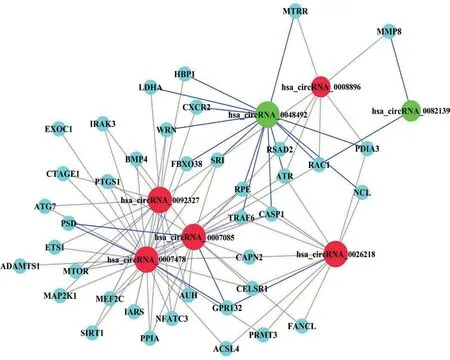
图4 ox-LDL刺激下巨噬细胞中circRNAs与mRNAs的基因共表达网络图

图5 circRNA_0007478靶基因预测
3 讨论
本研究基于基因芯片技术及生物信息学分析,发现在ox-LDL刺激巨噬细胞过程中存在circRNAs的差异表达。基于mRNA芯片的GO分析和共表达分析,差异表达的mRNAs与炎症、细胞因子及信号通路调节密切相关,提示在ox-LDL刺激的巨噬细胞中,circRNAs的功能研究可以从炎症方面进行探索。
利用circRNA芯片可以高通量地筛选在疾病发生过程发生变化的circRNAs,但是芯片的结果存在一定的假阳性,因此我们利用qRT-PCR进行验证。结果提示除circRNA_0026218无变化外,其余4条circRNAs在ox-LDL刺激后的巨噬细胞中表达上调,2条circRNAs表达下调,且变化倍数与芯片结果相近,提示芯片检测的质量可。
近年来,人们对circRNAs作用机制的研究也更为深入[9]。已发现circRNAs可通过碱基互补配对,直接调控其他RNA水平[10]。目前有关circRNAs调控机制研究较多的是ceRNA[11],即circRNAs通过“海绵”样吸附miRNA,使miRNA无法与靶基因结合,从而间接调控miRNA靶基因的表达。在基因芯片筛选出差异表达的circRNAs之后,如何选定一条circRNA进行后续的研究是一大难点。在本研究中,将PCR验证后有差异表达的6条circRNAs作为分析的对象,利用生物信息学分析circRNAs潜在靶miRNAs,结果提示miRNA-765与circRNA_0007478存在碱基互补配对,可能为其潜在的靶基因。此外,miRNA-765被报道在冠心病患者与健康人群间的外周循环血浆中的含量存在差异[12],而其余circRNAs预测的潜在靶miRNAs尚未见报道与动脉粥样硬化相关,因此挑选circRNA_0007478做进一步的探索。
miRNA发挥作用需通过调控它下游靶基因的表达,因此,针对miRNA-765的靶基因进行生物信息学分析,发现miRNA-765下游有多个靶基因被报道与动脉粥样硬化相关,其中大鸟苷三磷酸酶分子家族成员2(DNM2)[13]和腺苷三磷酸结合盒转运载体蛋白超家族成员C6(ABCC6)[14]等被报道与胆固醇代谢有关,轴突导向因子-1(NTN1)[15]和特异性蛋白-2转录因子(SP2)[16]等与炎症反应相关,血管抑素1(VASH1)[17]、钙网蛋白(CALR)[18]、圆柱瘤基因(CYLD)[19]等与内皮损伤相关,这提示miRNA-765可能参与调节动脉粥样硬化的进程。此外,基于ceRNA机制,将与circRNA_0007478共表达的mRNAs与miRNA-765潜在的靶mRNAs取交集发现,WRN这个基因与circRNA_0007478存在共表达,且是miRNA-765潜在的靶基因。文献回顾表明WRN基因的突变与Werner综合征相关,而Werner综合征临床表现有动脉硬化[20],但WRN与动脉粥样硬化的发病具体调控机制尚未见研究报道,这提示,以WRN为切入点,阐明circRNA_0007478参与调控动脉粥样硬化的具体机制成为可能。但上述结果仅仅基于软件推测,circRNA_0007478是否与miRNA-765存在真实结合情况需要分子实验进行证实,例如进行荧光霉素报告基因实验,或通过干扰miRNA-765观察circRNA_0007478对miRNA-765下游蛋白表达的影响。
综上所述,本研究通过构建ox-LDL诱导的巨噬细胞炎症反应的模型后进行芯片检测,筛选出差异表达的cricRNAs,并利用qRT-PCR证实了circRNA_0008896、circRNA_0007478、circRNA_0007085和circRNA_0092327在ox-LDL刺激后表达上调,circRNA_0048492和circRNA_0082139表达下调。此外,通过生物信息学分析预测circRNA_0007478可能通过结合miRNA-765影响下游蛋白的表达进而在动脉粥样硬化进程中发挥作用。
