梅花鹿锯茸前后急性期反应血清蛋白含量的变化
2021-04-13李婷郭肖兰邢秀梅王全凯张宇飞王洪亮
李婷,郭肖兰,邢秀梅,王全凯,徐 超,张宇飞,王洪亮※
(1.中国农业科学院特产研究所,农业部特种经济动物遗传育种与繁殖重点实验室,吉林省特种经济动物分子生物学省部共建国家重点实验室,长春 130112;2.吉林农业大学中药材学院,长春 130118)
急性期反应(acute phase reaction,APR)是动物机体先天免疫系统对局部或系统紊乱的一种免疫反应[1],主要由细胞生长因子以及促炎或抗炎细胞因子调节。在动物机体出现感染、炎症和组织损伤等应激原作用后,促炎细胞因子和趋化因子能够在短时间内激活肝脏中的受体细胞,合成不同的蛋白并分泌进入外周循环,这些蛋白被称为急性期蛋白(acute phase proteins,APPs)[2]。此外,动物机体内APR 受高温、惊扰和运输等应激反应、内分泌改变、蛋白质分解代谢增加和负氮平衡等的影响,还与脂质代谢、阳离子浓度、铁代谢、骨髓和淋巴因子介导的白细胞释放增加、补体活化及血浆急性期蛋白水平升高有关[3,4]。APR 是由各种损伤导致的由肝脏分泌的一类高度保守的血浆蛋白,其浓度随感染和炎症反应的变化而变化,当机体受到创伤、感染或有炎症时,伴随着急性期反应的发生,可触发防御导向细胞(如巨噬细胞、成纤维细胞及内皮细胞等)释放细胞因子(IL-1、IL-6 及TNF-等),从而促进肝脏合成急性期反应蛋白[5,6],如典型的前白蛋白(PA)、C-反应蛋白(CRP)、转铁蛋白(TRF)、血清淀粉样蛋白(SAA)和结合珠蛋白(HP)等。
肽聚糖是革兰氏阳性菌细胞壁的主要组成成分,是乙酰氨基葡萄糖、乙酰胞壁酸与4~5 个短肽聚合而成的多层网状大分子结构。肽聚糖作为病原相关分子模式能被细胞内模式识别受体NOD2 探测到,并激活巨噬细胞和树突状细胞NLRP3 炎症小体而引发炎症继而出现急性期反应,引起急性期蛋白变化[7]。
梅花鹿在锯茸时,鹿茸表皮分布的血管和神经被横断,茸皮下血管收缩,鹿茸内部的动脉和静脉血液外流[8],蜂窝状的骨或软骨组织暴露,外界病原微生物直接侵入,机体局部紊乱,激活血小板,释放凝血因子,损失的部分血浆蛋白由肝脏加速合成,同时伴随应激反应和急性期反应发生[9]。为了评估锯茸后梅花鹿机体的炎症及其变化,以及肽聚糖处理是否会引起炎症状况的变化,本实验通过酶联免疫吸附实验(Elisa)检测梅花鹿锯茸后急性期血清蛋白含量的变化及其与肽聚糖处理的关系。检测SAA、HP、CRP、PA 和TRF 等5种急性期蛋白在锯茸前后梅花鹿血液含量的变化。
1 材料与方法
1.1 试验动物及处理方法
选取中国农业科学院特产研究所梅花鹿保种场1岁毛桃期同龄健康公鹿9 只,随机分为3 组:空白组(不做处理)、对照组(碘伏+药棉+纱布处理)和实验组(碘伏+1 mg/mL 肽聚糖+药棉+纱布处理),麻醉和保定梅花鹿并于锯茸后的0 d、2 d、4 d、6 d、9 d、11 d、20 d和22 d 进行换药处理,同时颈静脉采集血液10 mL,血液中不加抗凝剂,以4 000 r/min 离心10 min 后吸取血清,将其低温带回实验室后-80 ℃保存用于检测血液中相关急性期蛋白含量。
1.2 试剂及仪器
肽聚糖、碘伏(上海谷研生物科技有限公司);牛SAA Elisa 试剂盒、牛结合珠蛋白(HP、Hpt)Elisa 试剂盒、牛PA Elisa 试剂盒、牛TRF Elisa 试剂盒、牛CRF Elisa试剂盒(上海酶联生物有限公司);多功能酶标仪(Synergy H1FMDG,美国BioTek);高速冷冻离心机(5810R,德国Eppendorf 公司);-80℃超低温冰箱(739274VD83G,海尔公司);电热恒温水浴锅(HWSY21-K,中国北京长风仪器仪表有限公司)。
1.3 测定项目及方法
上述5 种急性期蛋白的测定按照试剂盒中的使用说明进行。以试剂盒附带的标准品吸光度绘制标准曲线,并依据标准曲线计算得出待测样品中的不同急性期蛋白浓度,为避免试验操作中的误差,每个个体血清测定3 次。因为9~22 d 4 个时间点血清不足以测定全部5 个蛋白,故根据文献中牛常用的蛋白测定全部时间点的HP 和SAA 浓度,而CRP、PA 和TRF 3 个指标只测了前6 d 变化。
1.4 数据统计分析
应用Excel 及SPSS 软件补充版本号整理数据并对所得数据进行方差齐性检验与单因素方差分析(One-Way ANOVA),LSD 法进行多重比较,结果以平均值±标准差表示,P >0.05 表示差异不显著,并用Origin 软件绘图进行分析。
2 结果
2.1 SAA 含量变化分析
通过分析数据发现,SAA含量在不同个体之间差异较大,表现为自0 d,同一个体在不同时间点变化幅度远小于个体间差异,所以随机选取同龄非实验鹿30只,测得SAA含量为6.24±2.79g/mL(数据未列出),变化范围较大,说明并非实验选取个体导致的误差,而是正常个体体内SAA 蛋白含量本身存在较大的参考区间。实验中SAA 含量最高相差2.5 个数量级,不便于直接进行统计学分析和作图,见表1。所以将原始数据进行以10 为底的对数函数转换后发现,数据符合正态分布,可以进行显著性检验,见表2。
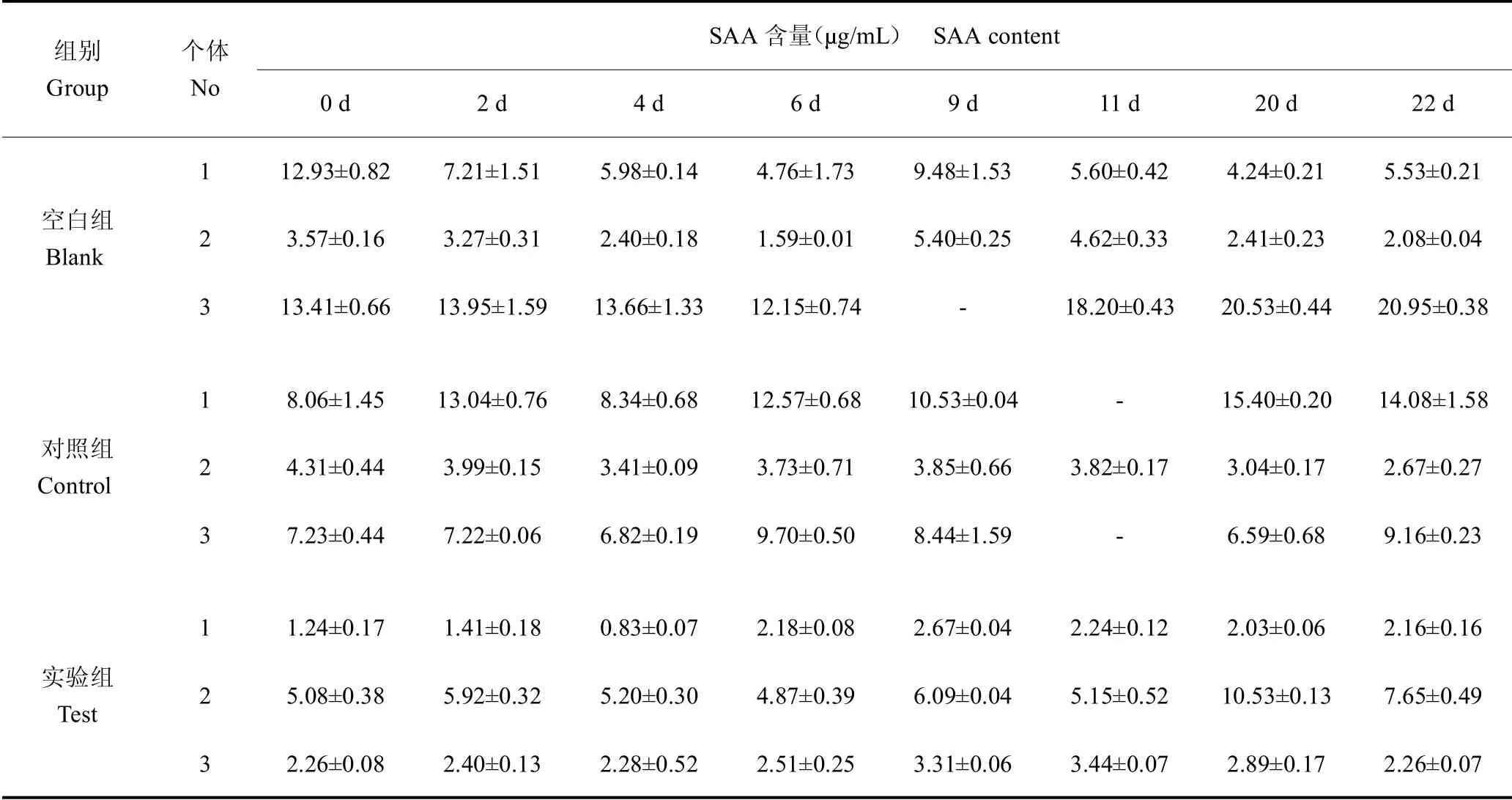
表1 梅花鹿锯茸后各组不同个体SAA 含量的变化Table 1 Changes of SAA content after sawing in Sika deer
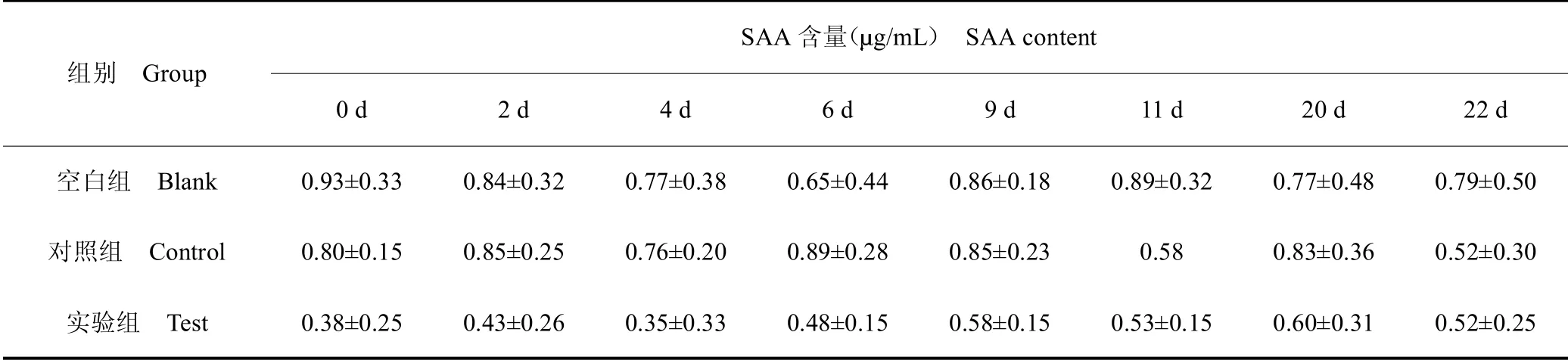
表2 数据变换后各组在不同时间点血清中SAA 含量Table 2 SAA content in serum of each group at different time points after data transformation
对组间数据分析结果表明,血清中SAA 含量在不同处理方法上无显著差异(P >0.05);对组内数据分析结果表明,血清中SAA 含量在不同天数间无显著差异(P >0.05),0 ~6 d 时,对照组与实验组存在相同的变化趋势,但与空白组变化趋势存在差异;6~9 d时,空白组与实验组存在相同的变化趋势,但与对照组变化趋势相反;9~22 d 时,对照组与实验组存在相同的变化趋势,但与空白组变化趋势相反,见图1。
2.2 HP 含量变化分析
与SAA 蛋白浓度特点类似,不同个体之间个体差异较大,测得HP 含量为175.27±138.98 ng/mL,实验结果见表3 和表4。
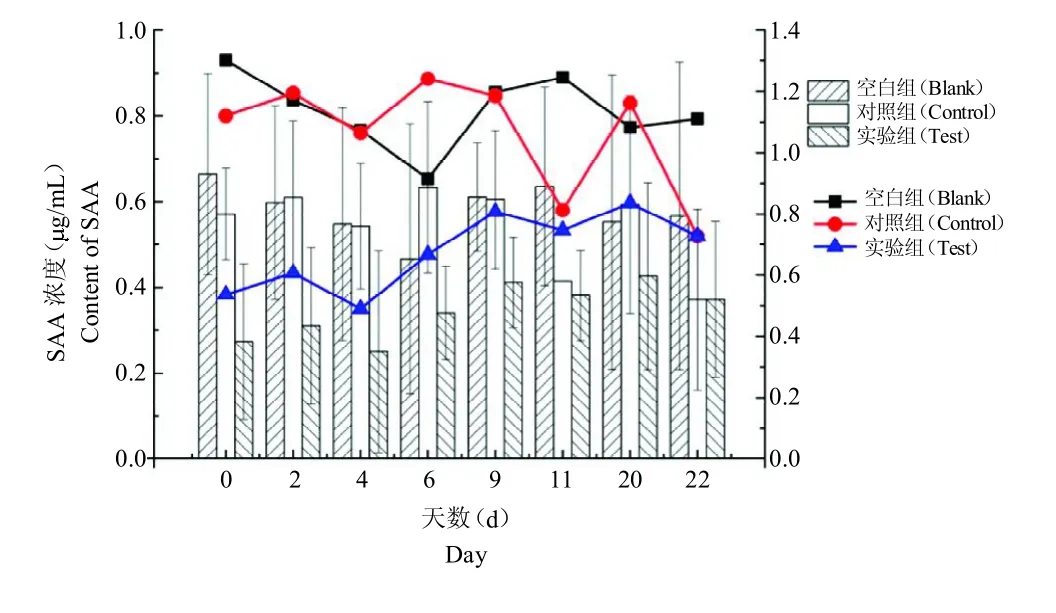
图1 血清中SAA 含量对比及变化趋势Fig.1 Contrast and change trend of serum SAA content in serum
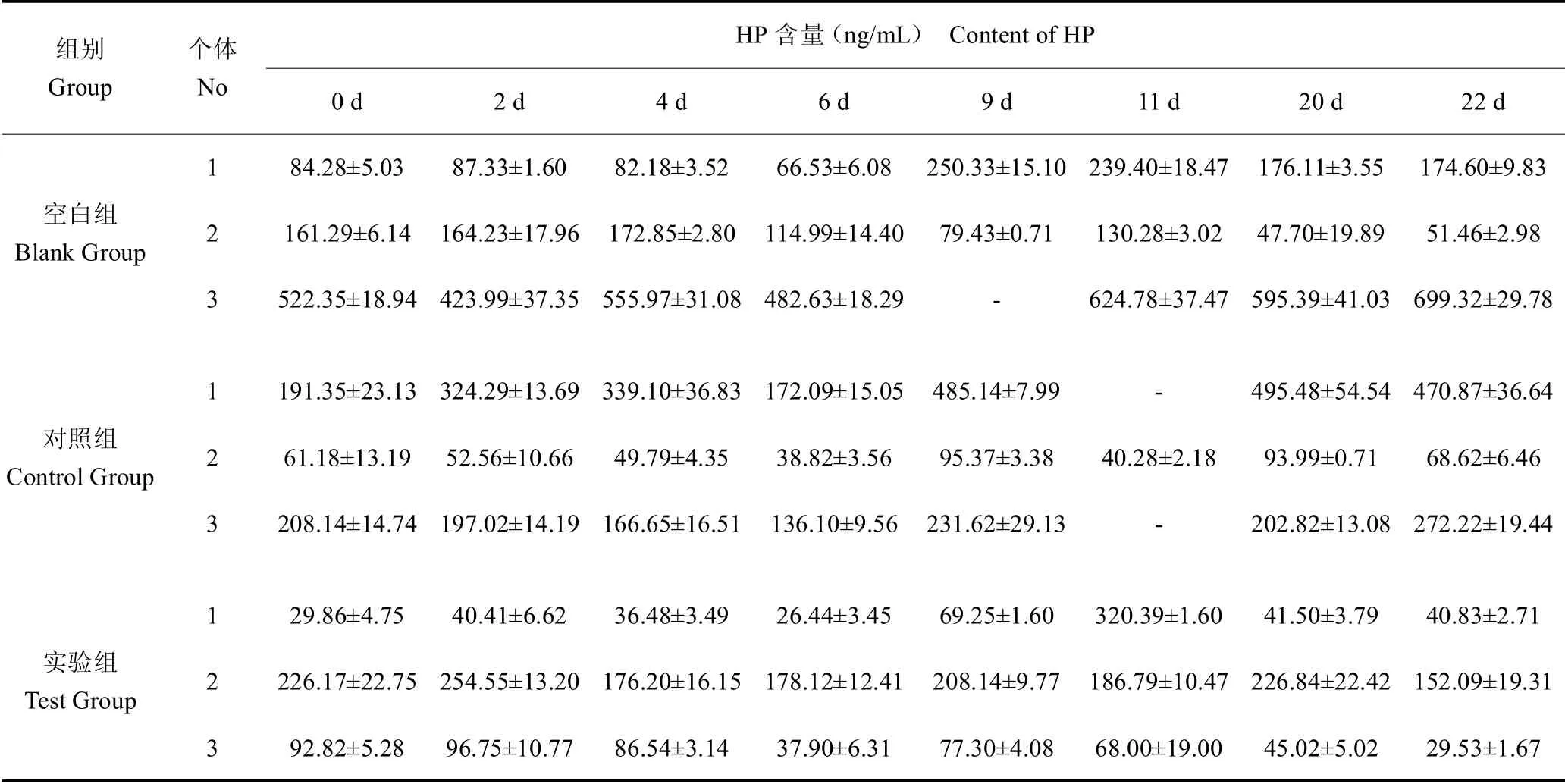
表3 血清中HP 含量Table 3 Content of HP in serum
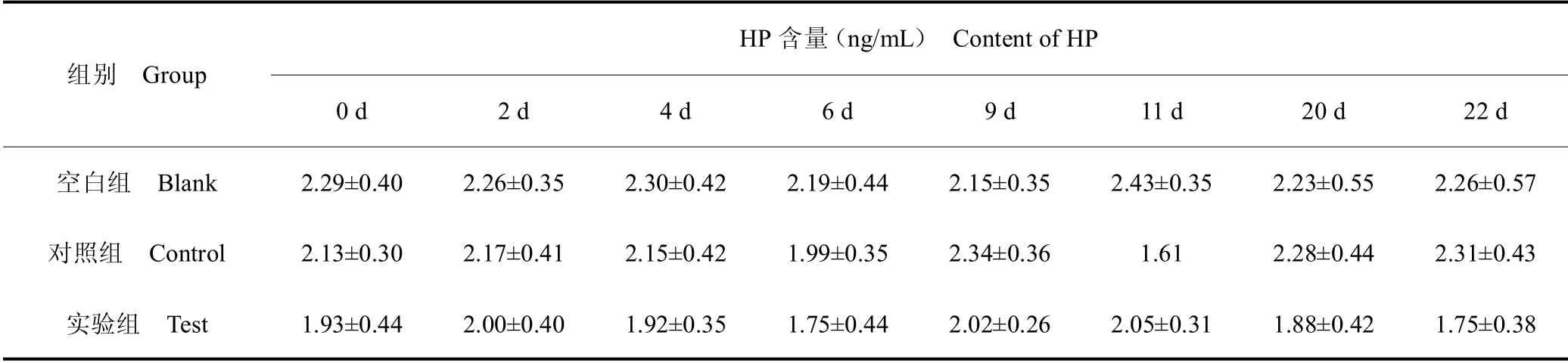
表4 数据变换后各组在不同时间点血清中HP 含量Table 4 HP content in serum of each group at different time points after data transformation
对组间数据分析结果表明,血清中HP 含量在不同处理方法上无显著差异(P >0.05);对组内数据分析结果表明,血清中HP 含量在不同天数间无显著差异(P >0.05),0~6 d 时,空白组与对照组和实验组存在相近的变化趋势;6~20 d 时,空白组与实验组存在相近的变化趋势,但与对照组变化趋势存在差异;20~22 d 时,空白组与对照组存在相同的变化趋势,但与试验组变化趋势相反,见图2。
2.3 CRP 含量变化分析
与SAA 蛋白浓度特点类似,不同个体之间个体差异较大,测得CRP 含量为4.10±2.81 mg/L,实验结果见表5 和表6。
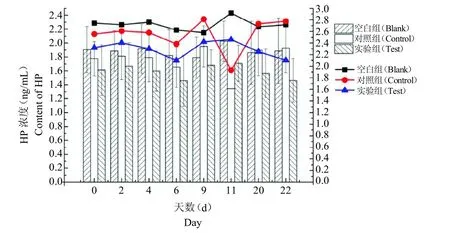
图2 血清中HP 含量对比及变化趋势Fig.2 Contrast and change trend of HP content in serum

表5 血清中CRP 含量Table 5 Content of CRP in serum
对组间数据分析结果表明,血清中CRP 含量在不同处理方法上无显著差异(P >0.05);对组内数据分析结果表明,血清中CRP 含量在不同天数间无显著差异(P >0.05),空白组与实验组具有相近的下降趋势,但与对照组变化趋势存在差异,见图3。

图3 血清中CRP 含量对比及变化趋势Fig.3 Contrast and change trend of CRP content in serum
2.4 PA 含量变化分析
与SAA 蛋白浓度特点类似,不同个体之间个体差异较大,测得PA 含量为6.58±5.05g/mL,实验结果见表7 和表8。

表7 血清中PA 含量Table 7 Content of PA in serum
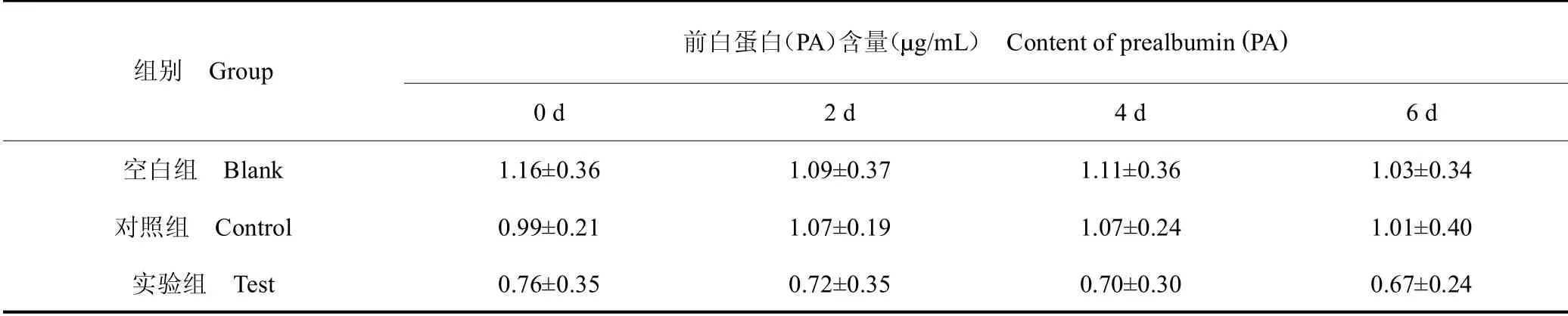
表8 数据变换后各组在不同时间点血清中PA 含量Table 8 PA content in serum of each group at different time points after data transformation
对组间数据分析结果表明,血清中PA 含量在不同处理方法上无显著差异(P >0.05);对组内数据分析结果表明,血清中PA 含量在不同天数间无显著差异(P>0.05),空白组与实验组具有相近的下降趋势,但与对照组变化趋势存在差异,见图4。
2.5 TRF 含量变化分析
与SAA 蛋白浓度特点类似,不同个体之间个体差异较大,测得TRF含量为53.14g/mL±51.10g/mL,实验结果见表9 和表10。
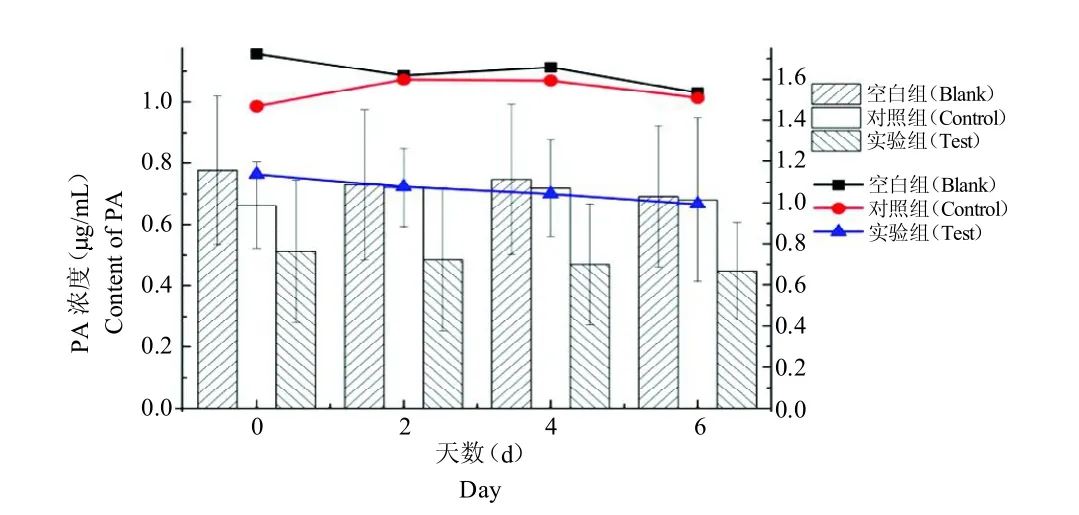
图4 血清中PA 含量对比及变化趋势Fig.4 Contrast and change trend of PA content in serum
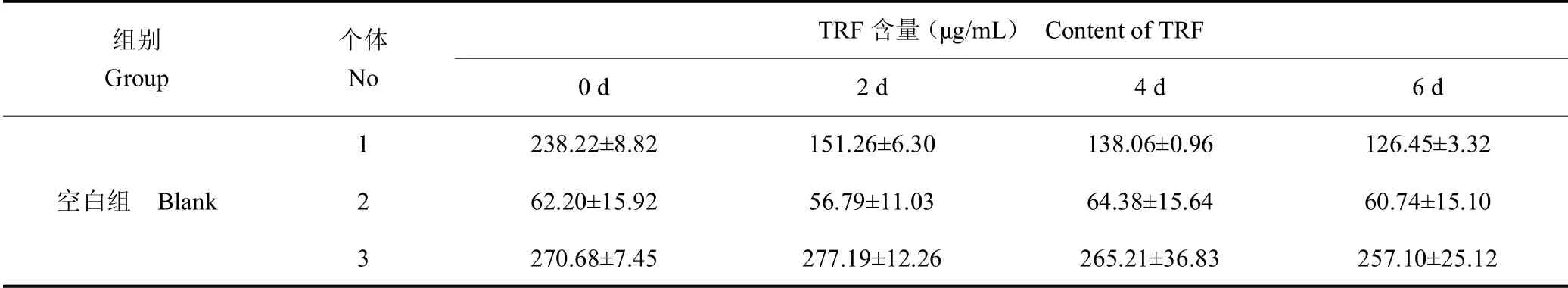
表9 血清中TRF 含量Table 9 Content of TRF in serum

续表9
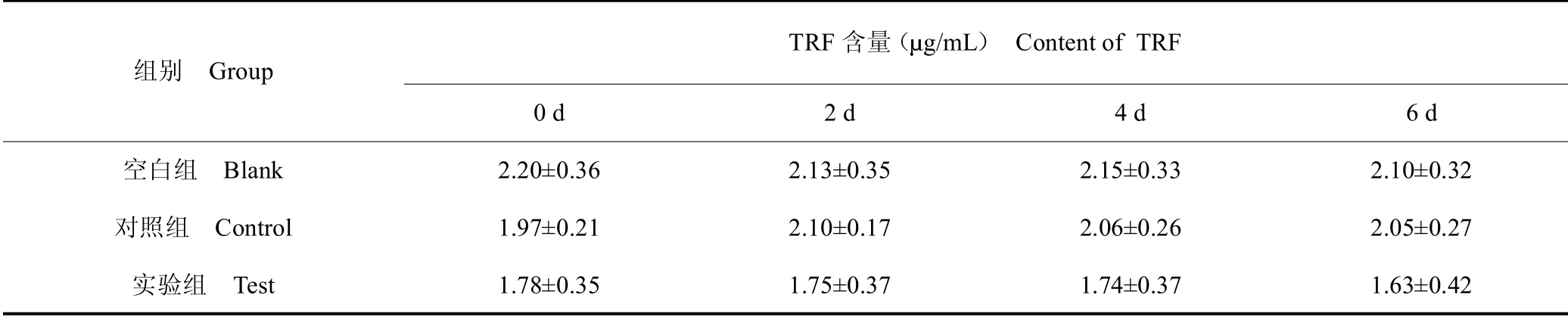
表10 数据变换后各组在不同时间点血清中TRF 含量Table 10 TRF content in serum of each group at different time points after data transformation
对组间数据分析结果表明,血清中TRF含量在不同处理方法上无显著差异(P >0.05);对组内数据分析结果表明,血清中TRF含量在不同天数间无显著差异(P >0.05),空白组与对照组和实验组具有相同的下降趋势,见图5。
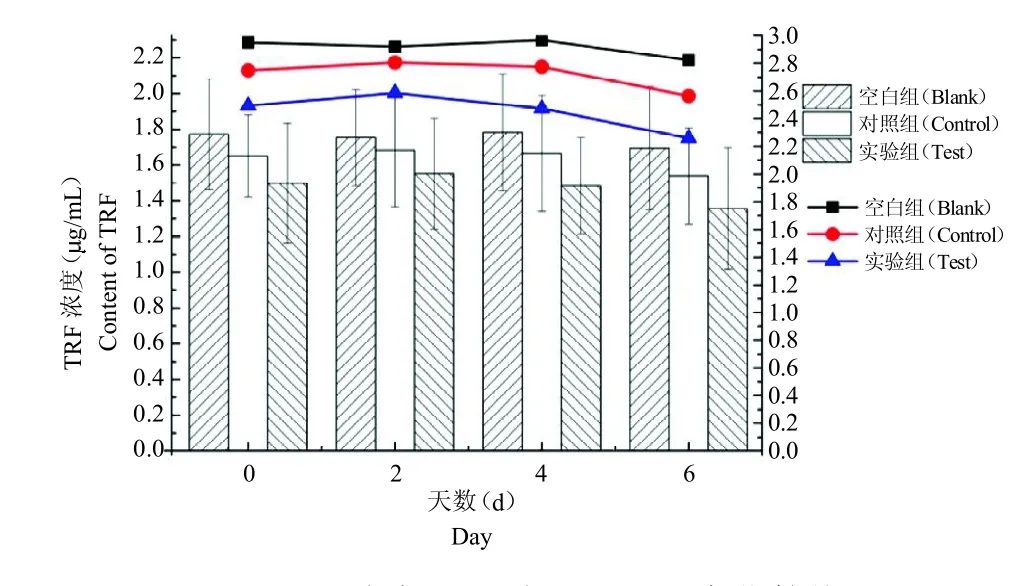
图5 血清中TRF 含量对比及变化趋势Fig.5 Contrast and change trend of TRF content in serum
3 讨论
机体受到炎症等刺激时,激发了先天的免疫系统及急性期反应,引起血清急性期蛋白含量的改变。急性期反应的大小和持续时间反映了感染的严重程度和潜在的组织损伤,因此,APPs 可以作为判断预后和治疗效果的良好指标。研究发现,不同物种的急性期反应蛋白有所不同,反刍动物的急性期反应蛋白中,SAA 和HP 是最主要的APPs[10],其变化也比较显著。APPs 具有防御、凝血、蛋白水解和组织修复等功能,除了具有免疫调节作用外,还具有抗菌活性[11]。Molenaar和Shah等[12,13]研究发现,牛SAA 对一系列革兰氏阴性菌和革兰氏阳性菌包括大肠杆菌具有抑制作用。此外,HP也可通过结合游离血红蛋白使大肠杆菌等细菌失去生长所需的铁来发挥抑菌作用。血清SAA 主要由肝脏合成,也可由巨噬细胞、平滑肌细胞、软骨细胞、上皮细胞和脂肪细胞等细胞在促炎刺激下产生的一种一线急性期反应蛋白,对引起组织损伤的促炎性因子具有免疫抑制或抑制作用。研究表明感染了传染性法氏囊病病毒(IBDV)和传染性支气管炎(IB)的鸡体内的SAA浓度显著升高[14,15],患有乳房炎和酮病的奶牛体内SAA浓度显著升高[16-18]。Upragarin等[19]研究发现,金黄色葡萄球菌可以引起细菌感染病例SAA 含量的升高。本实验中,实验组SAA 含量总体呈上升趋势,换药处理时发现在6 d 时创面流脓有炎症且茸皮肿胀,这可能是导致SAA含量升高的原因[20]。此外,SAA的浓度还受到多种应激因素的影响[21-23],也有可能是由于锯茸时导致的应激反应[8],造成SAA 含量的升高;而空白组和对照组总体呈下降趋势,推测是由于梅花鹿具有较强的免疫力[24]。
HP 又称触珠蛋白,是一种存在于所有哺乳动物血清中具有血红蛋白结合能力的强抗炎性急性期阳性蛋白[25],具有调节前列腺素合成、抑制淋巴细胞、中性粒细胞的趋化和吞噬作用[26],HP 还具有抗氧化性,可以预防组织损伤[27],在参与宿主抗感染、组织损伤的修复以及内环境稳定的过程中发挥重要作用。HP 是反刍动物中最重要的APP,在感染、创伤和炎症等病理状态时血清中含量会显著升高[28]。HP 在机体处于应激状态时血液中含量会明显增加[23],剧烈的体力活动后由于糖原衰竭、溶血和肌肉微损伤等产生炎症反应改变APP 原浓度[29],与牛对比急性期蛋白正常个体区间发现,牛的HP 含量较鹿的HP 含量低,推测是牛受驯化历史达数千年,急性期蛋白分布区间可能在驯化的过程中经过人工选择变窄,表现为牛的性情温顺,不怕人。而梅花鹿驯化时间只有数十年,驯化程度低,急性期蛋白未受人工选择,相反受到自然选择,因为应激反应在自然环境中是一种非常必要的生存能力,表现为对外界环境敏感、野性大、胆小易惊,引起应激反应的因素较多,如声音、人为活动、饲料及管理等,因此其相关蛋白浓度分布范围较大,没有显著性变化。
CRP 是动物机体受到创伤或微生物入侵等炎症性刺激时肝细胞合成的急性期反应蛋白,可作为细菌感染和病毒感染的鉴别指标。CRP 是人类、反刍动物、犬和马的一种急性期蛋白,具有明显的抗感染效应。在这些生物中,持续炎症过程的一个重要的早期标志是CRP 浓度的升高。本实验中,对照组CRP 浓度呈上升趋势,CRP浓度的增加可能与细菌、病毒、真菌和寄生虫在暴露于损伤刺激后36~48 h 内造成的细胞损伤有关[30],而空白组和实验组CRP 浓度呈下降趋势,推测是梅花鹿具有较强的免疫力和再生能力,且具有自愈功能[24],导致不会出现较大的炎症反应引起急性期蛋白变化。
血清PA 是一种由肝脏合成的存在于血清中半衰期较短且分解代谢率可预测的一种急性期反应蛋白,同时也是判断急性肾损伤患者营养状况的标志物和炎症指标。本实验中,空白组和实验组PA 浓度呈下降趋势,与Wang 等[31]研究结果相符,说明在锯茸期可能存在急性炎症,而空白组PA 呈上升趋势,可能是由于在锯茸时导致创面出血,血液浓缩[32],血中纤维蛋白原、凝血酶原及其他凝血因子含量增多的原因[33]。
TRF 是生物体中最重要的铁转运体,在血液中含量丰富,在细菌和病毒感染过程中,血清和肝脏中的TRF 的浓度会升高[34]。TRF 还具有免疫调节作用,阻止细菌的增殖,刺激嗜异细胞和巨噬细胞的活性,发挥抗炎和杀菌的作用,促进组织重建和血管生成[35]。本实验中,无论是空白组、对照组还是实验组在锯茸期内变化趋势不大,初步分析TRF 是愈后蛋白,具有促进组织重建和血管生成的作用,所选时间与TRF变化时间不符,故导致无较大趋势变化。
本实验中,各组梅花鹿锯茸期急性期蛋白无显著性变化,推测是由以下原因导致:(1)梅花鹿具有较强的免疫力和抗感染能力[24],导致不会出现较大的炎症反应引起急性期蛋白变化;(2)个体差异太大以达到掩盖处理效应的程度;(3)选取样本个体数较少,随机误差可能过大;(4)不同处理方法未达到引发炎症存在差异的程度;(5)产生应激反应,不同个体应激状况不同。鉴于所取样本量太少及不同个体差异及参考区间太大,对实验造成了一定程度的影响,可能未能全面地反应梅花鹿锯茸后炎症的实际状况,有必要在未来的实验中扩大样本量,并在实验之前选择急性期蛋白水平接近的个体,避免受个体差异的影响。
4 结论
本实验结果表明,梅花鹿锯茸期血清中5 种急性期蛋白均存在较大的浓度分布范围,个体差异明显,不同处理方法未能引起急性期蛋白显著变化,但部分蛋白在0~6 d 具有相似的变化趋势,锯茸后梅花鹿机体可能未引起明显的炎症反应,但需要进一步以更大的群体研究。
