抗人红细胞/抗猪瘟病毒双功能单链抗体的制备及功能鉴定
2021-04-12刘金凤覃绍敏石胜林俊杜毅超马玲秦树英白安斌陈凤莲张振江吴健敏
刘金凤,覃绍敏,石胜,林俊,杜毅超,马玲,秦树英,白安斌,陈凤莲,张振江,吴健敏*
(1.广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西 南宁 530001;2.上海海利生物技术股份有限公司,上海 201403)
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起的一种急性、热性及高度接触性传染病,是目前危害养猪业发展主要传染病之一[1]。早在上世纪60年代,我国就成功研制了猪瘟兔化弱毒苗,对猪瘟急性发生和大规模流行控制起了决定性作用。然而,近年来猪瘟流行趋势发生了变化,发病特征和临床症状越来越复杂,出现典型猪瘟和非典型猪瘟并存,持续性感染和隐性感染共现的现象,猪瘟防控依然面临着重要挑战[2-4]。目前,除研制有效的猪瘟疫苗和制备抗猪瘟病毒特异性抗体外,开发经济简便的猪瘟病毒快速检测方法,对有效进行猪瘟防控同样具有重要意义。
红细胞凝集试验是一种以红细胞作为指示物的免疫检测技术,其主要试剂为红细胞特异性抗体。红细胞膜H抗原是一种共有抗原,分布在人所有血型红细胞表面,以其为抗原制备的特异性抗体能与不同血型的红细胞结合,不发生凝集反应,而当这种抗体与另外的抗原或抗体结合形成双功能分子时,能通过待检样品中抗原或抗体的桥联作用,使红细胞发生肉眼可见的凝集反应[5-7]。单链抗体具有天然抗体的亲和力,分子量小,易于改造并可大量制备,是构建双功能抗体的理想元件[8-9]。本研究在抗人红细胞膜H抗原单链抗体基因(2E8-scFv)[6]及抗猪瘟病毒单链抗体基因(CSFV-scFv)基础上[10],通过基因重组技术,以柔性肽(G4S)3连接,构建抗人红细胞表面H抗原单链抗体与抗猪瘟病毒单链抗体融合的双功能单链抗体基因,经大肠杆菌密码子优化后进行原核表达,分析其双功能活性,制备抗猪瘟病毒双功能抗体,为进一步建立以红细胞凝集试验为技术支撑的CSFV病原快速检测方法奠定基础。
1 材料与方法
1.1 主要材料
TOP10感受态细胞、pCzn1质粒、BL21(Plyss)感受态细胞、CSFV、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)流行株均由本实验室保存;CSFV、伪狂犬病毒(PRV)、PCV2、PRRSV、PPV病原阳性血清均为临床病原检测为单一病毒感染的猪血清;限制性内切酶、DNA Marker、T4连接酶为TaKaRa公司产品;质粒小提试剂盒、DNA胶回收试剂盒、蛋白Marker、BCA蛋白定量试剂盒为TIANGEN公司产品;IPTG为Promega公司产品;抗His单克隆抗体为 Invitrogen 公司产品;HRP-羊抗鼠IgG、FITC-羊抗鼠IgG为Solarbio公司产品;Ni-IDA亲和层析柱为Novagen公司产品;其他化学试剂均为进口或国产分析纯。
1.2 双功能单链抗体基因密码子优化及合成
将CSFV-scFv与2E8-ScFv通过弹性连接肽Linker(Gly4Ser)3连接,构建双功能单链抗体基因2E8-CSFV,根据http://www.kazusa.or.jp/codon、GenScript Rare Codon Analysis Tool和CodonW1.4.2对2E8-CSFV基因序列密码子组成、使用频率及鸟嘌呤和胞嘧啶比率(GC含量)等进行分析,并根据大肠杆菌密码子的偏好性[11],利用密码子优化软件,将2E8-CSFV基因的部分密码子替换成高度表达的大肠杆菌密码子。优化后的双功能单链抗体基因DNA序列发生变化,但表达的蛋白质氨基酸序列不变,并在基因的上游加入NdeⅠ,下游加入XbaⅠ酶切位点。优化后的双功能单链基因由南京钟鼎生物科技有限公司合成,连接于pUC载体,即 pUC-2E8CSFV。
1.3 双功能单链抗体基因表达载体的构建
将重组质粒pUC-2E8CSFV和pCzn1载体分别用NdeⅠ、XbaⅠ双酶切后凝胶电泳回收酶切产物,并进行T4 DNA连接,转化TOP10感受态细胞,挑取单克隆,提取质粒并用NdeⅠ和XbaⅠ进行双酶切鉴定后测序分析,构建重组质粒pCzn1-2E8CSFV。
1.4 重组质粒的原核表达
将测序正确的重组质粒pCzn1-2E8CSFV转化BL21(Plyss)感受态细胞,挑取单菌落接种于3 mL 含Amp 的LB培养基中,37 ℃ 220 r/min 培养过夜,第2天按1∶100将菌液接种于30 mL 含Amp 的LB培养基中,培养至菌体OD600约0.6~0.8时,加入IPTG至终浓度为0.5 mmol/L,诱导培养4 h后取样。同时以未经诱导的菌液为对照,细菌经超声波破碎后进行离心,收集上清和沉淀经SDS-PAGE鉴定。
1.5 表达产物的纯化
按1.4中的步骤方法对重组质粒进行诱导表达,表达培养体积为1 000 mL。离心弃上清收集菌体,将菌体重悬于20 mL 裂解液中,超声波破碎后,4 ℃、10 000 r/mim 离心 20 min,收集包涵体沉淀,用包涵体洗涤液洗涤3次后,用溶解缓冲液按一定比例4 ℃放置过夜溶解包涵体,再次4 ℃、10 000 r/mim 离心 20 min,取上清经0.45 μm滤器过滤后,用Ni-IDA亲和层析柱进行蛋白纯化。收集洗脱液SDS-PAGE 检测,并将其装入透析袋中,用含有不同浓度(6、4、2、0 mol/L)尿素的复性液梯度稀释复性,最后 PBS脱盐,获得纯化蛋白-20 ℃保存备用。
1.6 单链抗体的活性鉴定
1.6.1 间接免疫荧光(IFA)检测双功能单链抗体病毒结合活性
用猪瘟病毒接种生长良好的PK-15细胞,37 ℃共培养24~72 h,细胞融合达80%时,以80%预冷丙酮固定细胞15~30 min,PBS洗涤2次后,5%脱脂奶粉4 ℃封闭过夜,加入纯化的重组蛋白37 ℃孵育1 h,PBS洗涤2次,加入抗His单克隆抗体37 ℃孵育1 h,加入FITC标记的羊抗鼠IgG,37 ℃ 避光孵育1 h,于荧光显微镜下观察结果。同时以正常培养PK-15细胞,PPV和PCV2感染的PK-15细胞以及PRRSV感染的Marc-145细胞对照。
1.6.2 间接ELISA检测双功能单链抗体活性
收集CSFV细胞培养液,经反复冻融后,4 ℃ 12 000 r/min 离心15 min,收集上清液制备病毒液。将病毒液4 ℃包被酶标板过夜(5 μg /mL),PBST洗涤3次,加入3%脱脂奶粉封闭2 h,PBST洗涤3次。将表达的重组蛋白进行倍比稀释,取100 μL分别加入各酶标孔,37 ℃结合反应1 h,PBST洗涤3次,加入100 μL/孔鼠抗His抗体(1∶1 000),37 ℃孵育1 h,弃液体,PBST洗涤3次,加入100 μL/孔HRP标记的羊抗鼠二抗(1∶1 000),37 ℃孵育1 h,弃液体,PBST洗涤3次,加入100 μL/孔TMB显色液,37 ℃显色30 min后,加入2 mol/L H2SO4终止显色,50 μL/孔,在450 nm 处读取OD值。
1.6.3 红细胞凝集试验检测双功能单链抗体活性
取CSFV病原阳性、阴性血清,按50 μL/孔依次加入血凝板中,然后再每孔加入50 μL表达的重组蛋白(500 μg/mL)和50 μL 1%的O型(A、B、AB型)人红血球细胞,混均匀,室温静置30~60 min,观察结果,红细胞呈网状平铺于孔底为100%凝集(++++),红细胞呈网状平铺于孔底,但边缘下滑为75%凝集(+++),红细胞于孔底呈环状或小团为50%凝集(++),红细胞少量凝集成小团为25%凝集(+),红细胞沉于孔底呈点状为不凝集(-)。同时设置其他常见猪病毒PRV、PCV2、PRRSV、PPV经病原为阳性的血清作为对照。
2 结果
2.1 双功能单链抗体基因设计优化及合成
CSFV-scFv和2E8-ScFv通过连接肽Linker(Gly4Ser)3连接,构建融合基因2E8-CSFV,综合分析大肠杆菌密码子偏好性、转录调节元件、mRNA二级结构、GC含量等参数,在不改变融合基因氨基酸序列的前提下,将基因所有密码子替换成大肠杆菌使用频率最高或次高的密码子,优化后基因全长1 533 bp,GC含量为53.44%,处于相对平衡状态,优化后合成基因连接于PUC,构建重组质粒pUC-2E8-CSFV。
2.2 双功能单链抗体基因重组表达载体构建
将重组质粒pUC-2E8-CSFV酶切,回收目的片段后,定向克隆到pCzn1载体中,构建重组表达载体pCzn1-2E8-CSFV,重组质粒经酶切鉴定,可见预期长约4.4 kb目的条带和1.5 kb的目的条带(图1),将酶切鉴定正确的重组质粒进行测序鉴定,结果显示与预期一致。
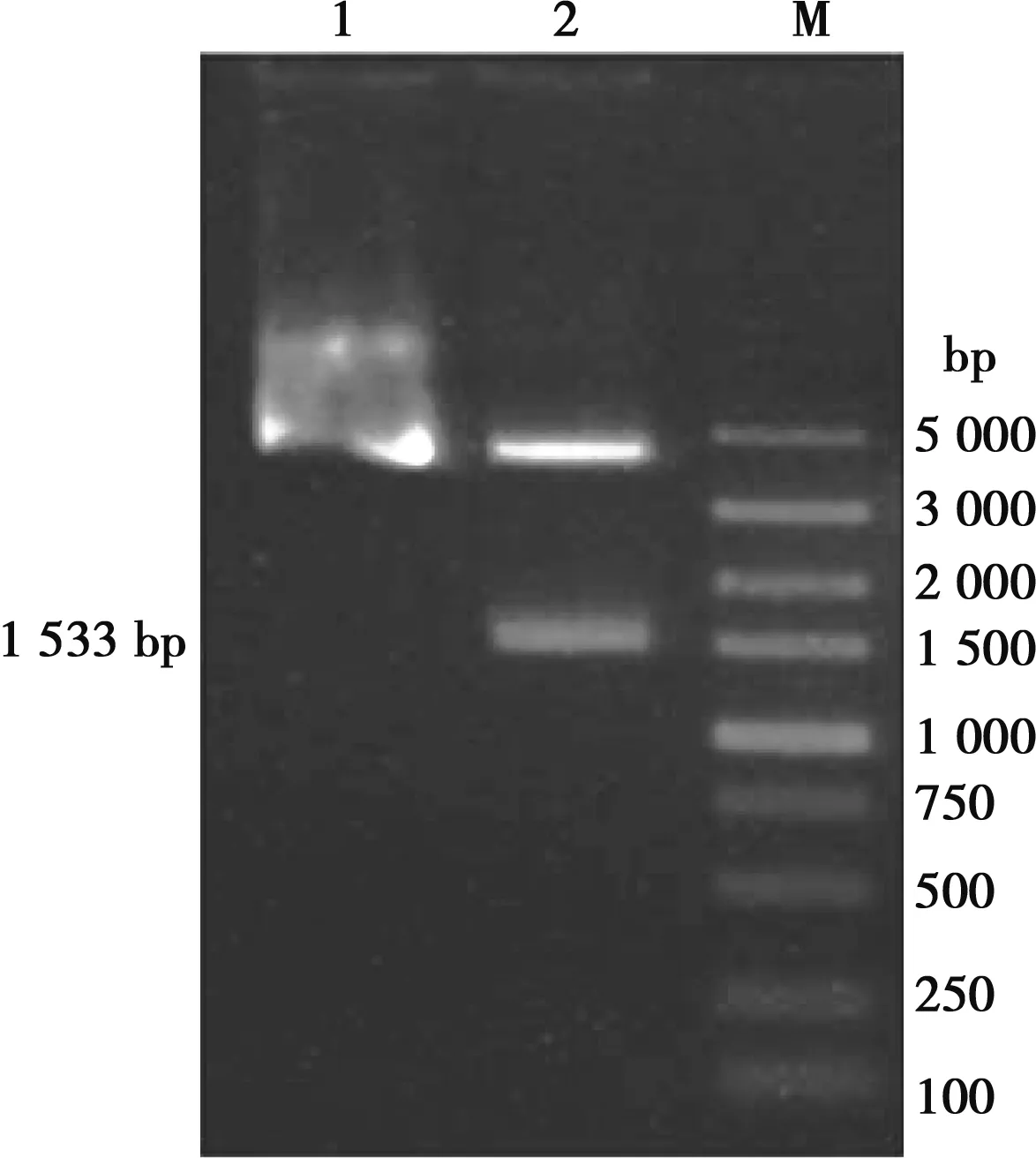
M.DL 5000 DNA Marker;1.pCzn1-2E8-CSFV质粒;2.pCzn1-2E8-CSFV双酶切产物图1 pCzn1-2E8-CSFV质粒酶切鉴定
2.3 双功能单链抗体的原核表达
重组表达载体pCzn1-2E8-CSFV转化大肠杆菌BL21(Plyss),进行IPTG诱导表达,表达产物经SDS-PAGE分析,结果见图2。在约55 kDa处出现明显的诱导条带,与预期结果相符合。进一步收集诱导菌液的上清及沉淀SDS-PAGE分析可知,目的蛋白主要以包涵体形式表达,主要存在于沉淀中(图2)。

M.预染蛋白分子质量标准;1.未诱导的pCzn1-2E8-CSFV;2.IPTG诱导的pCzn1-2E8-CSFV;3.诱导破碎后上清;4.诱导破碎后沉淀图2 pCzn1-2E8-CSFV表达产物SDS-PAGE分析
2.4 双功能单链抗体的纯化及鉴定
表达菌大量诱导表达,收集菌体制备包涵体,用Ni-IDA -Sepharose CL-6B 亲和层析柱纯化目的蛋白,并进行6 mol/L尿素变性和梯度复性,纯化复性后目的蛋白经SDS-PAGE分析,结果见图3。目的蛋白在大肠杆菌中高效表达,经亲和层析柱纯化后得到纯度90%以上的纯化蛋白,BCA测定蛋白浓度最高可达0.25 mg/mL。

M.蛋白分子质量标准;1.破碎后沉淀;2.流出液图3 表达产物纯化后SDS-PAGE分析
2.5 间接免疫荧光检测双功能单链抗体病毒结合活性
采用IFA方法检测双功能单链抗体病毒结合活性,结果见图3。在荧光显微镜下可见CSFV病毒感染的细胞产生特异性绿色荧光(图4),而PRRSV、PCV2、PPV病毒感染组及阴性对照组细胞则无特异性荧光反应(图略),表明原核表达的重组双功能单链抗体与猪瘟病毒具有良好的结合特性。

A.未感染CSFV的PK-15细胞;B.感染CSFV的PK-15细胞图4 双功能抗体间接免疫荧光检测
2.6 间接ELISA检测双功能单链抗体活性
采用间接ELISA方法检测双功能单链抗体活性。以猪瘟病毒为抗原包被ELISA板,与不同浓度的重组蛋白2E8-CSFV进行反应,结果见图5。2E8-CSFV浓度从0.5 mg/mL倍比稀释后,随着浓度降低,OD450值下降,表明原核表达的重组双功能单链抗体2E8-CSFV具有较好的生物活性,与猪瘟病毒有一定的结合能力。
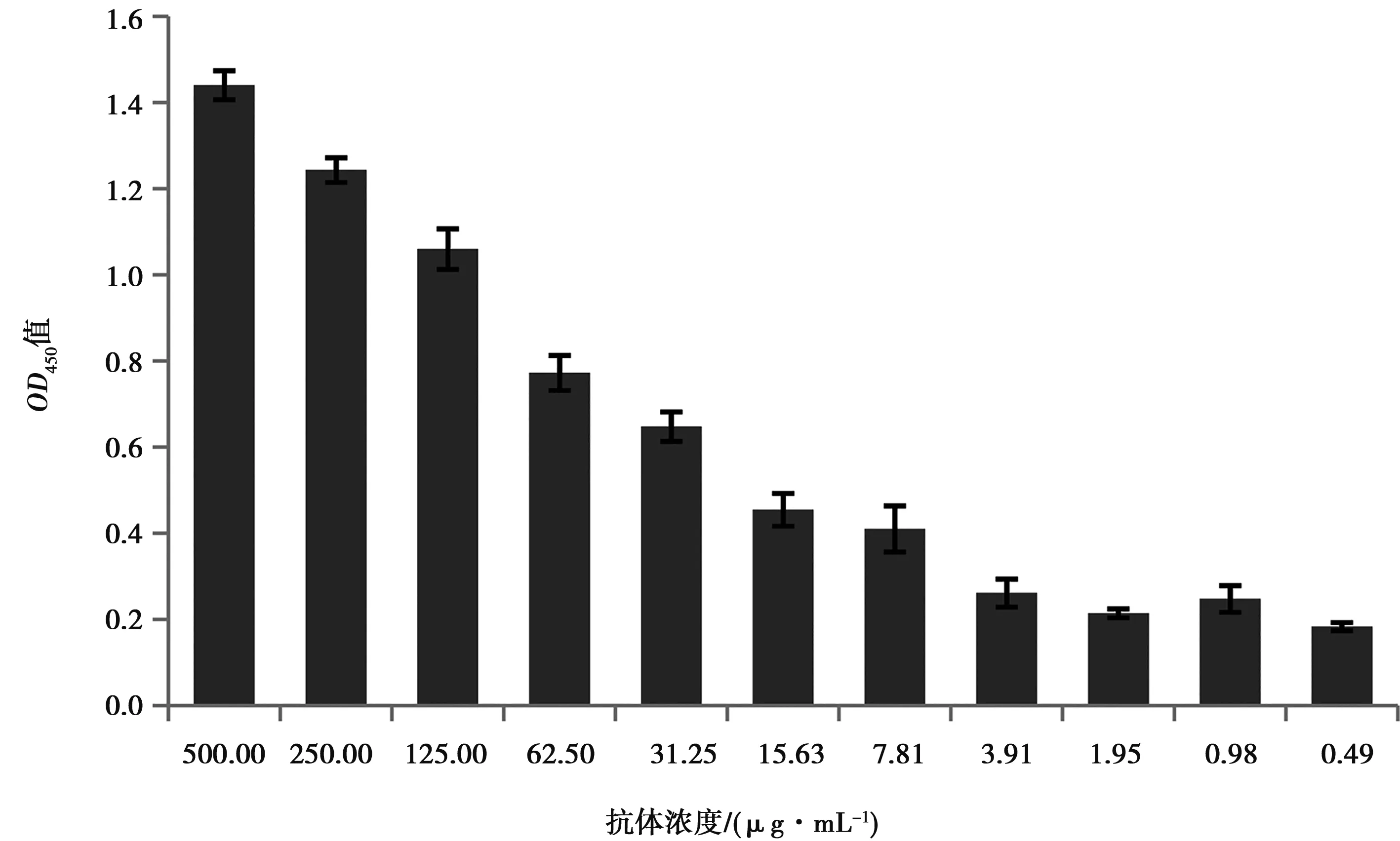
图5 双功能抗体与CSFV的结合活性分析
2.7 红细胞凝集试验检测双功能单链抗体活性
以不同血型的人红细胞为指示剂,用纯化复性后的重组双功能单链抗体与不同猪病毒病原阳性血清进行红细胞凝集试验,结果见图6。在不同血型(O、A、B、AB)红细胞中,重组双功能单链抗体2E8-CSFV 均能与CSFV病原为阳性的血清发生凝集反应,但与PRV、PCV2、PRRSV、PPV病原为阳性血清均未发生凝集反应(图7)。表明原核表达的双功能单链抗体2E8-CSFV既能与人红细胞特异性结合,同时又能与猪瘟病毒反应,具有双功能特性。

1.O型人红细胞;2.A型人红细胞;3.B型人红细胞;4.AB型人红细胞;A.双功能单链抗体组;B.阴性对照组图6 双功能单链抗体红细胞凝集特性检测

1.PRV;2:PCV2;3.PPV;4.PRRSV;5.CSFV图7 红细胞凝集试验方法特异性分析
3 讨论
目前以scFv为基础构建的双功能抗体已在许多领域得到了广泛应用并且具有多克隆抗体和单链抗体无法比拟的优点[12],然而在动物医学领域,对动物源性抗原单链抗体的研究相对匮乏,而猪瘟病毒单链抗体应用于猪瘟病原检测国内更是鲜有报道。我国是养猪大国,每年因猪瘟造成的损失难以估计,猪瘟仍是限制我国养猪业发展的一大难题,防治任务艰巨,如何准确快速的进行猪瘟病原学诊断具有重要意义。尽管近年来PCR、DNA探针、ELISA等技术广泛用于猪瘟病原的诊断研究,加快了病原微生物检验速度,有着不可替代的优势[13],然而,就我国养殖国情,基层兽医站和养殖场并不具备开展这些技术的人员设备条件,难以开展大规模应用。因此,有必要探索一种简便、快速、特异并适合基层生产使用的诊断技术。将单链抗体技术与以抗原抗体反应为本质的红细胞凝集试验技术相结合研制猪瘟病原快速诊断方法有望取得较好的应用前景。
获得特异性强、活性高的双功能抗体是建立红细胞凝集试验检测方法的前提。基因重组技术弥补了传统化学交联法和双杂交瘤法操作复杂、稳定性差、产量低等缺点,可广泛用于双功能抗体的制备。1994年,Lilley等[14]首次应用基因重组技术制备出抗人红细胞单链抗体和HIV-1抗原融合的双功能抗体;邵长利等[6]以抗人红细胞H抗原单克隆抗体为材料,制备其单链抗体2E8-scFv,并构建2E8-scFv融合HIV-1 gp41抗原肽的双功能抗体,用于HIV抗体检测,为建立基于红细胞H抗原的免疫检测技术奠定了基础。我们实验室在前期研究中以2E8-scFv为基础,成功制备了用于猪瘟抗体[15]、伪狂犬抗体[16]及狂犬抗体[17]快速检测的双功能分子,进一步证实了2E8-scFv融合外源基因能在原核系统中表达,并具有双功能活性。
本试验应用基因重组技术,通过柔性肽将2E8-scFv和CSFV-scFv连接构建双功能单链抗体基因。不同物种细胞在蛋白翻译过程中,与外源基因所编码的氨基酸密码子使用频率之间存在差异,研究表明密码子优化能显著提高蛋白的表达水平。为提高双特异性抗体的表达效率,在不改变基因氨基酸序列前提下,综合分析宿主细胞密码子偏好性、mRNA二级机构、GC含量等参数对基因密码子进行优化并合成,克隆至pCzn1原核载体进行大肠杆菌诱导表达。SDS-PAGE和Western blot鉴定目的蛋白主要以包涵体形式表达,其原因可能是大肠杆菌表达率过高,合成的蛋白没有足够的空间折叠,二硫键产生错配或过多的蛋白非特异性结合,溶解度下降形成不溶性包涵体[18]。包涵体含量高、纯度高,可作为活性蛋白贮存库存在。通常采用氧化还原法或尿素梯度透析法从包涵体中获得活性蛋白[19],双功能抗体半胱氨酸含量低,氧化还原半胱氨酸形成正确二硫键的方法,不适用于双功能抗体的变性复性。因此本研究选用0 mol/L~6 mol/L尿素,对表达的包涵体进行变性和梯度透析,缓慢恢复线性多肽的正确结构。间接免疫荧光显示复性后,双功能抗体能与猪瘟病毒结合,保留了亲本抗体的抗原结合活性,但试验所用抗体浓度较高,可能与抗体纯化复性方法有关,蛋白复性不完全,复性产物中活性蛋白含量低,导致抗体亲和力低;此外,以CSFV为包被抗原,间接ELISA检测双功能抗体的CSFV结合活性,结果线性关系不理想,这可能与纯化后的蛋白纯度有关;进一步红细胞凝集试验表明,重组双功能抗体能与CSFV抗原为阳性的血清发生凝集反应,证实双功能抗体的双特异性,但红细胞凝集效果不太理想,抗体使用量较大,反应时间较长,与预期存在一定差距,双功能抗体的活性、纯度及凝集试验的反应条件还需进一步优化提高。
综上所述,本研究通过基因重组技术,成功构建密码子优化型抗人红细胞表面抗原与抗猪瘟病毒单链抗体融合的双功能抗体基因,及其高效原核表达系统,成功制备出既能与人红细胞结合,又能与CSFV病原反应的双功能抗体,为后续建立CSFV病原红细胞凝集试验快速检测方法奠定基础。
