microRNA-124-3p对Th17细胞体外分化的影响分析
2021-04-12张海龙颜广智谢博陈盛楠邓汝森顾万军黄良宗
张海龙,颜广智,谢博,陈盛楠,邓汝森,顾万军,黄良宗
(佛山科学技术学院生命科学与工程学院,广东 佛山 528000)
在过去的20年中,microRNA(miRNA)已被发现在不同类型的细胞中存在,包括癌细胞和免疫细胞。miRNA在细胞增殖与活化、先天免疫细胞和调节性免疫细胞中的分化、疾病的发生发展等多种生化过程中均扮演重要角色。Th17细胞是在2005年发现的不同于Th1和Th2细胞的第三亚群的辅助性T细胞,该亚群的辅助性T细胞主要分泌白细胞介素-17(IL-17,也称为IL-17A)、IL-17F和IL-22等细胞因子,并由于IL-22和IL-17受体的广泛分布,从而诱导了大量的组织反应[1-2]。分化因子(TGF-与IL-6或IL-21)、生长和稳定因子(IL-23)和转录因子(RORt、STAT3和ROR等)在幼稚CD4+T细胞向Th17细胞分化中发挥重要作用[3-5]。大量研究表明:流感病毒感染宿主可引起miRNA表达谱的明显变化,病毒可能通过调控某些miRNA表达量的变化从而实现免疫逃逸,增强其对宿主的感染能力;同时宿主自身也可通过调控某些miRNA的表达变化,从而启动抗病毒反应机制[6]。Th17细胞在抗感染、寄生虫免疫以及自身免疫性疾病中发挥重要作用[7],其分泌的细胞因子具有促进炎性细胞(中性粒细胞、嗜酸性粒细胞等)聚集至炎症部位,具有较强的促炎症反应的作用。Th17细胞参与猪流感病毒感染宿主介导的炎症损伤,IL-17基因缺失小鼠可抵抗致死性H1N1亚型猪流感病毒攻击,提高小鼠存活率[8]。miRNA通过与靶基因的3′UTR结合导致靶基因的降解或抑制其翻译过程发挥其调控功能。H1N1猪流病毒感染小鼠miRNA差异表达分析表明,试验组miR-124-3p相比对照组显著上调约3.8倍,其调控靶基因之一是STAT3,也是Th17细胞分化过程中关键转录因子[9]。因此,猪流感病毒感染小鼠显著上调的miR-124-3p可能通过调节Th17细胞的分化,从而减轻流感病毒感染所致的炎症反应。探讨miR-124-3p对Th17细胞体外分化的影响对,于丰富miRNA调控作用,探索一种可行的免疫调节方式,降低Th17细胞介导的炎性反应都具有重要作用。
1 材料与方法
1.1 腺病毒表达载体、细胞、小鼠
miR-124-3p过表达/抑制腺病毒、空白载体由本实验室构建,于-80 ℃冻存;293A细胞系由中国科学院广州生物医药与健康研究院提供;6~8周龄SPF级C57BL/6雌性小鼠购自广东省医学实验动物中心。
1.2 主要试剂
胎牛血清(FBS)购自New Zealand公司;青霉素/链霉素双抗混合液购自GIBCO公司;小鼠CD4+CD62L+T细胞磁珠分选试剂盒、Gentle MACS 25C Tubes、autoMACS Running Buffer、TexMACS GMP Medium(Phenol Red)均购自德国Miltenyi Biotec MACS;小鼠淋巴细胞分离液购自深圳达科为生物技术有限公司;重组人细胞因子TGF-β1、重组小鼠细胞因子(IL-6、IL-1β、IL-23)、抗小鼠IL-4 抗体、抗小鼠IL-2抗体、IL-17A小鼠ELISA检测试剂盒均购自美国R&D公司;抗小鼠 IFN-γ抗体、固定/破膜试剂盒、小鼠抗CD3 /CD28单克隆抗体、藻红蛋白荧光标记抗小鼠IL-17单克隆抗体、异硫氰酸荧光素标记抗小鼠CD4单克隆抗体、藻红蛋白荧光标记抗小鼠CD62L单克隆抗体均购自美国BD公司;蛋白转运抑制剂Protein Transport Inhibitor cocktail、细胞刺激试剂Cell Stimulation cocktail、HEPES(1 mol/mL)均购自美国Invitrogen公司、Evo M-MLV 反转录试剂盒购自湖南艾科瑞生物工程有限公司;RNAiso Plus(Total RNA提取试剂)、TB GreenTMPremix ExTaqTM均购自日本Takara公司;PBS(不含钙镁离子)购自北京索莱宝科技有限公司;24孔、48孔、96孔细胞培养板、70 μmol/L细胞筛网均购自江苏NEST。
1.3 腺病毒载体的构建与滴定
根据mmu-miR-124-3p(miR-124-3p)基因(mouse),查找pre-miR序列:ATCAAGATCAGAGA-CTCTGCTCTCCGTGTTCACAGCGGACCTTGATTTAAT-GTCATACAATTAAGGCACGCGGTGAATGCCAAGAGC-GGAGCCTACGGCTGCACTTGAA;根据mmu-miR-124-3p(miR-124-3p)基因(mouse),查找miRNA成熟体序列,根据成熟体序列设计sponge序列,得到序列如下:GGCATTCGAGACGTGCCTTACGCGGGCA-TTCGAGACGTGCCTTACGCGGGCATTCGAGACGTGCC-TTACGCGGGCATTCGAGACGTGCCTTACGCGGGCATT-CGAGACGTGCCTTACGCGGGCATTCGAGACGTGCCTT-ACGCGGGCATTCGAGACGTGCCTTACGCG;将上述基因合成后,构建至穿梭载体PDC315-U6-MCS-CMV-EGFP,然后分别将插入目的序列的穿梭质粒与辅助质粒pBHGlox(delta) E13cre使用Lipofectamine2000共同转染至293A细胞,5% CO2,37 ℃恒温培养24 h,荧光显微镜对培养的细胞进行观察。7 d后收集细胞与上清,置于-20 ℃,反复冻融2 次,1 500 r/min、4 ℃离心1 min,收取上清液,上清液即为构建好的载体腺病毒。将收集的载体腺病毒重新感染293A细胞,5% CO2、37 ℃恒温培养72 h,按上述方法冻融离心后收集上清液,即为扩增的载体腺病毒;过表达腺病毒命名为miR-124-3p-over,抑制性腺病毒命名为miR-124-3p-sponge,空载体腺病毒命名为miR-124-3p-blank。将293A细胞轻轻吹打混匀,并加入至5 mL离心管中(离心管预先加入了10% FBS的高糖DMEM培养基3 mL),1 000g离心5 min,弃去上清,加入含10% FBS的DMEM培养基重悬,并将其转移至6孔细胞培养板中,培养24 h后进行传代;传代接种2.5×105个/mL 293A细胞于3块24孔板,培养24 h后,细胞汇合度达到100%,使用含10%FBS的高糖DMEM培养基稀释腺病毒原液,各自配制5个稀释梯度,分别是10-2、10-3、10-4、10-5、10-6。每个梯度重复3个孔,每孔分别加入50 μL的病毒液,同时保留剩下9个孔正常生长的细胞作为阴性对照,继续培养。腺病毒感染293A细胞48 h后,使用荧光显微镜(10×10倍)观察每个梯度感染的荧光细胞数,并选用荧光细胞数接近50的梯度,每孔采用2个不同视野进行细胞计数,每个待测腺病毒共得到6个数值,最后计算平均数;按照公式:滴度=(荧光细胞数×每孔的视野数)/(加入病毒液体积×稀释倍数),计算出腺病毒滴度。
1.4 磁珠分选 CD4+CD62L+幼稚T淋巴细胞
按常规方法处死C57BL/6小鼠,无菌取脾脏,充分研磨,制成2 mL脾细胞悬液。按德国Miltenyi Biotec公司磁珠分选试剂盒说明书分选获得CD4+CD62L+T细胞,进行细胞计数;用TexMACSTMMedium 培养基(含10%胎牛血清、1%双抗)将细胞密度调整为5×105个/mL,每孔200 μL铺于96孔细胞培养板中。
1.5 流式细胞术检测磁珠分选后CD4+CD62L+T细胞
取分选后的单细胞悬液置于2 mL EP管中,细胞总数约4×105个,加入1 mL 4 ℃预冷的Stain Buffer洗涤细胞2次,300 r/min、4 ℃离心10 min后弃上清。加入200 μL预冷Stain Buffer重悬细胞后,将其分至4个1.5 mL离心管中。向EP管中加入0.1 μL 异硫氰酸荧光素标记的抗小鼠CD4+流式抗体和0.1 μL 藻红蛋白荧光标记的抗小鼠CD62L+流式抗体,并分出空白管和单染管。将荧光标记抗体与细胞悬液吹打混匀后,4 ℃避光孵育30 min。孵育完成后,用1 mL Stain Buffer洗涤细胞2次,300 r/min、4 ℃离心10 min,弃上清液。向各EP管中加入200 μL预冷Stain Buffer重悬细胞,上机检测分析。
1.6 腺病毒表达载体体外转染CD4+CD62L+T细胞
将磁珠分选后的幼稚 T细胞用完全培养基(含10 mmol/L HEPES、1%双抗)重悬至5×105个/mL,铺于96孔细胞培养板,每孔200 μL;参考文献[10]方法,以感染复数(MOI)为50对细胞进行感染,每孔分别加入5 μL腺病毒,每组做3个重复,37 ℃、5% CO2细胞培养箱培养4~6 h;分别收集细胞于1.5 mL灭菌EP管中,300 r/min离心10 min,无菌PBS洗涤1次后进行后续试验;转染miRNA后培养40 h,提取RNA,用miR-124-3p特异性引物及随机引物(Random 6 mers Primer)分别逆转录为cDNA,以U6为内参(正向引物:CGCTTCGGCAGCACATATAC,反向引物:TTCACGAATTTGCGTGTCAT)检测过表达组和空白对照组miR-124-3p的相对表达量。
1.7 CD4+CD62L+ T细胞体外定向分化
分别将转染4~6 h后的幼稚 T细胞收集于1.5 mL灭菌EP管中,做好标记;300 r/min离心10 min,完全弃除上清;用200 μL TexMACSTM培养基(含10%胎牛血清、1% 双抗和下面所述细胞因子)充分混匀重悬细胞;加入的各种重组细胞因子:TGF-β(人2 ng/mL)、IL-1β(小鼠10 ng/mL)、IL-6(小鼠50 ng/mL)、IL-23(小鼠10 ng/mL)、anti-IFN-γ(小鼠10 μg/mL)、anti-IL-4(小鼠10 μg/mL);在5%CO2、37 ℃细胞恒温培养箱培养4 d,300 r/min离心10 min,收集上清,剩余细胞团块用200 μL TexMACSTM完全培养基(含1×cell Stimulation Cocktail和1×Transport Inhibitor Cocktail)继续培养6 h后,收集细胞进行流式细胞术检测Th17细胞占比。
1.8 ELISA检测幼稚T细胞定向Th17细胞分化后细胞上清中IL-17A的浓度
将1.7中收集的上清液进行ELISA检测,检测上清中IL-17A浓度。利用Curve exert 1.6.5软件绘制线性标准曲线,曲线横坐标为标准曲线点的小鼠IL-17A浓度值,纵坐标为标准曲线点的OD平均值。通过样本的OD值,根据标准曲线测出样本中小鼠 IL-17A的浓度。
1.9 数据处理与统计
本研究中全部试验结果均有2次或2次以上独立试验统计得出。两组数据之间的比较使用t检验。P值小于0.05说明两组之间差异显著,具有统计学意义,P值大于0.05则差异不显著。所有统计图均使用GraphPad prism 8.0.2软件(GraphPad Software,San Diego,USA)进行绘制。
2 结果
2.1 腺病毒表达载体滴定
每孔采用2个不同视野进行细胞计数,每个待测腺病毒共得到6个数值,最后计算平均数。miR-124-3p过表达组平均数为34个,抑制组平均数为33个,对照组平均数为35个。因此,miR-124-3p-over =(34 PFU×136)/(0.05 mL×10-4)=9.248×108PFU/mL;NC=(32 PFU×136)/(0.05 mL×10-4)=8.700×108PFU/mL;miR-124-3p-sponge =(35 PFU×136)/(0.05 mL×10-4)=9.520×108PFU/mL。
2.2 流式细胞术检测磁珠分选后幼稚T细胞占比
每只小鼠脾脏可获得约3×107个淋巴细胞,经CD4+CD62L+T细胞磁珠筛选后约可获得1×106个幼稚T细胞,获得率约为3.33%。其中,流式细胞术检测幼稚 T细胞占CD4+T细胞的比值(纯度)>90%,结果见图1。
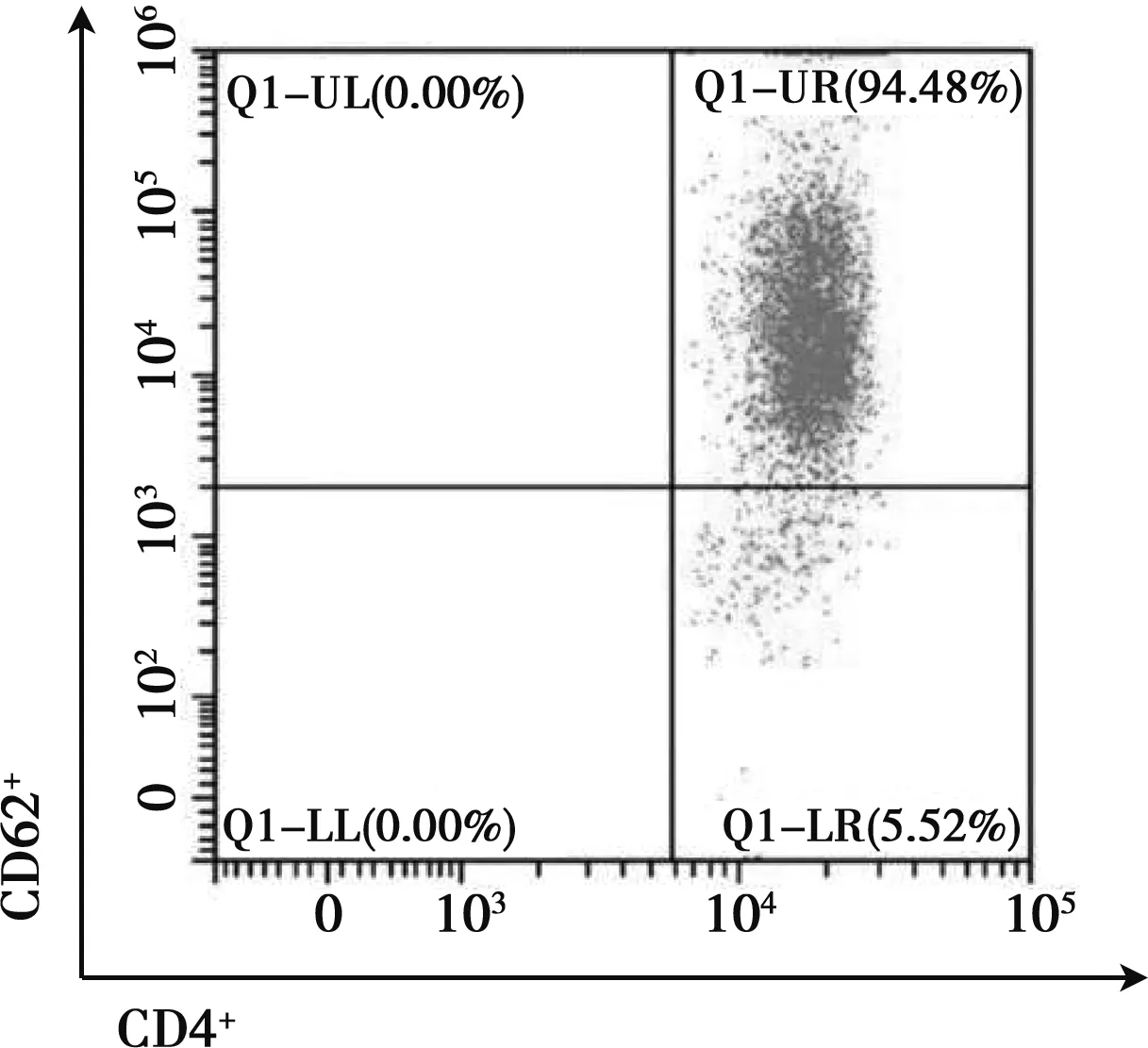
图1 流式细胞术检测磁珠分选后幼稚 T细胞占比CD4+T细胞结果(n=3)
2.3 实时荧光定量PCR(RT-qPCR)检测转染后miR-124-3p相对表达量
荧光定量PCR检测结果表明,miR-124-3p-over(40 h)可显著提高幼稚T细胞中miR-124-3p的表达量(P=0.019 4),结果见图2。

*表示P<0.05,下同图2 RT-qPCR检测过表达组和对照组中miR-124-3p相对表达量(n=3)
2.4 流式细胞术检测Th17细胞体外定向分化
流式细胞术检测细胞表面抗原CD4+和胞内抗原IL-17A,确定各组细胞体外定向分化占比,结果如图3所示。与对照组相比,miR-124-3p-over可抑制幼稚T细胞体外定向分化为Th17细胞,差异显著(P=0.01);而当抑制miRNA-124-3p在幼稚T细胞中表达水平时,则可以显著提高体外Th17细胞定向分化(P=0.02)。

图3 流式细胞术检测体外定向分化Th17细胞占比(n=3)
2.5 ELISA检测幼稚T细胞定向分化后细胞上清中IL-17A的表达结果
使用Curve exert 1.6.5软件制作标准曲线(图4),根据样品OD450的值代入标准曲线(y值)求出各组样品中IL-17A浓度。过表达组上清中IL-17A平均浓度为21.565 pg/mL,空白对照组中IL-17A平均浓度为38.310 pg/mL,抑制组IL-17A平均浓度为64.780 pg/mL(图5)。由图5可见,与对照组相比,miR-124-3p过表达组上清中IL-17A浓度显著下降(P=0.02),miR-124-3p抑制组IL-17A浓度显著增多(P=0.02)。
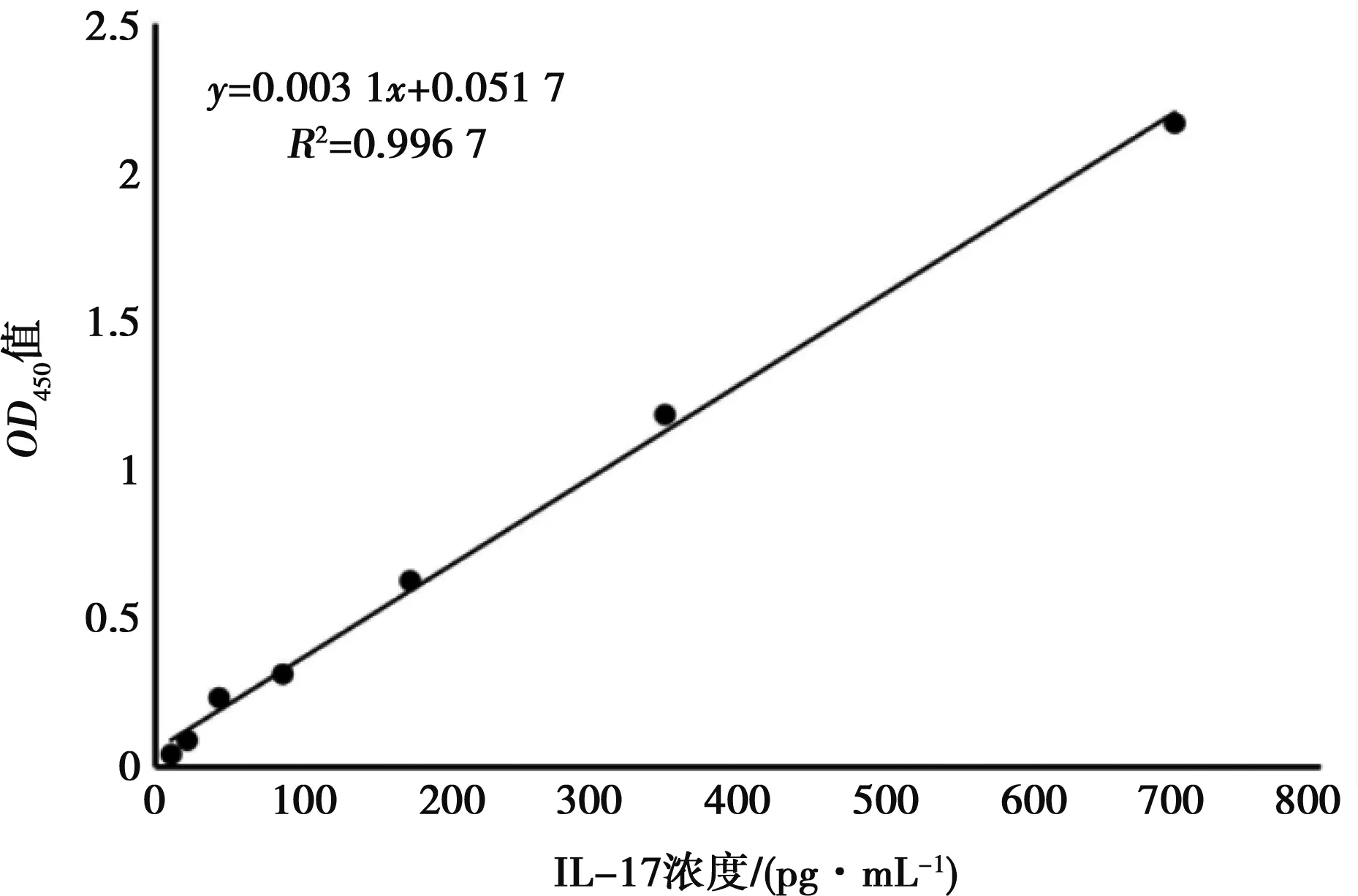
图4 curve exert 1.6.5软件制定的标准曲线
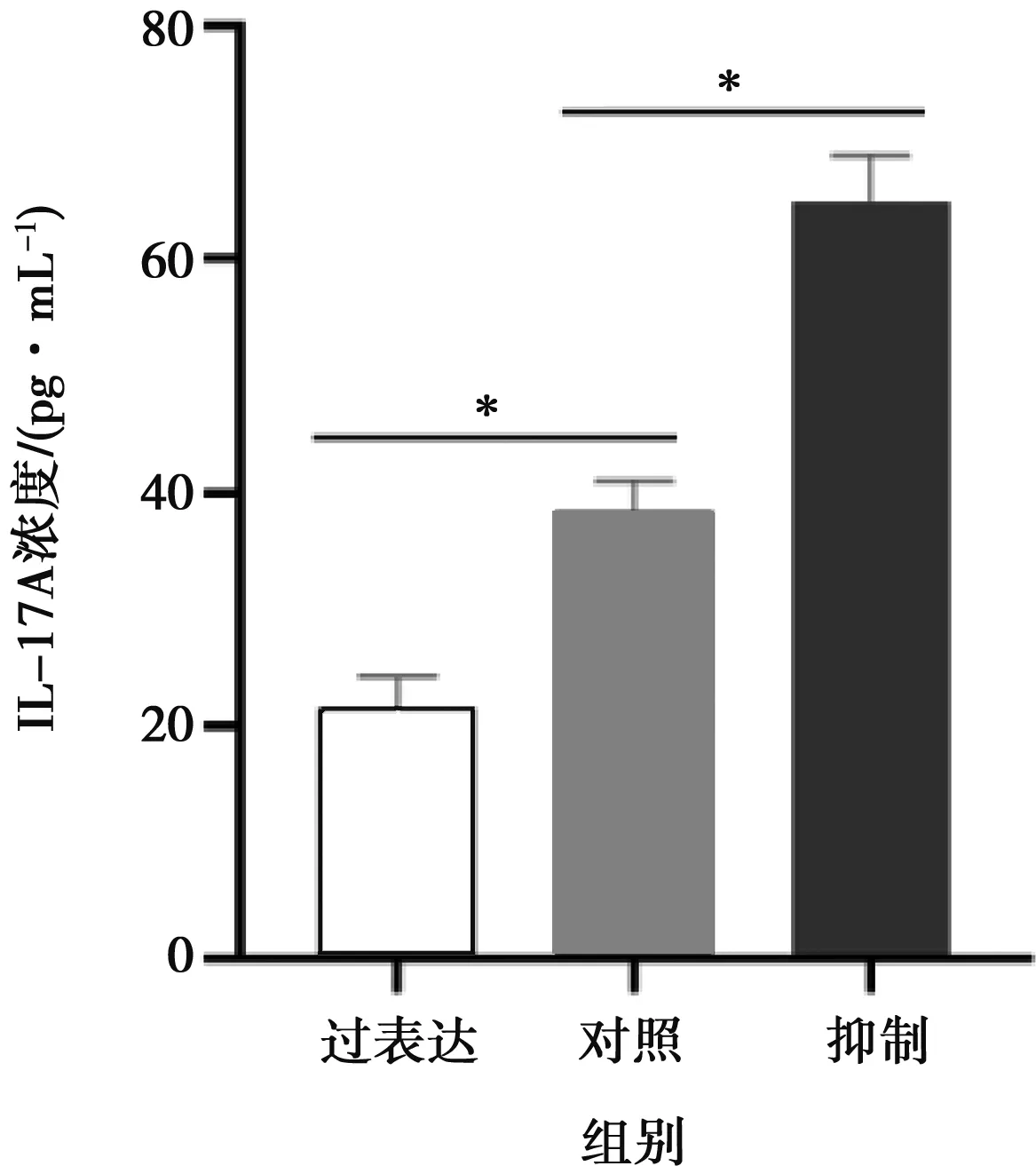
图5 ELISA法检测幼稚 T细胞体外定向分化Th17细胞4 d后各组细胞上清中IL-17A浓度(n=3)
3 讨论
miRNA对靶基因存在多水平调节作用,包括表达遗传效应、启动子调控、RNA加工、稳定以及翻译等[11];同时,miRNA也可对Th17细胞分化的某些关键转录因子(如STAT3、RORγt)进行多水平调节,从而对Th17细胞的分化进行“开始或停止”,调控介导Th17细胞在抗感染、自身免疫性疾病等过程中发挥作用。研究证明,miR-21靶向抑制SMAD-7蛋白促进Th17细胞分化介导试验性自身脑脊髓炎发展[12]。小鼠模型中,miR-193b通过Wnt/β-catenin 信号通路抑制A型流感病毒感染所致的肺脏炎性损伤[13]。利用miRNA靶基因预测软件分析表明,miR-124-3p中的一个重要靶基因,就是Th17细胞分化相关的关键正向转录因子STAT3。在人神经母细胞瘤细胞(SH-SY5Y cells)中,靶向调控STAT3蛋白表达对1-甲基-4-苯基吡啶离子(MPP+)所致的神经损伤具有改善作用[14]。
腺病毒表达载体不仅对传代细胞具有良好的转染效果,在较难转染的原代细胞(CD4+T淋巴细胞)也具有良好的转染效果,且具有毒性较低的特点[15]。本试验中,对磁珠法分选的幼稚T细胞,培养过夜后使其适应一段时间,利用腺病毒表达载体(感染复数为50)使其过表达并设置空白对照组,感作4~6 h,换液培养40 h后,荧光定量PCR检测结果表明,过表达组中miR-124-3p表达量显著上调(P<0.05),表明腺病毒表达载体在转染幼稚T细胞时,转染细胞的miRNA表达可取得较好的试验效果,为miRNA调控Th17细胞体外分化提供基础。为探讨miR-124-3p在体外极化条件下对Th17细胞分化的影响,本试验采用免疫磁珠法筛选出幼稚 T细胞,并用流式细胞术对其纯度进行检测,结果表明纯度大于90%,说明磁珠筛选幼稚 T细胞具有较好的效果,达到体外分化的要求。转染腺病毒后的幼稚T细胞在Th17细胞体外分化的条件下,刺激其向Th17定向分化的结果表明,与对照组相比,miR-124-3p过表达组可显著降低Th17细胞分化占比,而抑制组可显著增加Th17细胞分化占比。与空白对照组相比,过表达组中IL-17A浓度显著降低,抑制组中IL-17A浓度显著增加。IL-17是Th17细胞分泌的免疫调节因子,IL-17A主要通过诱导靶细胞表达多种炎症因子和趋化因子来发挥其促进炎症反应的功能[16]。猪流感病毒感染诱导的小鼠急性呼吸窘迫综合征模型中,小鼠血浆和支气管肺泡灌洗液中IL-17A含量升高,而IL-17A的基因敲除小鼠中,猪流感病毒感染诱导的急性呼吸窘迫综合征都得到了有效缓解[17]。
综上所述,miR-124-3p显著上调具有抑制宿主Th17细胞分化作用,从而减轻Th17细胞介导的炎性反应,其具体的靶向调控基因还需要进一步深入研究。
