奶牛产后血液炎性因子变化规律
2021-04-12郭启勇陶金忠吴心华郭延生宁夏大学农学院宁夏银川750021
郭启勇,陶金忠,吴心华,郭延生 (宁夏大学 农学院,宁夏 银川 750021)
奶牛围产期(periparturient period)指产前21 d和产后21 d[1],这一时期奶牛经历了妊娠-产犊-泌乳3个巨大的生理变化。产后由于食欲尚未恢复,加之泌乳启动,能量摄入远低于能量输出,所以奶牛分娩后易处于能量负平衡(negative energy balance,NEB)的生理状态。NEB导致血糖水平降低,并动员分解体脂以弥补能量不足,血液中游离脂肪酸(NEFA)和β-羟基丁酸(BHBA)浓度反馈性升高[2]。而高浓度的NEFA与BHBA使免疫机能受到抑制,使机体对病原微生物的易感性增加[3]。据报道,NEFA含量与慢性炎症的发生有关,随着NEFA增加,炎症反应逐渐加重,单核细胞吞噬细菌碎片和中性粒细胞抗击细菌侵袭能力也在降低[4]。
细胞因子主要由T淋巴细胞、巨噬细胞和嗜酸性粒细胞产生。其功能包括激活和抑制免疫系统反应、诱导细胞分裂和调节记忆细胞[5]。以往大多数研究仅集中在奶牛产后发生炎性疾病(如子宫内膜炎、胎衣不下和乳房炎)时一些炎性细胞因子的变化情况,对产后21 d内炎性细胞因子的变化规律缺乏系统研究。因此本研究对奶牛产后21 d内炎性细胞因子的动态变化进行研究,以期揭示奶牛围产后期炎性应答的基本规律,为预防产后炎性疾病的发生提供参考依据。
1 材料与方法
1.1 实验动物饲养管理实验动物均为荷斯坦奶牛,牛只饲喂和样品采集均于2019年9月至11月在宁夏某规模化养殖场进行。选取体况相近的2~3胎次自然分娩的产后荷斯坦奶牛10头。奶牛场每天挤奶3次(4:00、12:00、20:00)。采用全混合日粮(TMR)饲喂,自由饮水,产前使用表1配方饲喂,产后用表2配方饲喂。产后1 h内将益康XP 350 g、丙酸钙450 g、硫酸镁100 g、盐50 g、丙二醇300 mL、氯化钙120 g和20 L温水混合经瘤胃导管灌服。

表1 围产前期奶牛TMR日粮配方 %

表2 奶牛产后TMR日粮配方 %
1.2 样品采集在分娩后0、7、14和21 d早上饲喂前尾静脉采集血液10 mL,肝素钠抗凝,3 000 r/min离心10 min,收集血浆,-196℃保存待测。
1.3 主要试剂分别利用牛肿瘤坏死因子(TNF-α)、牛白细胞介素1(IL-1)、牛白细胞介素2(IL-2)、牛白细胞介素6(IL-6)、牛白细胞介素8(IL-8)、牛白细胞介素17(IL-17)、牛白细胞介素18(IL-18)、牛白细胞介素23(IL-23)、牛转化生长因子(TGF-β)、牛白细胞介素4(IL-4)、牛白细胞介素10(IL-10)、牛白细胞介素13(IL-13)和牛免疫球蛋白(IgG)试剂盒进行检测(江苏晶美,中国)。
1.4 试验方法血样常温下解冻,采用ELISA法对血浆中TNF-α、IL-1、IL-2、IL-6、IL-8、IL-17、IL-18、IL-23、TGF-β、IL-4、IL-10、IL-13和IgG含量进行检测。
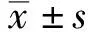
2 结果
2.1 奶牛产后促炎性细胞因子的变化规律血浆中TNF-α、IL-8、IL-17的含量在产后0 d显著高于产后7、14和21 d(P<0.05);血浆中IL-1的含量在产后14 d显著高于其他时间段(P<0.05);血浆中IL-2、IL-18的含量在产后0 d极显著高于产后其他时间段(P<0.01);血浆中IL-6含量在产后7 d显著高于其他时间段(P<0.05);血浆中IL-23含量在产后0 d显著低于其他时间段(P<0.05),且随着时间逐渐升高且差异显著(P<0.05);血浆中TNF-α、IL-1、IL-6、IL-8、IL-17、IL-18的含量在产后21 d显著降低(P<0.05)(表3,图1)。
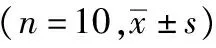
表3 奶牛产后不同时间促炎性细胞因子的变化 ng/L

A.奶牛产后血浆中TNF-α和IL-1质量浓度;B.奶牛产后血浆中IL-2质量浓度;C.奶牛产后血浆中IL-6和IL-8质量浓度;D.奶牛产后血浆中IL-17和IL-23质量浓度;E.奶牛产后血浆中IL-18质量浓度。**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。下同
2.2 奶牛产后抗炎性细胞因子变化规律血浆中TGF-β、IL-4、IL-10、IL-13和IgG的含量在产后0 d显著高于其他时间段(P<0.05);血浆中IL-4的含量在产后7 d开始逐渐下降且差异不显著(P>0.05);血浆中TGF-β、IL-10和IL-13的含量在产后21 d显著低于其他时间段(P<0.05)(表4,图2)。

表4 奶牛产后不同时间抗炎性细胞因子变化 ng/L
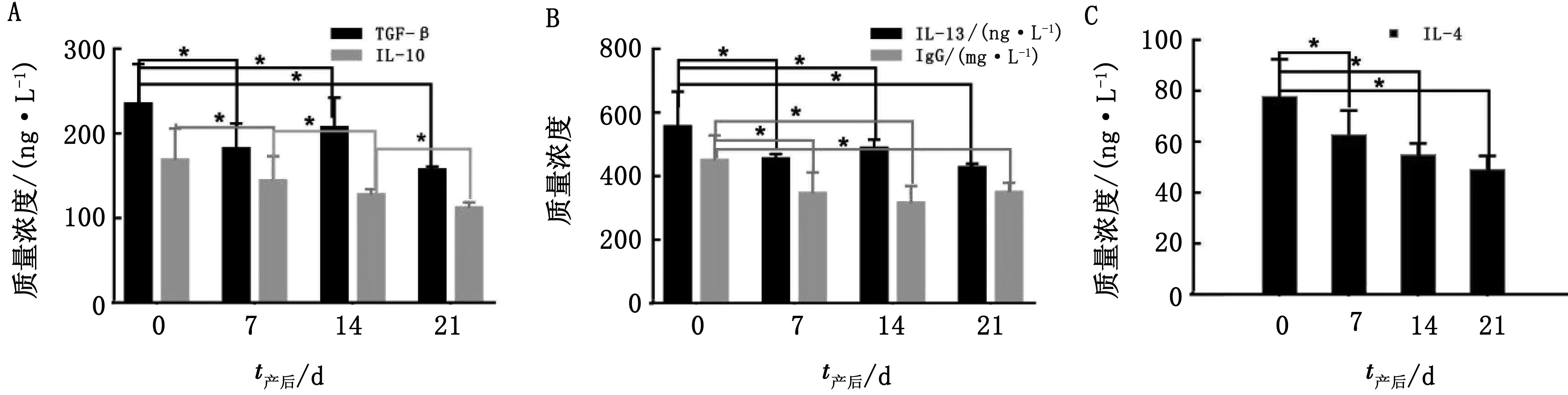
A.奶牛产后血浆中TGF-β和IL-10质量浓度;B.奶牛产后血浆中IL-13和IgG质量浓度;C.奶牛产后血浆中IL-14质量浓度
3 讨论
3.1 奶牛产后促炎性细胞因子的变化规律促炎性因子的释放将会导致免疫细胞的激活和产生。TNF-α可以促进T细胞产生各种炎症因子,进而促进炎症反应的发生。另有研究表明,产前7 d给奶牛每天皮下注射TNF-α,血浆TNF-α含量增加3倍,奶牛干物质采食量(dry matter intake,DMI)降低24%[6],说明血浆中的TNF-α含量的升高对奶牛DMI有抑制作用。本试验结果显示,奶牛产后0 d TNF-α含量极显著高于产后7、14和21 d,这与产犊造成的子宫炎性损伤密切相关,而TNF-α的升高又进一步抑制了奶牛DMI。
IL-1的表达对炎症具有多效性作用,作为一种主要的促炎细胞因子,IL-1主要由天然免疫细胞表达。然而,在生理和病理条件下,各种类型的细胞都表达IL-1,信号转导通过不同水平的正负调控因子对免疫机能进行调控[7]。另外,在细菌感染时,通过中性粒细胞特异性蛋白酶在中性粒细胞的表达促使IL-1含量增高。在本研究中,产后14 d血浆中IL-1的含量显著高于其他时间段,这说明产后14 d是代谢性疾病和感染性疾病最为容易发生的时间。另外也有调查研究显示,奶牛产后14 d是疾病高发时期[8]。
IL-2的主要生理作用是刺激和维持T淋巴细胞的分化增殖,促进细胞分化过程中各亚型淋巴细胞的活化,产生免疫反应。IL-2具有调节CD4+和CD8+细胞增殖、诱导自然杀伤细胞增殖、促进抗体产生和B淋巴细胞增殖[9]的作用。IL-2的变化与产后时间的延长没有直接关系,与特异性受体的亲和力有关[10]。有研究表示IL-2对妊娠有消极作用,在怀孕小鼠的体内注射IL-2,可使怀孕小鼠终止妊娠[11],IL-6可作为急性感染的早期诊断依据,细菌感染后IL-6含量迅速升高,其升高水平与感染的严重程度一致。有研究表明,正常泌乳期奶牛血浆中IL-1和IL-6的含量比早期泌乳期低1.5~5.0倍[12]。IL-8是炎症反应和血管生成重要的趋化因子,在肿瘤细胞系、癌症患者的血液中含量均升高,由单核巨噬细胞产生。奶牛产后0 d血浆中IL-2、IL-6和IL-8浓度升高,这与奶牛分娩启动导致的产道和子宫损伤有关。产后7 d,血浆中IL-2、IL-6和IL-8浓度没有显著降低,这可能与产后7 d病原微生物的侵袭有关。另外也有研究表明,奶牛发生炎症反应或病原微生物的感染会使血浆中IL-2、IL-6和IL-8浓度升高[13-14]。
IL-17诱导中性粒细胞生成和迁移,是黏膜免疫最为主要的细胞因子,黏膜免疫的缺陷有助于细菌和病毒入侵,导致炎症发生。本试验发现奶牛产后0 d血浆中IL-17的含量显著高于其他时间段,这可能与产后0 d产道的急性损伤和分娩启动有关。另外有研究表明,当奶牛被牛病毒性腹泻病毒和金黄色葡萄球菌感染时,血浆中的IL-17也显著升高[15-16]。IL-18是IL-1细胞因子家族的一员,是胃肠道黏膜内稳态的关键调节因子,具有促炎和免疫调节的作用。相关资料显示IL-18浓度的升高与分娩启动有关[17]。在本研究中,产后0 d血浆中IL-18极显著高于产后其他阶段,这可能与分娩启动有关。
IL-23是一种中枢促炎细胞因子,对免疫反应具有广泛的影响。IL-12和IL-23在结构上共享同一个亚基,并在T细胞介导的炎症反应中发挥重要作用,是巨噬细胞和树突状细胞应对外界病原微生物产生的促炎性细胞因子[18]。IL-23在感染、炎症、自身免疫性疾病及肿瘤免疫中发挥重要的作用,人医临床发现肠炎和银屑病患者的IL-23的水平较高[19]。本研究中血浆中的IL-23含量在产后不断升高且产后21 d显著高于其他阶段,这可能与产后NEB造成的免疫抑制和产后酸中毒导致的腹泻密切相关。
3.2 奶牛产后抗炎性细胞因子变化规律抗炎性细胞因子表达是机体自我防御的体现,奶牛产后由于生产应激和泌乳需要,导致抗炎性细胞因子的含量升高。TGF-β是一种主要的免疫抑制细胞因子,所有免疫系统细胞都表达TGF-β,TGF-β是最强大的免疫抑制细胞因子,在各种免疫细胞中的抗增殖和抗炎来维持免疫稳态[20]。另有研究表明,当奶牛患子宫内膜炎时,血液中TGF-β的含量显著低于健康奶牛[21]。本试验结果也表明,产后0 d血浆中TGF-β含量显著高于产后7、14和21 d,产后7和14 d明显高于产后21 d。这说明奶牛产后由于分娩启动和NEB,造成奶牛在围产后期处于免疫抑制状态。IL-10是炎症和伤口愈合中的主要抗炎因子和抗纤维化因子,是一种有效的负反馈调节因子,主要作用是抑制树突状细胞的抗原递呈,抑制巨噬细胞的活化和浸润到损伤部位,继而减弱促炎细胞因子的表达[22]。从细胞水平上来说,IL-10是一种转录后调节剂,通过信号转导和转录激活因子来限制损伤后的组织死亡和器官功能障碍。本研究发现,由于产犊造成的出血使产后0 d奶牛血浆中IL-10的含量显著高于其他阶段。产后7、14和21 d逐渐降低,这与机体的产后能量负平衡的恢复有关。
IL-4和IL-13享用同一受体链和信号传导系统,因此IL-4和IL-13功能有部分重叠,两者均具有支持B细胞产生抗体的作用[23],IL-4和IL-13共享受体和生物活性的可用性反映了免疫保护在进化上的作用,两者都会影响组织结构蛋白表达和正常皮肤屏障保护,IL-13还参与皮肤炎症反应。IL-13在外周免疫机能中的作用更为突出,在炎性反应状态下,IL-13会迅速升高[24]。研究表明,怀孕期间血浆中IL-4含量上升,IL-4是一种很重要的抗病毒免疫细胞,可以促进白细胞介导的细胞免疫,以及抑制中性粒细胞和巨噬细胞活化[25]。IL-4的含量降低,革兰阳性金黄色葡萄球菌的传播概率就会增大[26]。本试验研究结果表明,IL-4和IL-13含量也呈现类似的变化,产后0 d显著高于产后其他时间段,产后7、14和21 d差异不显著。这说明奶牛产后抗病毒和阻止细菌感染的能力明显降低。IgG是血清主要的抗体成分,也是唯一可以通过胎盘的免疫球蛋白。临床上通过对IgG的检测来评价初生犊牛的获得性免疫,IgG在初乳中的含量比常乳高,牛布鲁菌的免疫效果使用IgG来评价。本次研究中血浆中IgG在产后0 d显著升高,产后7 d开始逐渐降低,说明分娩启动和产后能量负平衡会导致IgG的升高,但是随着机体的逐渐恢复,IgG的浓度逐渐降低。
本试验系统研究了奶牛在产后0、7、14和21 d血液中细胞因子的变化规律,结果显示奶牛产后0 d血浆中TNF-α、IL-2、IL-8、IL-17、IL-18、TGF-β、IL-4、IL-10、IL-13和IgG的含量高于其他时间段,IL-1的含量在产后14 d高于其他时间段,TNF-α、IL-1、IL-6、IL-8、IL-17、IL-18、TGF-β、IL-10和IL-13的含量在产后21 d显著降低,IL-6含量在产后7 d高于其他时间段,IL-23含量在产后0 d低于其他时间段,且随着时间逐渐升高,IL-4的含量在产后7 d开始逐渐下降。这说明奶牛产后炎性因子的变化可能与分娩启动、急性炎性损伤和能量负平衡引起的免疫抑制和病原微生物的感染等多种因素有关。
