猪IL-10重组腺病毒的构建及其对PRRSV体外增殖的影响
2021-04-12魏婷婷刘思颖杜连昭王茜茜王兴龙西北农林科技大学动物医学院陕西杨凌712100
魏婷婷,刘思颖,杜连昭,李 晨,王茜茜,马 欣,王兴龙 (西北农林科技大学 动物医学院,陕西 杨凌 712100)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)又称“猪蓝耳病”,由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)感染猪引起,自1987年被首次报道以来[1]给全球养猪业带来巨大的经济损失[1-3]。PRRSV基因型分为欧洲型(Ⅰ型)与美洲型(Ⅱ型)[4]2种,2种分型的PRRSV毒株感染后引起的临床症状基本相同[5]。
我国主要流行Ⅱ型PRRSV毒株[6-8],并于2006年自江西省开始出现[9-10]高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV),该病被列为一类传染病[11]。在我国PRRSV的地区性流行时有发生,减毒活疫苗在防控PRRS时起一定程度作用[12],但PRRSV为RNA病毒,其基因组不断地变异与重组产出新的强毒株,给疫苗防控带来巨大的挑战。PRRSV为套式病毒目、动脉炎病毒科、动脉炎病毒属的一员[13],与同属的其他病毒有着相似的基因结构和复制方式[14],且同样主要感染巨噬细胞并在其中进行复制,造成感染后机体的免疫抑制与持续性感染,这一特征为其防控带来阻碍,且其机理尚不明确。研究发现,PRRSV感染猪后可诱导机体PBMC与PAM等细胞分泌IL-10使其表达上调,但被诱导的IL-10高表达对PRRSV感染机体的意义尚不明确。
IL-10细胞因子作为一个典型的免疫抑制因子,可能在PRRSV的感染过程中发挥主要作用。为探究IL-10对PRRSV在细胞内增殖的影响,本研究利用重组人腺病毒表达系统构建表达猪IL-10的重组腺病毒,以重组腺病毒感染的方式实现细胞内IL-10的过表达,并检测过表达IL-10对PRRSV在体外细胞内增殖产生的影响,以期为后续体内试验的进行提供技术支持,为进一步揭示IL-10于PRRSV感染的分子意义提供依据,从而给PRRSV的防控提供解决思路。
1 材料与方法
1.1 毒株、菌种、细胞和质粒PRRSV SD16-GFP毒株由实验室拯救并鉴定后保存,表达绿色荧光蛋白的rHAd-EGFP腺病毒、pAdTrack-cmv 与pAdEasy-1质粒、E.coliDH5α与BJ5183菌株、HEK-293A细胞、Marc-145细胞与3D4/21细胞均由本实验室保存;含有猪IL-10全长基因序列的pET28a-IL-10质粒为实验室鉴定后保存。
1.2 主要试剂抗PRRSV N蛋白鼠源多克隆抗体为自行制备保存;鼠源β-tubulin与TAGE标签一抗购自天津三箭生物技术有限公司;HRP标记的山羊抗鼠抗体购自生工生物工程股份有限公司;转染试剂TurboFect Transfection Reagent、0.1% ATV、Opti-MEM与DMEM培养基购自Thermo Scientific;胎牛血清(Sera Pro)、Trizol购自TaKaRa;DEPC水与分析纯购自索莱宝;胶回收试剂盒与RNA反转试剂盒、DNA与蛋白Marker购自GenStar;连接试剂盒、DNA聚合酶(TaKaRa);质粒提取试剂盒购自天根生物公司;限制性内切酶,NEB产品。
1.3 引物设计与合成根据GenBank存录序列,分别设计扩增IL-10全长的上下游引物IL-10-1s、IL-10-1a与qPCR引物、PRRSV ORF7及对照qPCR引物、IL-10检测引物(表1)。引物均由擎科生物公司合成。

表1 引物序列
1.4 穿梭质粒pAdTrack-cmv-IL-10的构建以实验室保存的pET28a-IL-10质粒为模板,使用IL-10-1s与IL-10-1a进行PCR扩增获得猪IL-10基因。利用BglⅡ和NotⅠ酶切位点连入pAdTack-cmv载体后转化大肠杆菌DH5a感受态细菌,筛选出阳性重组质粒并进行BglⅡ和NotⅠ双酶切与基因测序鉴定。
1.5 重组腺病毒质粒pAd-IL-10的构建使用EcoRⅠ限制性内切酶将1 μg pAdTrack-cmv-IL-10质粒线性化后转化含pAdEasy-1腺病毒骨架载体的BJ5183感受态细菌,使两者完成同源重组。筛选出阳性重组菌落并进行酶切与测序鉴定,大量扩增pAd-IL-10重组质粒后于-20℃保存备用。
1.6 rHAd-IL-10重组腺病毒的包装将PacⅠ限制性内切酶线性化的pAd-IL-10腺病毒重组质粒转染HEK-293A细胞六孔板(4 μg/孔),次日更换含2% FBS的细胞维持液培养10~14 d。
在显微镜下观察转染后的细胞,当出现拉丝、空洞等特征性的细胞病变后,收集病毒液按500 μL/孔的量转接新的HEK-293A细胞6孔板中培养2~3 d,使用荧光电子显微镜观察GFP表达情况,并观察细胞的病变情况,收集病毒液。
1.7 重组腺病毒的TCID50测定将rHAd-EGFP、rHAd-IL-10病毒液使用纯DMEM培养液进行10-2~10-12的10倍倍比稀释,每个稀释度8个重复孔。于预备HEK-293A细胞的96孔板中每孔加入100 μL稀释好的病毒液孵育1 h后更换维持液继续培养4~5 d,统计产生CPE的细胞孔数,按照Karber法进行计算。
1.8 Western blot检测IL-10的表达将10 MOI rHAd-IL-10与rHAd-EGFP病毒分别接入3D4/21细胞24孔板中,培养48 h后收集细胞样品进行Western blot检测。一抗为鼠源抗FLAG或β-tubulin标签抗体,二抗为HRP标记的羊抗鼠二抗。用ECL化学发光检测系统检测目的蛋白(23 kDa)与β-tubulin蛋白(55 kDa)条带。
1.9 猪IL-10的活性验证据文献报道,IL-10可以抑制LPS对单核巨噬细胞产生IL-12的诱导作用[15]。试验使用质量浓度为 1 mg/L的LPS诱导3D4/21细胞产生IL-12后,再利用RT-qPCR技术测定分别感染rHAd-IL-10、rHAd-EGFP病毒36 h后的3D4/21细胞中IL-12 mRNA表达量的差异,从而验证rHAd-IL-10重组腺病毒表达的猪IL-10的活性。
1.10 IL-10对PRRSV增殖的影响使用10 MOI rHAd-IL-10病毒提前感染Marc-145细胞(24孔板)实现猪IL-10的过表达,设感染rHAd-EGFP病毒为对照组,培养24 h后每孔分别加入1 MOI PRRSV SD16-GFP病毒,继续培养一段时间后收样,分别进行RT-qPCR、Western blot与TCID50检测。
2 结果
2.1 穿梭质粒pAdTrack-cmv-IL-10的构建将IL-10基因(573 bp)(图1A)连入pAdTack-cmv载体获得穿梭质粒pAdTrack-cmv-IL-10(图1B),经BglⅡ与NotⅠ酶双酶切鉴定(载体约9 200 bp、目的片段约560 bp)(图1C)均正确后,送至西安擎科生物公司进行测序鉴定,结果符合。
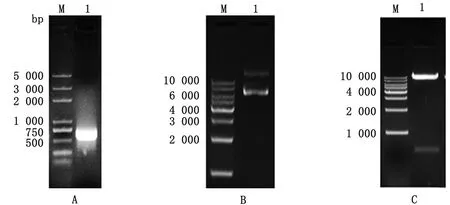
M.DNA Maker;A.IL-10目的片段扩增;B.质粒pAdTrack-cmv-IL-10电泳;C.质粒pAdTrack-cmv-IL-10双酶切鉴定
2.2 重组腺病毒质粒pAd-IL-10的构建线性化的 pAdTrack-cmv-IL-10质粒(图2A)转化含pAd-Easy-1的BJ5183菌后获得pAd-IL-10重组质粒(约35 000 bp)(图2B)。

A.pAdTrack-cmv-IL-10质粒EcoRⅠ酶切结果(1.pAdTrack-cmv-IL-10质粒);B.pAd-IL-10质粒电泳结果(1.pAdTrack-cmv-IL-10质粒对照;2.pAd-IL-10质粒);C.pAd-IL-10 PacⅠ酶切(1.pAdTrack-cmv-IL-10质粒酶切对照;2.pAd-IL-10质粒酶切产物);M.DNA Marker
2.3 rHAd-IL-10重组腺病毒的包装使用PacⅠ将pAd-IL-10质粒线性化得到大小约5 000、30 000 bp的2条条带(图2C),转染HEK-293A细胞后12 d左右在显微镜下观察到细胞病变(图3A),收集病毒液转接新的HEK-293A细胞,72 h后使用荧光电子显微镜观察到大量GFP表达(图3B)。
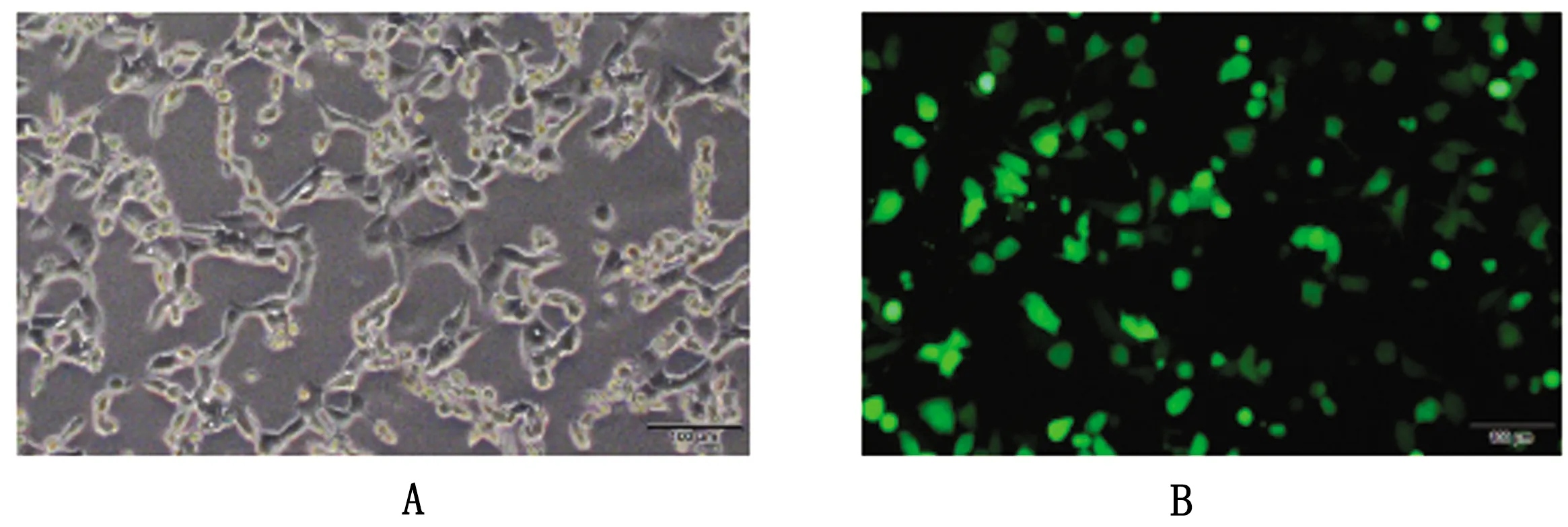
A.pAd-IL-10腺病毒重组质粒转染HEK-293A细胞后细胞病变图;B.rHAd-IL-10重组腺病毒感染HEK-293A细胞荧光图
2.4 重组腺病毒的TCID50测定按照Karber法进行计算,得出rHAd-EGFP重组腺病毒的TCID50为10-9.87/mL,rHAd-IL-10重组腺病毒的TCID50为10-10.25/mL。
2.5 Western blot检测IL-10的表达rHAd-IL-10重组腺病毒感染3D4/21细胞后成功表达IL-10(23 kDa),对照组成立(图4A)。
2.6 猪IL-10活性验证感染rHAd-IL-10重组腺病毒的3D4/21细胞中IL-12 mRNA表达量相比rHAd-EGFP对照组显著降低约40%(P<0.01)(图4B),即rHAd-IL-10重组腺病毒表达的猪IL-10具有相应的生物活性。
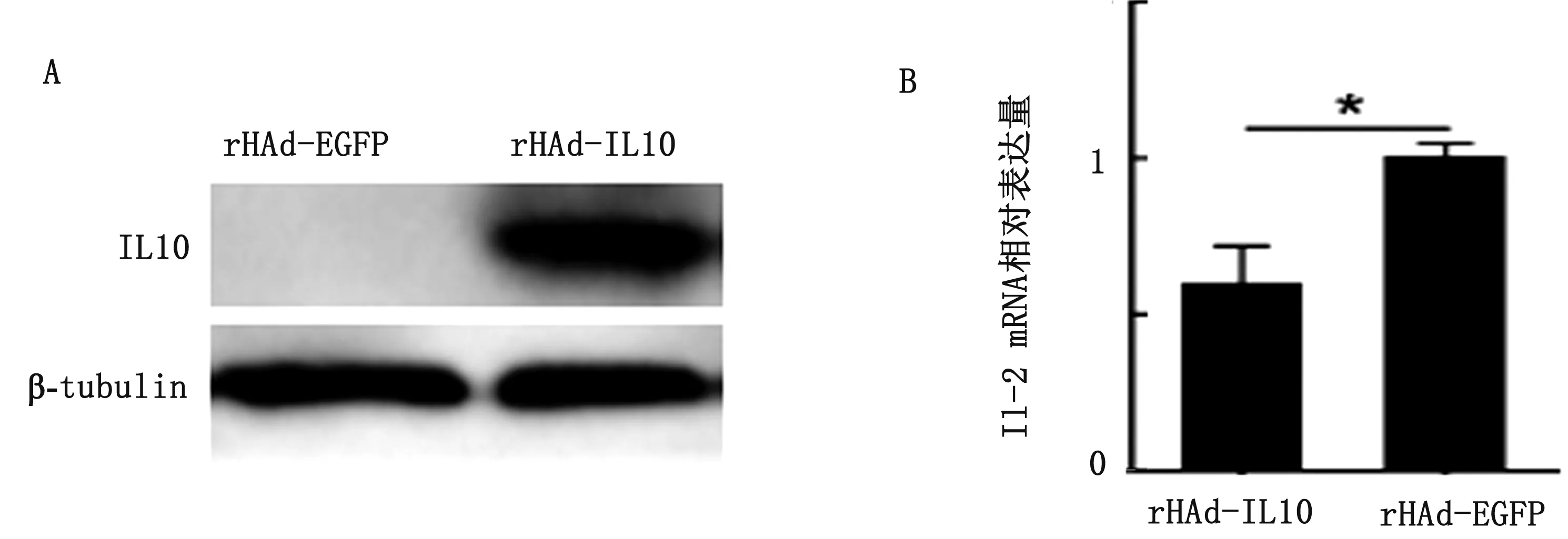
A.Western blot 检测IL-10;B.RT-qPCR检测IL-12 mRNA
2.7 IL-10对PRRSV增殖的影响
2.7.1RT-qPCR检测PRRSV mRNA水平 Marc-145细胞分别经rHAd-EGFP(对照组)和 rHAd-IL-10感染24 h后接入PRRSV SD16-GFP病毒,培养24、48 h后收取细胞样品,RT-qPCR检测2组细胞RNA中PRRSV ORF7转录mRNA的量。结果如图5A所示,使用rHAd-IL-10重组腺病毒过表达猪IL-10的细胞组检测到PRRSV ORF7转录mRNA的量显著增多(P<0.01),在24、48 h分别约为对照组的1.6和2.3倍,说明过表达猪IL-10促进PRRSV病毒在Marc-145细胞内的转录水平,即促进病毒增殖。
2.7.2Western blot检测PRRSV N蛋白的表达 Marc-145分别经rHAd-EGFP(对照组)、rHAd-IL-10重组腺病毒感染24 h后接入PRRSV SD16-GFP病毒,培养48 h后收取细胞样品,Western blot检测2组细胞中PRRSV N蛋白的量,使用Image J软件对蛋白条带进行灰度分析后,结果显示经rHAd-IL-10重组腺病毒过表达猪IL-10的细胞中N蛋白的表达量相比对照组显著增多(P<0.01)(图5C),约为对照组的1.2倍,这一结果证明猪IL-10可以促进PRRSV SD16-GFP病毒在Marc-145细胞内的增殖(图5)。
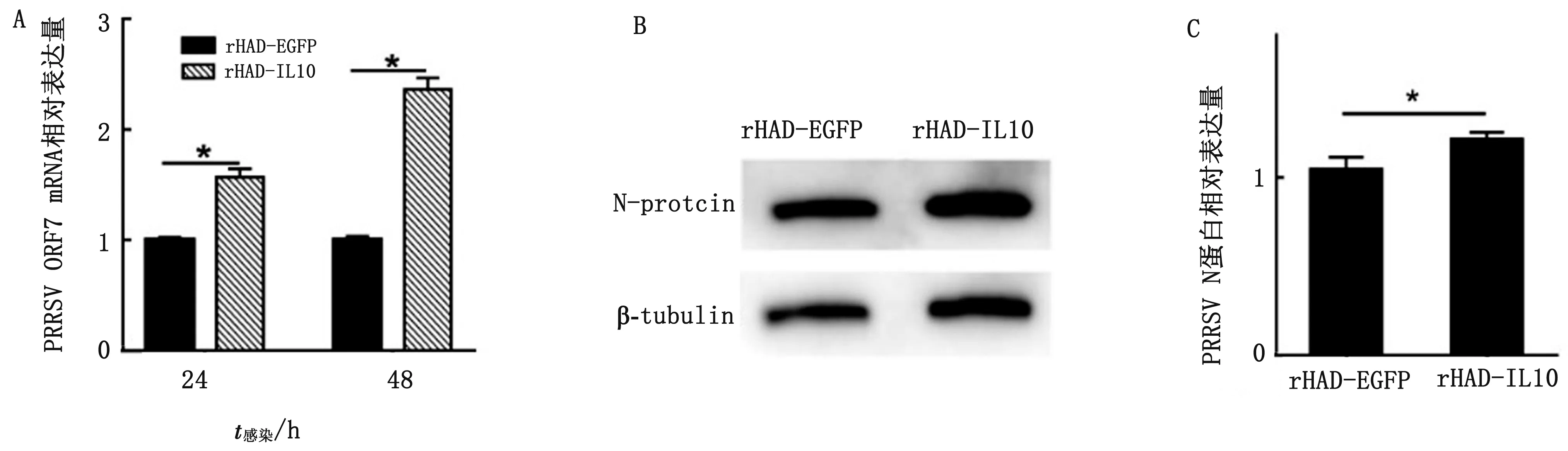
A.RT-qPCR检测IL-10对Marc-145细胞中PRRSV mRNA水平的影响;B.Western blot检测Marc-145细胞中PRRSV蛋白表达水平;C.蛋白灰度分析
2.7.3PRRSV的TCID50测定 经处理后的Marc-145细胞上清液转接新的Marc-145细胞96孔板后进行TCID50检测,4~5 d后统计产生CPE的细胞孔数,按照Karber法计算各组的病毒滴度得出rHAd-EGFP和rHAd-IL-10处理后的PRRSV病毒TCID503次试验平均值分别为10-4.42/mL和10-5.14/mL。转换为PFU后,rHAd-IL-10处理组的PRRSV SD16-GFP病毒滴度显著高于rHAd-EGFP处理的对照组(P<0.01),证明猪IL-10表达上调可以促进PRRSV SD16-GFP病毒在Marc-145细胞内的增殖(图6)。
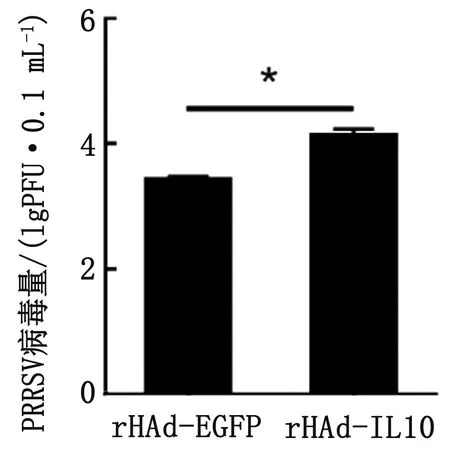
图6 TCID50检测IL-10对Marc-145细胞中PRRSV病毒滴度的影响
3 讨论
PRRSV通过感染PAM细胞进入猪体内后,能通过不断地在细胞内复制实现持续性感染,而长期在猪体内存在,在感染后易引发与其他细菌或病毒病的混合性感染[16-19],造成这一现象的机制尚不明确[20]。此外,PRRSV的感染影响猪瘟疫苗免疫后机体产生猪瘟抗体[21-23],这一影响很可能由PRRSV造成的免疫抑制引起。PRRSV病毒粒子在感染机体后的前期与后期均会诱导一系列细胞因子的表达水平产生相应变化,例如IL-10、IL-1β、IL-6、IL-8、TNF-α和IL-15等[24-26],它们的产生和分泌与机体的免疫应答息息相关。在这些细胞因子中,IL-10作为典型的免疫抑制因子,在PRRSV毒株感染猪后会引起其水平持续上升[27],但是这种高表达现象对PRRSV感染的意义何在仍无定论。
本研究选用重组腺病毒载体来实现IL-10的表达调控,为后续的多种细胞试验及动物试验的简便性与安全性奠定了基础。试验结果表明,获得的rHAd-IL-10重组腺病毒感染3D4/21细胞后可以抑制LPS诱导的IL-12细胞因子的表达与分泌,这一结果与已有研究发现相吻合[15]。IL-12细胞因子参与促进细胞免疫应答调控,可诱导相应的免疫细胞产生IFN-γ,提升机体的抗病毒作用。IL-10的这种抑制作用可能是导致机体感染 PRRSV后出现免疫抑制的重要原因之一。
研究还证实IL-10在细胞内表达水平上调后会促进PRRSV SD16-GFP病毒在Marc-145细胞内的增殖,这为构建用于病毒扩增的细胞系提供理论支持。此外,推测这一促进作用与PRRSV感染机体后易诱发混合感染可能存在联系,已有试验表明IL-10水平降低可抑制猪瘟病毒在体内的复制[28],IL-10的高表达对病毒增殖的促进作用可能是导致混合感染的重要原因,这有利于临床防控,但其中可能存在更复杂的机制,还需要进行更深入的研究。
