替莫唑胺+贝伐单抗+肿瘤电场治疗MGMT启动子未甲基化的复发性胶质母细胞瘤一例
2021-04-12杨博成蒋理石全红詹彦孙晓川谢延风
杨博成 蒋理 石全红 詹彦 孙晓川 谢延风
患者 女性,25岁,主因头晕、记忆力减退2个月,于2020年1月1日至我院门诊就诊。患者2个月前无明显诱因出现头晕,伴记忆力减退,表现为反复出现的头重脚轻感,偶感行走不稳、视物旋转,每次持续数分钟至十数分钟,休息后自行缓解,并逐渐出现近事遗忘,对短期内发生的事回忆困难。患者曾于2015年12月因间断性头晕、头痛(全头部胀痛伴闷胀感),伴视物旋转10余天在我院神经外科就诊,头部MRI显示右背侧丘脑及侧脑室三角区囊实性占位性病变,考虑胶质瘤(图1a),于2015年12月19日行右背侧丘脑及侧脑室三角区肿瘤切除术,于显微镜下全切除肿瘤,术后组织病理学诊断为多形性胶质母细胞瘤(WHOⅣ级),分子病理学检查未见染色体1p和19q缺失,检测到O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子未甲基化。术后3天神经系统检查:神志清楚,查体合作,双侧瞳孔等大、等圆,直径约3 mm,直接及间接对光反射灵敏,四肢可遵嘱活动,右侧肢体肌力约5级、左上肢约3级、左下肢约4级,肌张力稍增高,生理反射存在,病理征未引出。Karnofsky功能状态评分(KPS)为60。术后1个月复查MRI未见明显肿瘤残留(图1b)。随后辅以Stupp方案(即同步放化疗+巩固化疗),计划靶区/临床靶区(PTV/CTV)为1.80 Gy/次、28次,共50 Gy,肿瘤靶区(GTV)1.90 Gy/次、28次,共54 Gy,每周5次,共6周,同时予以服用替莫唑胺120 mg/d连续42天;同步放化疗结束后,继续5-28方案规律辅助替莫唑胺化疗,即予以服用替莫唑胺240 mg/d连续5天为一疗程,间隔28天,共12个疗程。此后每3~6个月定期随访并复查头部MRI。随访至2019年11月(2个月前),患者再次出现头晕、记忆力减退,自诉近期记忆减退,再次至我院门诊就诊。门诊体格检查未见明显记忆力减退症状,但有轻度头晕,无天旋地转感,双下肢轻度乏力,肌力约4级,行走不稳,需搀扶。头部MRI显示,双侧基底节区、丘脑及中脑异常混杂信号影(图1c),较前为新发,考虑复发性胶质母细胞瘤可能。结合患者病情及胶质母细胞瘤诊疗规范,经与患者及其家属沟通后,采用替莫唑胺+贝伐单抗+肿瘤电场治疗(TTFields)方案,于2020年1月7日开始服用替莫唑胺160 mg/d连续21天为一疗程,间隔7天;于2020年1月10日开始静脉注射贝伐单抗,首次剂量为7.50 mg/kg,维持剂量10 mg/kg,每2周1次;于2020年1月20日开始联合肿瘤电场治疗,治疗参数:电压220 V、频率200 k Hz、波长1500 m,治疗时间平均16 h/d。治疗2个月后(2020年3月28日)复查头部MRI,显示双侧基底节区、丘脑及中脑异常混杂信号影,部分病灶及囊腔较前稍缩小,增强扫描病灶呈结节状和环形强化(图1d,1e),达到神经肿瘤反应评价(RANO)的疾病稳定(SD)标准。患者自诉头晕及记忆力减退症状稍好转,但仍有肢体乏力。继续接受替莫唑胺+贝伐单抗+肿瘤电场治疗,门诊随访神经功能及生存状况无明显恶化,头晕及记忆力减退等症状基本改善,仍有肢体乏力。治疗6个月后(2020年7月29日)末次复查MRI显示肿瘤无明显进展(图1f)。继续上述方案治疗,截至2020年9月27日,患者因伴发严重肺部感染,抗感染效果欠佳,呼吸衰竭死亡。
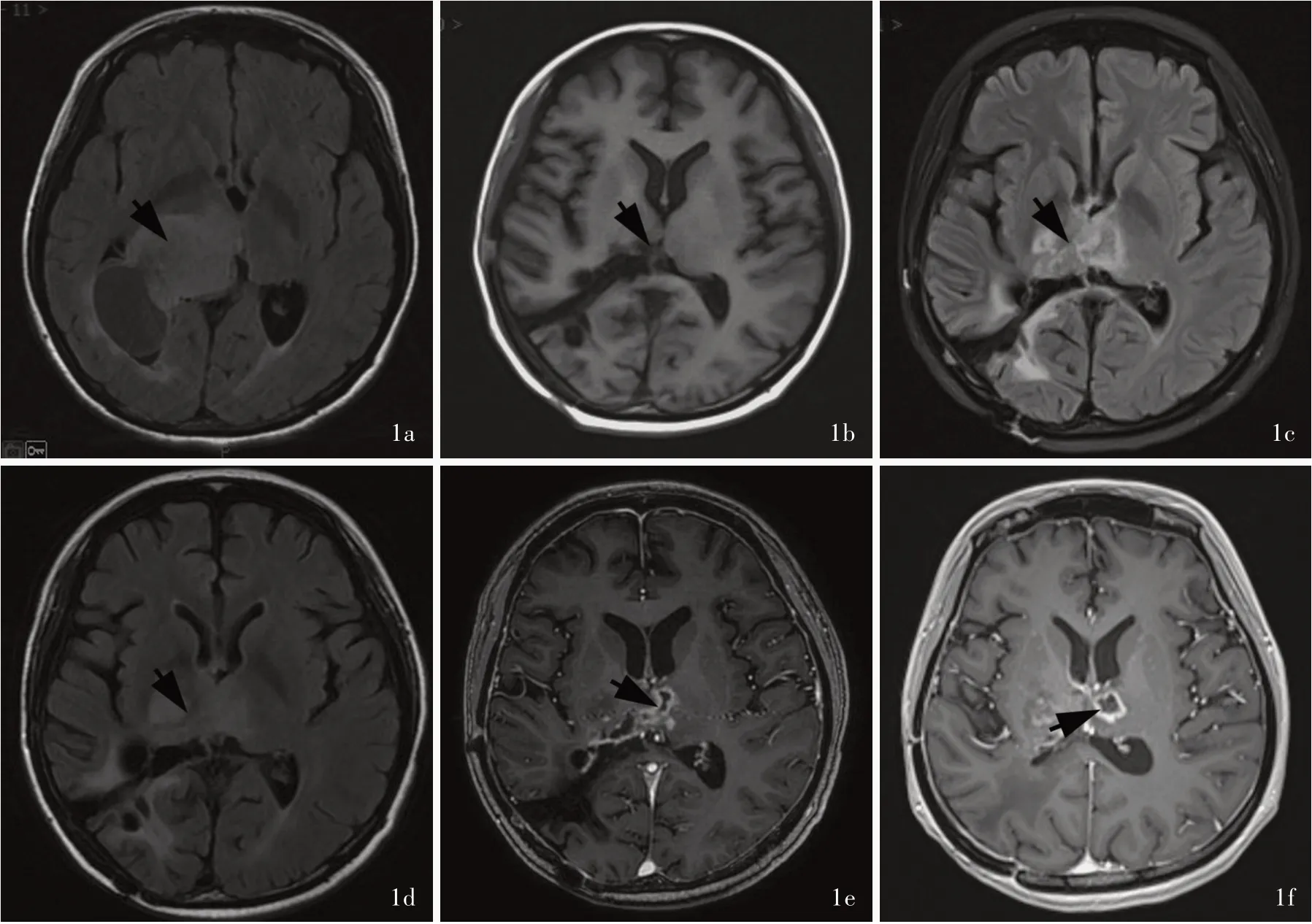
图1 头部MRI检查所见 1a 横断面T2-FLAIR成像(2015年12月8日)显示,右背侧丘脑及侧脑室三角区囊实性占位性病变(箭头所示),考虑胶质瘤 1b 术后1个月(2016年1月15日)复查横断面T1WI未见明显肿瘤残留(箭头所示) 1c术后4年(2020年1月6日)横断面抑脂T2-FLAIR成像显示,双侧基底节区、丘脑及中脑异常稍低信号影(箭头所示),考虑为肿瘤复发 1d 替莫唑胺+贝伐单抗+肿瘤电场治疗2个月后(2020年3月28日),横断面T2-FLAIR成像显示,双侧基底节区、丘脑及中脑异常稍低信号影,部分病灶及囊腔较前稍缩小(箭头所示) 1e 替莫唑胺+贝伐单抗+肿瘤电场治疗2个月后(2020年3月28日),横断面增强T1WI显示,双侧基底节区、丘脑及中脑病灶呈结节状和环形强化(箭头所示)1f 替莫唑胺+贝伐单抗+肿瘤电场治疗6个月后(2020年7月29日),横断面增强T1WI显示,双侧基底节区、丘脑及中脑病灶呈结节状和环形强化(箭头所示),病灶较2020年3月28日无明显增大Figur e 1 Head MRI findings Axial T2-FLAIR(2015-12-08)showed a cystic solid mass in the right dorsal thalamus area and the lateral ventricle triangle area(arrow indicates),which was considered as glioma(Panel 1a).One month after surgery(2016-01-15),axial T1WI showed no obvious tumor residue in the primary lesion area(arrow indicates,Panel 1b).Four years after surgery(2020-01-06),axial T2-FLAIR with fat saturation showed an abnormal mixed-signal shadow in bilateral basal ganglia-thalamus and midbrain(arrow indicates),suggesting tumor recurrence(Panel 1c).Two months after treatment(2020-03-28),axial T2-FLAIR showed mixed-signal in bilateral basal ganglia-thalamus and midbrain,and some lesions and lumens were slightly smaller than before(arrow indicates,Panel 1d).Axial enhanced T1WI 2 months after treatment(2020-03-28)showed abnormal mixed-signal shadows in the bilateral basal ganglia thalamic area and midbrain,and showed nodular and annular enhancement(arrow indicates,Panel 1e).Axial enhanced T1WI 6 months after treatment(2020-07-29)showed abnormal mixedsignal shadows in bilateral basal ganglia thalamus and midbrain,and showed nodular and annular enhancement(arrow indicates),which showed no significant changes in lesions compared with those examined on March 28,2020(Panel 1f).
讨 论
肿瘤电场治疗作为一种全新的肿瘤治疗方式,其原理是利用特定频率(100~300 k Hz)的交变电场干扰肿瘤细胞的有丝分裂,抑制肿瘤生长,同时破坏正常细胞结构,杀伤肿瘤细胞,从而达到延长患者生存期之目的[1-2]。本文患者在首次诊断为胶质母细胞瘤后,接受标准化Stupp方案,同步放化疗结束后再以5-28方案规律辅助替莫唑胺巩固化疗,治疗后46个月均保持病情稳定,第47个月(2019年11月)肿瘤复发,复发后早期接受替莫唑胺+贝伐单抗+肿瘤电场治疗的三联疗法,肿瘤控制较理想,截至2020年7月,肿瘤复发后的无进展生存期(PFS)达6个月。肿瘤电场治疗联合其他方法治疗复发性胶质母细胞瘤的疗效尚待前瞻性随机对照试验的验证。
研究显示,复发性胶质母细胞瘤患者经单纯肿瘤电场治疗或最佳药物化疗后,无进展生存期和总生存期(OS)无明显差异[3]。但相较于放化疗,肿瘤电场治疗的安全性有明显优势,且不增加替莫唑胺的全身不良反应[4],且单纯肿瘤电场治疗组的安全性明显优于化疗组[3]。一项全球范围的回顾性研究纳入11 029例行肿瘤电场治疗的高级别胶质瘤患者,发现电极片下方皮肤刺激是其主要不良反应(34%),且多为1~2级,无需终止治疗[5]。另一项研究比较复发性胶质瘤患者单纯肿瘤电场治疗与化疗联合肿瘤电场治疗的疗效,发现化疗联合肿瘤电场治疗的患者中位总生存期更长[6]。Stupp等[4,7]认为,替莫唑胺联合肿瘤电场治疗的收益均高于单纯肿瘤电场治疗或者单纯化疗。上述研究表明肿瘤电场治疗联合其他治疗方法的有效性和安全性均较高。
肿瘤电场治疗对于复发性胶质母细胞瘤患者的疗效与药物化疗相当,基于其良好的安全性,肿瘤电场治疗联合化疗和靶向治疗等已列入《中国脑胶质瘤临床管理指南(2020)》,因此认为,肿瘤电场治疗联合其他治疗方法有可能成为复发性胶质母细胞瘤的新治疗策略,尚待大规模前瞻性随机对照试验的确切证据。
利益冲突无
