Aβ1~42诱导KATP亚基SUR1/Kir6.2蛋白表达的信号转导通路研究
2021-04-12李艳菊张戈王晓静邢孝民马国诏
李艳菊 张戈 王晓静 邢孝民 马国诏
阿尔茨海默病是老年人最常见的神经变性病,典型病理改变为β-淀粉样蛋白(Aβ)沉积[1]。大量证据表明,Aβ可以导致细胞膜去极化、线粒体功能障碍和氧化应激反应,上述变化反过来进一步刺激Aβ的生成和沉积[2-3]。线粒体ATP敏感性钾离子通道(KATP)的开放可以保护神经元免受Aβ的细胞毒性作用[4]。KATP广泛表达于不同脑区,其亚基决定不同脑区对缺氧、氧化应激、神经毒性和血糖代谢等的耐受性不同[5]。Aβ1~42和ATP可以上调KATP亚基SUR1/Kir6.2蛋白的表达[4-6]。业已证实,信号转导通路与阿尔茨海默病的发病机制有关,目前已知核 因 子-κB(NF-κB)、p38丝裂原激 活 蛋 白 激 酶(MAPK)和蛋白激酶C(PKC)信号转导通路与阿尔茨海默病的病理生理学机制密切相关,如NF-κB信号转导通路在阿尔茨海默病患者中表达增强[7];阿尔茨海默病患者脑组织p38 MAPK磷酸化水平升高,与Aβ斑块和神经原纤维缠结(NFTs)有关[8-9];Aβ寡聚体还可以破坏PKC信号转导通路[10]等。进一步研究信号转导通路对Aβ1~42上调KATP亚基SUR1/Kir6.2蛋白表达的影响,可以为通过信号转导通路靶向治疗阿尔茨海默病提供理论依据[11]。基于此,本研究旨在探讨NF-κB、p38 MAPK和PKC信号转导通路在原代培养的大鼠皮质和海马神经元Aβ1~42上调KATP亚基SUR1/Kir6.2蛋白表达中的作用,以期为上述信号转导通路对神经元的作用提供新思路,同时也为研究防治阿尔茨海默病药物提供新视角。
材料与方法
一、实验材料
1.实验动物 出生24 h内的Wistar种系新生大鼠200只,雌雄不限,由山东大学实验动物中心提供(许可证号:SCXK鲁20090001),控制温度(21℃)、光照(12 h昼-12 h夜)和相对湿度(50%~60%)。
2.设备与仪器 (1)主要药品与试剂:Aβ1~42人工重组蛋白(规格0.10 mg)、SN50(规格1 mg)、SB203580(规格1 mg)、多聚赖氨酸(规格10 mg)、白屈菜红碱(CTC,规格5 mg)均购自美国Sigma公司,Neurobasal培养基、胎牛血清(FBS,规格500 ml)均系美国Gibco公司产品,B27细胞培养添加剂(规格10 ml)购自美国Invitrogen公司,DMEM高糖培养基(规格500 ml)购自美国HyClone公司,链霉抗生物素蛋白-生物素-过氧化物酶复合物(SABC)免疫组化检测试剂盒、二氨基联苯胺(DAB)显色试剂盒均系武汉博士德生物工程有限公司产品,Ⅰ抗工作液包括山羊抗大鼠胆碱乙酰转移酶(ChAT)抗体(规格0.10 ml,滴度1∶100)、兔抗大鼠Kir6.2多克隆抗体(规格0.10 ml,滴度1∶500)和兔抗大鼠SUR1多克隆抗体(规格0.10 ml,滴度1∶500),以及内参照物甘油醛-3-磷酸脱氢酶(GAPDH)购自美国Santa Cruz公司,辣根过氧化物酶(HRP)标记的山羊抗兔IgGⅡ抗(规格0.10 ml,滴度1∶500)、生物素标记的兔抗山羊IgGⅡ抗(规格0.10 ml,滴度1∶200)购自北京中杉金桥生物技术有限公司,MgCl2、CaCl2、KCl、NaHCO3、Na2HPO4·12H2O(均为分析纯)固体粉末样试剂为天津市广成化学试剂有限公司产品,NaCl、KH2PO4(均为分析纯)固体粉末样试剂购自国药集团化学试剂有限公司,二辛可宁酸(BCA)检测试剂盒购自上海博彩生物科技有限公司,放射免疫沉淀法(RIPA)裂解液、苯甲基磺酰氟(PMSF;规格1 ml,浓度100 mmol/L)购自上海碧云天生物技术有限公司,电化学发光(ECL)发光液购自美国Millpore公司。(2)主要设备与仪器:光学显微镜(IM50)为德国Leica公司产品,CO2培养箱为日本SUNYO株式会社产品。
二、研究方法
1.原代神经细胞培养 将新生大鼠从培养环境取出,于实验室无菌条件下,头颈部消毒,以无菌剪刀在其枕下颈部行一倒“T”字口按皮肤、颅骨逐层剪开,剥除脑膜后分离出皮质、海马。75%乙醇溶液消毒后,在无菌条件下用显微镊分离大脑皮质和海马,D-Hanks溶液清洗,制备1 mm×1 mm×1 mm脑组织切片,以0.125%胰蛋白酶消化10 min,终止消化后采用300目不锈钢网过滤;过滤液离心,以离心半径5 cm、转速1000 r/m离心5 min,获得原代神经细胞,以细胞密度为3×106/ml种植于多聚赖氨酸包被的60 mm培养皿(37℃培养箱,95%空气和5%CO2)中,24 h后更换培养基(98%Neurobasal培养基+2%B27+1%青霉素和链霉素)。以5μmol/L阿糖胞苷处理细胞,抑制神经胶质细胞增殖,培养3~5 d后显微镜下观察到存活细胞即为原代神经细胞培养成功。
2.免疫细胞化学法鉴定胆碱能神经元 爬片生长的神经细胞培养至第7天,磷酸盐缓冲液(PBS)冲洗5 min×3次,4%多聚甲醛于4℃固定30 min,磷酸盐缓冲液浸泡35 min,滴加山羊抗大鼠ChATⅠ抗(1∶100),4℃过夜,于室温孵育30 min,磷酸盐缓冲液洗涤;滴加兔抗山羊IgGⅡ抗(1∶200),37℃孵育1 h,磷酸盐缓冲液洗涤;滴加SABC,室温下20 min,后磷酸盐缓冲液洗涤5 min×4次,苏木精染色。光学显微镜下随机观察10个高倍视野(×400),胞质呈棕色的阳性神经元即为胆碱能神经元。
3.实验分组与Western blotting法检测蛋白相对表达量 严格无菌条件下将Aβ1~42人工重组蛋白0.10 mg溶解于0.50 mol/L二甲基亚砜(DMSO)溶液中,以磷酸盐缓冲液(pH值=7.4)稀释,即为Aβ1~42原液,置于37℃恒温箱内孵育72 h进行老化处理,4℃贮存备用,以培养细胞之前用血清稀释,细胞培养液中DMSO终浓度不超过0.10%(此浓度不会对细胞产生不利影响)。培养的神经元随机分为对照组、Aβ1~42组、SN50/SB203580/CTC+Aβ1~42组 和SN50/SB203580/CTC组,培养7 d。对照组采用等体积磷酸盐缓冲液和培养基培养;Aβ1~42组采用Aβ1~42(2μmol/L)[4]处理;SN50/SB203580/CTC+Aβ1~42组采用SN50(0.50μmol/L)或SB203580(2μmol/L)或CTC(2μmol/L)进行处理,并于30 min后加入Aβ1~42(2μmol/L);SN50/SB203580/CTC组分别采用SN50(0.50μmol/L)或者SB203580(2μmol/L)或者CTC(2μmol/L)处理,培养72 h后,收集细胞行Western blotting检测。以冰磷酸盐缓冲液洗掉培养液,按照RIPA裂解液-PMSF蛋白酶抑制剂体积比100∶1配制细胞裂解液,冰浴裂解细胞30 min,收集蛋白,于4℃、离心半径5 cm、10 000 r/min离心10 min,再以BCA法检测蛋白浓度。取40μg总蛋白上清液行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),经电泳转移至聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉封闭1 h,兔抗大鼠SUR1(1∶500)或兔抗大鼠Kir6.2(1∶500)Ⅰ抗4℃摇动封闭一夜。室温下以0.05%TBST溶液冲洗3次,并与辣根过氧化物酶标记的山羊抗兔IgGⅡ抗在稀释的TBST溶液(1∶3000)中培养1 h,冲洗。采用ECL发光液显色,以GAPDH作为内参照物,再采用NIH图像(1.34版)对染色后的目的蛋白光密度值(OD值,280 nm)进行分析。
4.统计分析方法 采用Graphpad Prism 8.3统计软件进行数据处理与分析。正态性检验采用Shapiro-Wilk检验,呈正态分布的计量资料以均数±标准差(±s)表示,采用单因素方差分析,两两比较行LSD-t检验。以P≤0.05为差异具有统计学意义。
结 果
ChAT免疫细胞化学法显示,呈棕色的阳性神经元为胆碱能神经元(图1),占全部培养细胞>90%。

图1 光学显微镜观察可见胞质呈棕色的胆碱能神经元(箭头所示) 苏木精染色 ×400Figure 1 Optical microscopy showed the brown cytoplasm of cholinergic neurons(arrow indicates). Hematoxylin staining ×400
不同处理组KATP亚基SUR1蛋白(P=0.000)和Kir6.2蛋白(P=0.000)相对表达量差异有统计学意义(表1),其中,SN50+Aβ1~42组和SN50组SUR1蛋白相对表达量均低于对照组(P=0.010,0.000)和Aβ1~42组(P=0.000,0.000),SN50组亦低于SN50+Aβ1~42组(P=0.012;表2,图2),表明NF-κB抑制剂SN50可降低Aβ1~42诱导的KATP亚基SUR1蛋白的表达;SN50+Aβ1~42组和SN50组Kir6.2蛋白相对表达量低于对照组(P=0.004,0.034)和Aβ1~42组(P=0.000,0.000),而SN50组与SN50+Aβ1~42组差异无统计学意义(P=0.441;表2,图3),表明NF-κB抑制剂SN50亦可降低Aβ1~42诱导的KATP亚基Kir6.2蛋白的表达。

图2 Western blotting法显示,SN50+Aβ1~42组和SN50组SUR1蛋白相对表达量低于对照组和Aβ1~42组,SN50组亦低于SN50+Aβ1~42组Figure 2 Western blotting showed the expression of KATP subunit SUR1 in SN50+Aβ1-42 group and SN50 group was lower than that in control group and Aβ1-42 group,and the expression of SUR1 protein in SN50 group was lower than that in SN50+Aβ1-42 group.

图3 Western blotting法显示,SN50+Aβ1~42组和SN50组Kir6.2蛋白相对表达量低于对照组和Aβ1~42组,而SN50组与SN50+Aβ1-42组无明显差异Figure 3 Western blotting showed the expression of KATP subunit Kir6.2 in SN50+Aβ1-42 group and SN50 group was lower than that in control group and Aβ1-42 group,but there was no significant difference of Kir6.2 between SN50 group and SN50+Aβ1-42 group.
表1 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的比较(±s,×103)Table 1. Comparison of SUR1 and Kir6.2 proteins expression in different treatment groups(±s,×10 3)

表1 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的比较(±s,×103)Table 1. Comparison of SUR1 and Kir6.2 proteins expression in different treatment groups(±s,×10 3)
Aβ1-42,β-amyloid protein 1-42,β-淀粉样蛋白1~42
?

表2 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的两两比较Table 2. Pairwise comparison of SUR1 and Kir6.2 proteins expression in different treatment groups
不同处理组KATP亚基SUR1蛋白(P=0.000)和Kir6.2蛋白(P=0.000)相对表达量差异有统计学意义(表3),其中,SB203580+Aβ1~42组SUR1蛋白相对表达量仅低于Aβ1~42组(P=0.000),SB203580组SUR1蛋白相对表达量低于对照组(P=0.002)、Aβ1~42组(P=0.000)和Aβ1~42+SB2035800组(P=0.014;表4,图4),表明p38 MAPK抑制剂SB203580可以降低Aβ1~42诱导的KATP亚基SUR1蛋白的表达;SB203580+Aβ1~42组Kir6.2蛋白相对表达量低于Aβ1~42组(P=0.001),但高于对照组(P=0.003),SB203580组Kir6.2蛋白相对表达量低于对照组(P=0.003),Aβ1~42组(P=0.000)和SB203580+Aβ1~42组(P=0.000;表4,图5),表明p38 MAPK抑制剂SB203580可以影响Aβ1~42诱导的KATP亚基Kir6.2蛋白的表达。

图4 Western blotting法显示,SB203580+Aβ1~42组SUR1蛋白相对表达量仅低于Aβ1~42组,SB203580组SUR1蛋白相对表达量低于对照组、Aβ1~42组和SB2035800+Aβ1~42组Figure 4 Western blotting showed the expression of KATP subunit SUR1 in SB203580+Aβ1-42 group was lower than that in Aβ1-42 group,the expression of KATP subunit SUR1 protein in SB203580 group was lower than that in control group,Aβ1-42 group and SB203580+Aβ1-42 group.

图5 Western blotting法显示,SB203580+Aβ1~42组Kir6.2蛋白相对表达量低于Aβ1~42组,但高于对照组;SB203580组Kir6.2蛋白相对表达量低于对照组、Aβ1~42组和SB203580+Aβ1~42组Figur e 5 Western blotting showed expression of KATP subunit Kir6.2 protein in SB203580+Aβ1-42 group was lower than that in Aβ1-42 group,but higher than that in control group,while expression of KATP subunit Kir6.2 protein in SB203580 group was lower than that in control group,Aβ1-42 group and SB203580+Aβ1-42 group.
表3 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的比较(±s,×103)Table 3. Comparison of SUR1 and Kir6.2 proteins expression in different treatment groups(±s,×103)

表3 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的比较(±s,×103)Table 3. Comparison of SUR1 and Kir6.2 proteins expression in different treatment groups(±s,×103)
Aβ1-42,β-amyloid protein 1-42,β-淀粉样蛋白1~42
?

表4 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的两两比较Table 4. Pairwise comparison of SUR1 and Kir6.2 proteins expression in different treatment groups
不同处理组KATP亚基SUR1蛋白(P=0.000)和Kir6.2蛋白(P=0.000)相对表达量差异有统计学意义(表5),其中,CTC+Aβ1~42组SUR1蛋白相对表达量高于对照组(P=0.040),但低于Aβ1~42组(P=0.000),CTC组SUR1蛋白相对表达量低于对照组(P=0.000)、Aβ1~42组(P=0.000)和CTC+Aβ1~42组(P=0.000;表6,图6),表明PKC抑制剂CTC可以影响Aβ1~42诱导的KATP亚基SUR1蛋白的表达;CTC+Aβ1~42组Kir6.2蛋白相对表达量低于对照组(P=0.000)和Aβ1~42组(P=0.000),CTC组Kir6.2蛋白相对表达量低于对照组(P=0.001)和Aβ1~42组(P=0.000),但高于CTC+Aβ1~42组(P=0.018;表6,图7),表明PKC抑制剂CTC可以影响Aβ1~42诱导的KATP亚基Kir6.2蛋白的表达。
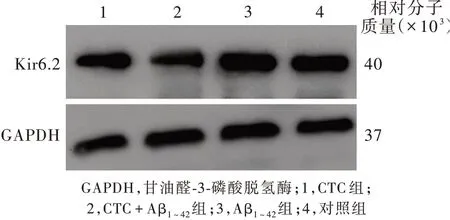
图7 Western blotting法显示,CTC+Aβ1~42组Kir6.2蛋白相对表达量低于对照组和Aβ1~42组;CTC组Kir6.2蛋白相对表达量低于对照组和Aβ1~42组,但高于CTC+Aβ1~42组Figur e 7 Western blotting showed the expression of KATP subunit Kir6.2 in CTC+Aβ1-42 group was lower than that in control group and Aβ1-42 group,while the expression of Kir6.2 protein in CTC group was lower than that in control group,Aβ1-42 group,but higher than that in CTC+Aβ1-42 group.

表6 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的两两比较Table 6. Pairwise comparison of SUR1 and Kir6.2 proteins expression in different treatment groups

图6 Western blotting法显示,CTC+Aβ1~42组SUR1蛋白相对表达量高于对照组,但低于Aβ1~42组;CTC组SUR1蛋白相对表达量低于对照组、Aβ1~42组和CTC+Aβ1~42组Figure 6 Western blotting showed the expression of KATP subunit SUR1 in CTC+Aβ1-42 group was higher than in control group,but lower than that in Aβ1-42 group,while the expression of KATP subunit SUR1 in CTC group was lower than that in control group,Aβ1-42 group and CTC+Aβ1-42 group.
表5 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的比较(±s,×103)Table 5. Comparison of SUR1 and Kir6.2 proteins expression in different treatment groups(±s,×103)

表5 不同处理组SUR1蛋白和Kir6.2蛋白相对表达量的比较(±s,×103)Table 5. Comparison of SUR1 and Kir6.2 proteins expression in different treatment groups(±s,×103)
Aβ1-42,β-amyloid protein 1-42,β-淀粉样蛋白1~42
?
讨 论
Aβ诱导的神经毒性作用在阿尔茨海默病发病机制中发挥关键作用[12]。有研究显示,过度氧化应激反应和自由基毒性作用是阿尔茨海默病的发生机制之一[13]。Aβ可以诱发过度氧化应激反应,后者打破自由基产生与消除的动态平衡,加速细胞凋亡[14]。β修饰细胞膜脂质和蛋白质氧化,增加活性氧(ROS),降低线粒体功能和ATP酶活性,其可导致细胞能量代谢以及膜电位失调,降低细胞活性[15]。此外,环孢素A、促红细胞生成素以及ATP敏感的钾离子通道开放剂可能对β诱导的神经毒性具有保护作用[16-17]。
KATP是一种多蛋白复合物,由Kir6.1/Kir6.2和SUR1/SUR2不同亚基组成,形成1∶1异质八聚体。KATP可通过降低心肌细胞、神经元和其他可兴奋细胞的兴奋性,在细胞膜中发挥重要作用。在线粒体中,KATP参与线粒体膜电位的调节,并调节ATP和活性氧的生成[18]。针对原代培养大鼠胆碱能神经元的研究发现,不同时间段(实验24、48和72小时)Aβ1~42可诱导KATP亚基表达的差异性增加,同时抑制KATP电流。而二氮嗪预激活线粒体KATP可逆转上述变化[19];此外,亦有研究显示,暴露于Aβ1~4224小时不影响KATP亚基SUR1/Kir6.2蛋白的表达[5,20]。
本研究结果显示,与对照组相比较,Aβ1~42诱导72小时可显著增加原代培养神经元中KATP亚基SUR1/Kir6.2蛋白的表达,可能是由于Aβ1~42引起的氧化应激反应持续存在,可导致线粒体功能障碍、细胞代谢紊乱、细胞内ATP下降;鉴于KATP亚基SUR1/Kir6.2对ATP较为敏感[6],随着细胞内ATP下降,KATP亚基SUR1/Kir6.2蛋白表达量显著升高。此外,Aβ1~42可通过非特异性信号转导通路激活神经胶质细胞,进一步刺激KATP亚基SUR1/Kir6.2蛋白表达而诱导神经炎症反应。KATP亚基SUR1/Kir6.2的活化和表达升高,可能是防止Aβ1~42细胞毒性破坏正常细胞膜电位和自发电活性而产生的生理反应。
NF-κB是一种普遍存在的核转录因子。活化的NF-κB通过调节基因表达、免疫反应和细胞凋亡信号转导通路转移至细胞核中,从而参与疾病的病理生理学过程[21]。有证据证明,阿尔茨海默病患者神经元内NF-κB活性显著升高[8,22]。Mattson等[23]通过诱导锰超氧化物歧化酶(MnSOD)抑制过氧亚硝基阴离子生成和膜脂质过氧化,以探讨NF-κB抗凋亡机制。NF-κB抑制剂SN50是包含41个氨基酸残基的肽类,SN50含有穿透细胞的P50核定位序列,可特异性地阻止NF-κB从细胞质转移至细胞核,从而抑制NF-κB的DNA结合活性。本研究SN50+Aβ1~42组KATP亚基SUR1/Kir6.2蛋白相对表达量低于Aβ1~42组,表明SN50可以降低Aβ1~42诱导的KATP亚基Kir6.2/SUR1蛋白的表达。推测其原因,可能是由于SN50通过抑制NF-κB的核移位干扰其生成,从而抑制κB基序的激活以及Aβ1~42生成有关的基因转录,降低Aβ1~42的神经毒性作用,间接影响KATP亚基蛋白的表达。本研究结果显示,SN50组KATP亚基SUR1蛋白相对表达量低于对照组、Aβ1~42组,表明SN50对Aβ1~42诱导的KATP亚基SUR1蛋白表达增加的抑制作用是非特异性的;而SN50组与SN50+Aβ1~42组KATP亚基Kir6.2蛋白相对表达量差异无统计学意义,表明SN50对Aβ1~42诱导的KATP亚基Kir6.2蛋白表达增加的抑制作用具有特异性。因此推测,NF-κB信号转导通路部分参与KATP亚基SUR1/Kir6.2蛋白的表达。
MAPK是一类丝氨酸/苏氨酸激酶,参与细胞外信号如生长因子、有丝分裂原和应激细胞的增殖、分化和细胞存活,而在哺乳动物中p38 MAPK即为MAPKs的成员之一[24]。正常情况下,p38 MAPK位于细胞质内,一旦激活迅速转入细胞核,激活活化转录因子,后者与顺式作用元件结合,引起凋亡相关基因大量表达,与细胞延迟性死亡关系密切[25],p38主要依靠促炎性因子、应激刺激等激活,此外,还可被脂多糖及革兰阳性菌细胞壁成分激活[26-27]。研究表明,Aβ可以刺激培养的细胞激活p38 MAPK和MAPK激活的蛋白激酶-2(MAPKAP-2),从而上调炎性因子如白细胞介素-1(IL-1)/肿瘤坏死因子-α(TNF-α)的产生[28-30]。在人类阿尔茨海默病脑组织和转基因小鼠模型中,激活的p38 MAPK主要定位于神经元纤维缠结、Aβ斑块和神经胶质细胞中[9]。在神经变性病中,Aβ过度刺激可导致炎性介质释放增加,导致周围神经炎症和神经毒性作用[31]及神经元凋亡。SB203580是一种吡啶异咪哒唑化合物,是最常用的p38 MAPK特异性抑制剂,主要是作用于p38 MAPK上ATP结合活性位点T160[32],通过抑制p38 MAPK与ATP结合而使其失去激酶活性,从而抑制p38 MAPK信号转导通路。SB203580通过与p38 MAPK的ATP结合,较易抑制p38α和p38β的活性。虽然抑制p38 MAPK的自体磷酸化,但上游MAPK磷酸化能力并未受到影响。利用这种化学性质,SB203580已被用于鉴定培养细胞中p38 MAPK的自磷酸化[33-34]。本研究结果显示,与Aβ1~42组相比,SB203580+Aβ1~42组的KATP亚基SUR1/Kir6.2蛋白相对表达量均降低,表明SB203580可以显著降低Aβ1~42诱导的SUR1/Kir6.2蛋白的表达。分析其原因,可能是由于Aβ斑块引起其周围神经胶质细胞增生激活,释放炎性因子,激活p38 MAPK,p38 MAPK迅速转移至细胞核,激活转录因子,导致KATP亚基SUR1/Kir6.2 mRNA表达升高,表明活化的p38 MAPK不仅有促神经炎症作用,导致SUR1/Kir6.2 mRNA表达升高,而且对周围神经元也有神经毒性作用。而SB203580位于ATP结合位点,导致p38 MAPK失去与ATP结合的能力,不仅降低Aβ的细胞毒性作用,而且显著降低Aβ1~42诱导的SUR1/Kir6.2蛋白表达量。因此,p38 MAPK信号转导通路也参与Aβ1~42细胞毒性作用导致的KATP亚基SUR1/Kir6.2蛋白表达量的升高。在本研究中,SB203580组KATP亚基SUR1/Kir6.2蛋白表达均低于对照组、Aβ1~42组和SB203580+Aβ1~42组,表明SB203580对Aβ1~42诱导的Kir6.2蛋白表达升高的抑制作用是非特异性的,而SB203580+Aβ1~42组与对照组相比,SUR1蛋白相对表达量无明显差异,表明SB203580对Aβ1~42诱导的KATP亚基SUR1蛋白表达升高有特异性抑制作用。因此认为,p38 MAPK信号转导通路部分参与Aβ诱导的KATP亚基SUR1/Kir6.2蛋白的表达。
PKC是一类依赖磷脂的丝氨酸/苏氨酸激酶,至少由12种同工酶组成[35]。静息状态下,PKC以无活性形式存在于细胞质中[36],而应激状态下,PKC转移至细胞膜而被激活。研究表明,佛波醇-12-肉豆蔻酸酯-13-乙酸酯(phorbol-12-myristate-13-acetate)是一种非特异性PKC激活剂,可降低神经元Aβ水平[37]。PKC调节α-分泌酶,尤其是PKC的α同工酶和ε同工酶,PKC介导的α-分泌酶激活在阿尔茨海默病的治疗上具有3个有益结局:增加可溶性淀粉样前体蛋白α(sAPPα)产生,减少Aβ,通过PKC介导的下游底物磷酸化增强记忆力[38-39]。本研究采用CTC处理细胞后,与Aβ1~42组相比,CTC+Aβ1~42组KATP亚基SUR1/Kir6.2蛋白相对表达量均降低,表明CTC可以降低Aβ1~42诱导的SUR1/Kir6.2蛋白的表达。其可能机制是,PKC从细胞质到细胞膜的激活促进各种蛋白质磷酸化,包括离子通道蛋白的丝氨酸或苏氨酸残基,从而改变KATP通道蛋白的构象和门控动力学,升高KATP亚基SUR1/Kir6.2蛋白的表达。PKC抑制剂CTC抑制一系列蛋白磷酸化作用,从而降低KATP亚基蛋白的表达,以调节离子通道的开关。因此,PKC信号转导通路也参与神经元KATP亚基SUR1/Kir6.2蛋白表达的升高。本研究结果显示,与Aβ1~42组相比,CTC组KATP亚基SUR1/Kir6.2蛋白表达均降低,表明CTC对Aβ1~42诱导的KATP亚基表达的抑制作用是非特异性的;与CTC+Aβ1~42组相比,CTC组KATP亚基SUR1蛋白表达降低,而KATP亚基Kir6.2蛋白则相反,表明CTC对Aβ1~42诱导的Kir6.2蛋白表达的抑制作用是特异性的,提示PKC仅部分参与Aβ1~42诱导的KATP亚基蛋白的表达。
KATP在阿尔茨海默病中具有潜在的神经保护作用。我们的前期研究表明,原代培养的胆碱能神经元暴露于Aβ1~4272小时,导致KATP亚基表达的差异性增加。在本研究中,NF-κB、p38 MAPK和PKC信号转导通路均部分参与Aβ1~42诱导的KATP亚基SUR1/Kir6.2蛋白的表达,抑制上述信号转导通路可以降低神经元KATP亚基SUR1/Kir6.2蛋白的表达。表明NF-κB、p38 MAPK和PKC信号转导通路在Aβ1~42诱导的SUR1/Kir6.2蛋白的表达方面发挥关键作用,为下一步从信号转导通路方面研究防治阿尔茨海默病药物靶点提供新的理论视角。
利益冲突无
