镉和铜对海洋浮游植物的毒性效应及其机制研究进展
2021-04-11段美娜
段美娜,覃 亮,龙 婧,林 娜,赵 辉
(1.广东海洋大学 化学与环境学院//2.南方海洋科学与工程 广东省实验室(湛江)南海资源大数据中心,广东 湛江 524088)
重金属污染物一般是指Hg、Cd、Pb、Cr、Cu、Zn和类金属As等生物毒性显著的重金属[1]。重金属污染物难降解且难溶于水,但对生物体的脂肪组织具有较高亲和力,可以在生物体内富集并通过食物链逐级传递,进而危害人体健康[2]。近年来,随着我国海洋经济以及近岸城市化、工业化的发展,各种含重金属的工业废水、生活污水排入海洋,致使海洋环境中有毒重金属元素含量越来越高[3]。浮游植物是海洋生态系统的初级生产者,对海洋生态系统的能量流动、物质循环和信息传递等方面起着十分重要的作用[4]。同时,浮游植物是海洋重金属污染的第一层受体,也是最先受到重金属影响的海洋生物种群之一。因此全面了解重金属污染对海洋浮游植物的毒性效应及机制十分必要。
重金属的生物毒性因重金属种类[5]、元素存在形态[1]和浮游植物种类[6]而有所不同。重金属如Cd、Hg和As等,对浮游植物而言属于非必需元素,低浓度的此类重金属即具有生长发育毒性效应[7-11]。Cd是具有“三致性”危害(致癌、致畸、致突变)的有毒污染物之一,已被联合国组织确定为优先检测的环境污染物。人类活动诸如垃圾焚烧、金属和合金制造、电镀、采矿、冶炼和焊接工艺等将Cd释放到水环境中。Cd可以沿着海洋食物链传递、富集浓缩,最终进入人体,对人体内脏器官、血液循环系统和生殖系统等产生损伤。重金属如Cu、Zn和Mn等,是浮游植物维持正常生命活动所必需的微量元素[7],它们对浮游植物具有低剂量刺激、高剂量抑制的毒物兴奋效应,即当此类重金属的含量高出某一阈值时才会对浮游植物产生毒性影响[8-9]。Cu是一种常见的重金属,铜锌矿的开采和冶炼、金属加工、机械制造、钢铁生产等都是海洋环境中Cu污染的来源。据数据统计表明,我国近海河口环境Cu污染水平在过去几十年中呈逐渐上升趋势[2-3]。近海海域Cd和Cu污染问题已成为海洋生态学、环境科学和生态毒理学研究领域的热点。
海洋环境中渗透压、盐类和碳源与淡水环境相比具有巨大差异,因而海洋浮游植物应对环境胁迫的机制极有可能与淡水浮游植物不同。全面了解重金属对海洋浮游植物的毒性及其作用机制,对于预测生物群落变动趋势和改善海洋生态环境有十分重要的意义。
本研究通过分析非必需元素Cd和必需元素Cu对海洋浮游植物的毒性效应及机制,以期为今后开展重金属对海洋浮游植物毒害机理的深入研究提供依据。
1 Cd的毒性效应及机制
1.1 Cd的毒性效应
Cd的性质稳定且不易降解,易在生物体内蓄积,已有多篇文献报道Cd对海洋浮游植物的生理生化过程毒性效应[12],例如生长抑制效应[11,13-29]、光合器官的损伤效应[5,11,15,24-25,27,30]、氧化应激效 应[5,13-15,17-18,22,30]、色素降解效应[5,11,13-17,21]等 (表1)。
1.2 Cd的毒性作用机制
镉在海水中有多种存在形态,一般认为Cd2+对浮游植物具有较高的生物可利用性和毒性,因此后文主要以Cd2+为代表阐述其毒性作用机制。Cd2+对海洋浮游植物的毒性效应存在很大的种间和种内差异,但高浓度的Cd2+对绝大部分海洋浮游植物的生长发育均具抑制效应[11,13-29,34]。
1.2.1Cd对钙信使系统的影响 Ca2+作为细胞中最重要的第二信使,参与了细胞许多生理过程的信号转导。胞内Ca2+浓度的改变是Ca2+信使系统启动的中心环节。Cd2+离子半径与Ca2+相近,结构相似,Cd2+与Ca2+竞争性地利用Ca2+通道进入细胞 内[35-36],因此外界环境Cd2+浓度增加可能导致海洋浮游植物细胞对Ca2+的吸收量减少[11]。除此之外,Cd2+还可以通过自然抵抗力相关巨噬细胞蛋白、ATP结合盒转运蛋白等通道进入浮游植物细 胞[35-36]。

表1 重金属Cd对海洋浮游植物的毒性效应Table 1 The toxicological effects of heavy metals (cadmium) on marine phytoplankton

续表1(Continued)
细胞内Cd2+与Ca2+之间亦存在阳离子竞争效应:1)可以替代Ca2+与下游的Ca2+信号靶蛋白结合,进而影响细胞内一系列与Ca2+相关的信号转导过程[31];2)直接与Ca2+竞争性结合Ca2+-ATPase,导致Ca2+-ATPase活性降低,影响Ca2+的跨膜运输;3)在线粒体、质膜、微管、肌动蛋白等的Ca2+结合部位,直接竞争或取代Ca2+,使胞质中游离的Ca2+浓度增加。另外,Cd2+极易与线粒体膜上的巯基结合,导致线粒体内膜结构改变,膜通透性增加。大约80%的胞内Ca2+贮存在线粒体、内质网等钙库中,一旦线粒体等膜结构功能被Cd2+破坏,将导致胞质中Ca2+浓度的增加。胞内Ca2+浓度的大幅增加,将激活某些酶如内源性核酸内切酶,导致DNA的片段化[23],从而诱导细胞凋亡。
1.2.2Cd对光合作用损伤 海洋浮游植物的光合作用对Cd2+胁迫十分敏感。Cd2+对海洋浮游植物光合作用的毒性作用机理较为复杂,可能的途径包括5种:1)进入细胞的Cd2+可直接与叶绿素中的Mg2+发生替换,使叶绿素失去捕光功能,导致光合速率降低[5,11,13,15,24,27]。2)Cd2+具有高度的巯基亲和性,可以与含巯基的生物大分子特异性结合[24,26,34],抑制海洋浮游植物的叶绿素合成酶(如原叶绿素酸酯还原酶、δ-氨基-γ-酮戊酸脱水酶)活性,同时增强叶绿素酶的活性。叶绿素酶能够抑制原叶绿素酸酯还原酶复合物的合成。因而,Cd2+通过对叶绿素合成酶和叶绿素酶活性的影响,导致叶绿素降 解[5,11,13-17,21]。3)Cd2+可以作用于海洋浮游植物光系统电子传递链的许多位点,尤其是PSII电子供体侧的放氧复合体位点,抑制光反应过程中的电子传递[11,30],降低光合作用效率[5,11,13,15,24,27,30]。4)Cd2+能抑制碳同化过程中的关键酶活性[17]。碳酸酐酶是海洋浮游植物光合作用中的关键酶,可以加速HCO3-和CO2之间的转换,为光合作用中CO2固定的酶促反应提供反应底物。Cd2+可以替换碳酸酐酶活性中心的Zn2+,抑制碳酸酐酶的活性,进而干扰CO2固定过程。5)Cd2+可以破坏叶绿体结构,影响叶绿体的正常功能。对南极嗜冷单细胞藻(K.Antarctica)研究表明,Cd2+胁迫损伤了叶绿体超微结构,导致基粒片层消失、类囊体空泡、基粒堆叠混乱[11]。
1.2.3Cd诱导氧化胁迫 Cd2+进入海洋浮游植物细胞后,不仅影响光合作用,还会间接诱导ROS的生成,造成细胞的氧化损伤。ROS是生物体的正常代谢产物。海洋浮游植物体内存在抗氧化系统,包括抗氧化酶和抗氧化剂。抗氧化酶主要包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、过氧化氢酶(CAT)等,抗氧化剂主要包括还原型谷胱甘肽(GSH)、类胡萝卜素(Car)等。未受到环境胁迫时,在抗氧化系统作用下海洋浮游植物体内ROS维持在较低水平。在受到Cd2+胁迫时,海洋浮游植物细胞内通常会积累大量的 ROS[5,22],导致氧化胁迫。虽然Cd2+是非氧化还原性金属,无法通过Fenton和Haber-Weiss反应直接产生ROS,但Cd2+可以通过以下方式间接导致海洋浮游植物体内ROS含量的增加:1)置换蛋白质等生物大分子中的Fe或Cu等过渡性金属,引起细胞内游离的过渡性金属含量上升,过渡性金属可以通过Fenton和Haber-Weiss反应加速ROS的生成,从而加剧氧化胁迫。2)Cd2+可以抑制线粒体和叶绿体的电子传递[30],并导致线粒体和叶绿体等细胞器的结构性损伤[11],使光呼吸功能紊乱,导致ROS的产生。3)Cd2+引起抗氧化系统功能的失调,如抑制抗氧化酶的活性[13-14,17,22]或对抗氧化剂的消 耗[14,15,30]等,导致氧化胁迫。氧化胁迫可以引起膜组分中脂质的过氧化[13-15,17,22],其直接的结果是膜不饱和脂肪酸减少、膜脂的流动性降低、膜功能异常,引起细胞透明性病变、纤维化,导致细胞裂 解[11,28]。
高浓度的ROS会导致氧化损伤,而低浓度的ROS可作为信号分子诱导浮游植物细胞的程序性死亡。H2O2呈电中性并且能够通过细胞膜,存在时间较长,常被看作ROS中的最佳信号分子。对绿藻(Chlorella saccharophila和Micrasterias)[37-38]和甲藻(Peridinium gatunense)[39]的研究表明,在环境胁迫下H2O2作为主要的ROS信号分子,诱导了caspase-3-like酶活性上升,从而介导了细胞的类程序性死亡的发生。
2 Cu的毒性效应及机制
2.1 Cu的毒性效应
Cu是海洋浮游植物生长必需的微量元素,是呼吸作用和光合作用中多种酶的辅助因子。但过量的Cu对海洋浮游植物的毒性很大,会影响浮游植物的光合作用[5,27,40-46]、色素含量[5,40,42,45,47-48]、脂肪酸代谢[27]、碳水化合物合成[42,47,49]、ATP生成[42,49]、蛋白质合成[23,33,42,44,47-50]、基因表达[5,33,42,44,46]等多种生理生化过程。Cu对海洋浮游植物的毒性效应因受试物种不同而有所差异(表2)。
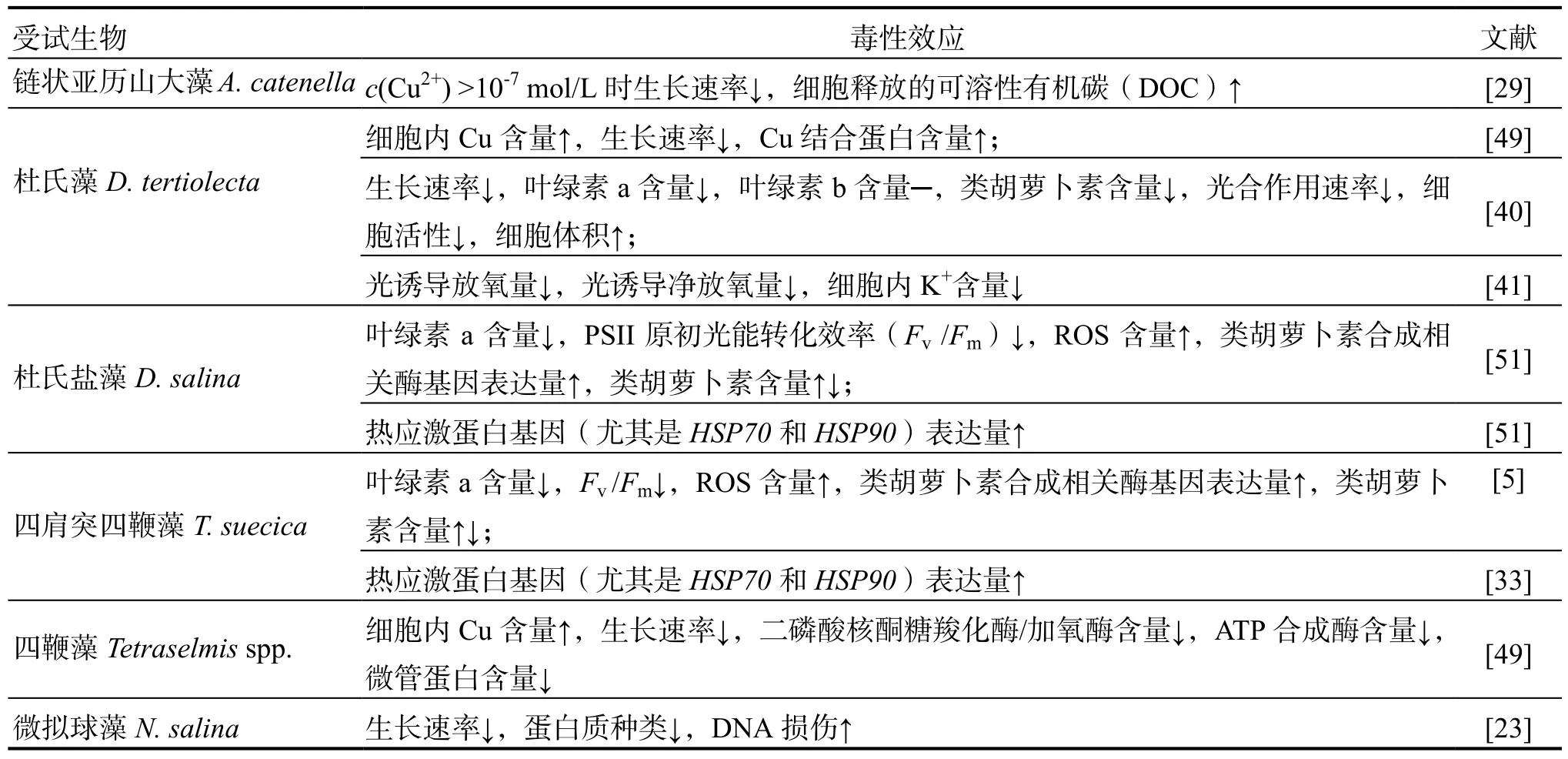
表2 重金属Cu对海洋浮游植物的毒性效应Table 2 The toxicological effects of heavy metals (copper) on marine phytoplankton

续表2(Continued)
2.2 Cu的毒性机制
Cu2+水溶性很高,在自然水体中极易迁移,一直是海洋环境研究中一个不容忽视的问题,因此后文对铜毒性机制的讨论主要以Cu2+为代表。
Cu对海洋浮游植物的毒性作用机制大致可以概括为:1)Cu2+与氨基酸的羧基、羟基、氨基、巯基具有高度亲和性[49],Cu2+与这些基团的结合会使蛋白质失去活性[42,48-50],干扰生理生化过程。2)Cu属于过渡性金属,可以与细胞内的脱氧剂反应生成Cu+,Cu+是Fenton和Haber-Weiss反应的催化剂,直接加速细胞内ROS的生成[56],诱导氧化胁迫。3)Cu2+和Cu+都可以与其他结合在特定位点的必需金属离子发生替换,对海洋浮游植物的生长发育产生毒性效应。
2.2.1Cu与高度亲和性基团结合 海洋浮游植物细胞壁和细胞膜上存在丰富的多糖类、蛋白质、脂质类物质,Cu2+具有较强的极化性,极易与这些物质的羧基、羟基、氨基、巯基等官能团结合。海洋环境中Cu2+浓度增大时,首先被吸附到浮游植物细胞壁上[54],当超出细胞壁容纳能力之后,过量的Cu2+通过细胞膜进入细胞,从而产生细胞毒性[54]。海洋浮游植物细胞的膜结构由于具有丰富的不饱和脂肪酸和蛋白质,因而成为Cu2+优先攻击的部位之一。Cu2+可与膜蛋白的官能团(如羧基、羟基、氨基等)或磷脂分子层的磷脂类物质结合,导致膜蛋白失去活性,影响膜的选择透过性[41]和流动性,进而影响各细胞器与细胞质之间、细胞与外界之间的信号传递和物质运输等生理过程,甚至会导致细胞膜破裂,细胞解体[40,42]。Cu2+还可以与细胞内含有巯基的分子如GSH[45]、植物螯合肽[50]结合。植物螯合肽主要功能是作为必需微量金属元素的缓冲剂,螯合并运输过量的重金属至液泡。植物螯合肽合成的前体是GSH,其合成将消耗GSH,导致GSH含量下降。三角褐指藻(P.triconut)在受到Cu2+胁迫时,细胞内的植物螯合肽含量增加,GSH含量略有下降[50]。GSH的消耗意味着生物体的抗氧化潜力降低,这对处于过渡性重金属(如Cu)胁迫下的海洋浮游植物影响极大。
2.2.2Cu诱导氧化胁迫 Cu是具有3种价态(0、+1、+2)的过渡金属元素,在生物体内可以直接催化H2O2反应生成ROS。对多种海洋浮游植物的研究表明,Cu2+胁迫可导致细胞内ROS含量增加,使抗氧化防御系统失衡,引起氧化损伤[5,42,45-48,51-52,54]。ROS攻击的主要目标之一是质膜和细胞器膜中的不饱和脂肪酸,引起膜脂过氧化[42,47-48,51-52,54],膜透性上升,导致细胞内K+大量外渗[41]。ROS还能够氧化蛋白质侧链中一些氨基酸的残基,被ROS氧化的变性蛋白质最终为蛋白水解酶降解。这可能是Cu2+胁迫下,杜氏盐藻D.salina[47]、四鞭藻Tetraselmisspp.[49]等细胞中蛋白质含量和种类减少的原因之一。此外,ROS可将DNA分子中的鸟嘌呤氧化,若此时DNA损伤修复失败,则进一步导致碱基由G变为T,发生DNA突变[23]。Cu2+能导致大量ROS产生,海洋浮游植物细胞中的抗氧化防御系统能在一定范围内清除ROS,保护细胞免受氧化胁迫。因而,在Cu2+胁迫下,海洋浮游植物细胞内的多种抗氧化酶(CAT、SOD等)活性及抗氧化剂(GSH等)含量发生变化[5,33,42,45-52,54]。
2.2.3Cu对光合作用的损伤 Cu胁迫对海洋浮游植物的光合作用的毒性作用机制是多方面的,可概括为:1)Cu2+可以替换叶绿素卟啉环中的Mg2+[9],生成铜代叶绿素,铜代叶绿素无法行使正常叶绿素的捕光功能,即有效叶绿素含量降低[5,40,42,45,47-48],导致海洋浮游植物的光合作用受到抑制。2)过量的Cu损伤叶绿体的膜系统[42],改变叶绿体或类囊体的结构。类囊体存在于叶绿体基质中,其膜上含有光合色素和电子传递链组分。Cu胁迫导致细胞叶绿体双层膜结构遭破坏,基粒堆叠结构解体,因而提供给暗反应的ATP和还原氢减少,直接导致光合速率降低。3)抑制光合作用相关的酶活性或降低其含量,影响光合速率。例如二磷酸核酮糖羧化酶,它催化卡尔文循环中最初固定CO2的反应。Cu胁迫可以抑制该酶的活性,并降低海洋浮游植物细胞内该酶的含量[42,49]。4)降低光系统的电子传递效率[43-44]。电子传递链中传递电子的载体脱氢酶绝大多数包含铁硫簇(Fe-S),由于Cu极化性比Fe强,因此相对Fe而言更加亲巯基,所以Cu竞争性与硫结合形成“Cu-S簇”,抑制脱氢酶活性,造成电子传递不畅,导致光合作用受到抑制[27,42-44,46,49]。同时,溢出的电子还会与氧结合形成ROS,造成细胞氧化损伤。
除此之外,过量的Cu进入细胞核内会与DNA的磷酸羟基或二硫键结合,诱发DNA之间、蛋白质之间以及DNA和蛋白质之间的分子内和分子间交联[23]。Cu胁迫还可能导致DNA甲基化异常,直接影响DNA的复制和转录水平,最终引起基因调控紊乱和蛋白质合成受抑制[5,23,42,44,47,49]。研究表明,在Cu的胁迫下四鞭藻Tetraselmissp.细胞内微管蛋白含量减少[49]。微管蛋白在浮游植物的生长和发育中起到维持细胞形态、促进细胞内运输、参与细胞运动及细胞分裂的作用。这可能是Cu胁迫抑制海洋浮游植物细胞生长速率的原因之一。
3 展望
近年来关于重金属污染对海洋浮游植物的毒性作用机制研究,主要以单种浮游植物为研究对象,测试指标以细胞生长速率、抗氧化酶活性、叶绿素荧光特性参数等生理生化水平指标为主。本研究表明海洋浮游植物对同一种污染物的响应具有物种差异性,而在自然海洋环境中往往是多种浮游植物和多种污染物共存。因此,在今后的研究中,笔者认为应该重点考察重金属元素对多种浮游植物共存时的毒性机理研究,这样结合实际情况才能为保护生态环境提供更大的帮助;加强重金属元素在海洋浮游植物亚细胞水平上的迁移、转运、积累的研究,基于高通量手段检测生物体在重金属胁迫下基因、蛋白质和代谢物等的全部信息变化,以便更全面系统地诠释重金属对海洋浮游植物的毒害机理。
