不同温度下马氏珠母贝干露耐受能力及其免疫相关基因表达的变化
2021-04-11魏雯璐张丞澍郝瑞娟廖永山王庆恒邓岳文
魏雯璐,刘 琪,张丞澍,郝瑞娟,廖永山,王庆恒,,3,邓岳文,,3
(1.广东海洋大学水产学院,广东 湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524000;3.广东省珍珠养殖与加工工程技术研究中心,广东 湛江 524088;4.广东海洋大学珍珠研究所,广东 湛江 524025)
干露胁迫是潮间带生物经常面临的环境应激因素之一,尽管经历长期选择进化后,生活在潮间带的双壳贝类有一定干露耐受能力,但不同物种或群体之间干露耐受能力仍存在较大差异。前人研究表明,耐干露能力强的群体在生长发育[1]、存活 率[1-3]和应激免疫[4-5]等方面表现出明显优势。如肖友翔等[2]指出,较大规格日本神海蛤稚贝(Panopea japonica)干露后存活率显著高于较小规格;于瑞海等[6]对不同生长阶段海湾扇贝(Argopecten irradians)干露实验也表明,成熟成贝对干露更为耐受,存活率高于对干露敏感的稚贝;Meng等[5]报道,经同时间干露后,对干露胁迫更为敏感的潮下带长牡蛎(Crassostrea gigas)存活率低于潮间带长牡蛎,且有较强代谢抑制,更早发生糖酵解代谢。可见,干露耐受能力可作为贝类重要的抗逆指标之一,应用于生产实践,在一定程度上提高生产性能。
马氏珠母贝(Pinctada fucata martensii),又名合浦珠母贝,是我国海水养殖珍珠生产的主要贝种之一[7-8],为附着性生活,运动能力差。在马氏珠母贝养殖过程中,体表常常附着大量污损生物和浮泥等,需要定期清理贝体体表的各类附着物,同时使贝体处于干露状态,从而引起贝体的应激反应。另外,在马氏珠母贝的植核手术和运输过程中,亦处于干露状态。广东海洋大学珍珠团队课题组在长期生产实践中发现,干露耐受能力强的珍珠贝植核后的存活率高于对干露敏感的珍珠贝。本研究利用马氏珠母贝黑壳色系构建干露敏感组及耐受组,分析两组的免疫基因表达差异及植核后休养期的存活率,探讨不同温度下马氏珠母贝的干露胁迫耐受能力,为马氏珠母贝的健康养殖和遗传育种提供基础资料。
1 材料与方法
1.1 实验材料
实验用贝为养殖于广东省雷州市后洪村海域的马氏珠母贝黑壳色系,选取鳞片生长旺盛、闭壳有力的成贝用于实验。马氏珠母贝室内暂养期间,每日投喂3次足量拟微绿球藻(Nannochloropsissp.),海水盐度为30,溶解氧大于5.0 mg/L。
1.2 实验设计与方法
1.2.1实验I:不同温度下马氏珠母贝的干露耐受能力 取2 400只马氏珠母贝,壳长为(53.75 ± 3.95)mm,清除体表附着物,在室内水泥池暂养3 d后,随机分为4个实验组,通过恒温器分别在(22 ± 1)、(26 ± 1)、(30 ± 1)和(34 ± 1)℃下进行干露胁迫。每个实验组设3个平行,每个平行200只贝。以双壳张开持续15 s为开口标准,以触碰外套膜后贝体反应迟缓不能完全闭壳为濒死标准,记录实验贝的开口及濒死情况。
1.2.2实验II:干露敏感组与耐受组免疫指标比较 取2 000只成贝(规格及暂养处理同实验I),在22 ℃下进行干露,发现贝开口后及时放回海水养殖池中进行恢复,以选择强度8%将最先开口的160只贝作为干露敏感组(S组);第1 840只开口后,剩余的160只为干露耐受组(T组),并将两组马氏珠母贝在水泥池中暂养7 d以恢复体质。暂养结束后,将S组和T组在22 ℃下再次干露胁迫,分别在干露前(0 h)、干露处理2 h和干露处理14 h的时候从S组和T组各随机剪取25个个体的鳃,经液氮速冻,用于提取总RNA,利用等量混合原则将每组25个个体的总RNA每5个混为一个样品用于后续实验。2 h和14 h分别是实验II获得的S组大量开口和濒死时间点。
将鳃组织样品利用Trizol法提取总RNA,1%的琼脂糖凝胶电泳检测RNA的完整性,Nano Drop ND 1000紫外分光光度计(Thermo公司)检测RNA的纯度及浓度。cDNA第一链的合成参照M-MLV 试剂盒说明书(TaKaRa公司)进行。
在马氏珠母贝转录组数据库基础上,用Primer Premier 5.0 软件,设计本实验所需引物(表1),检测脯氨酸羟化酶(PHD)、葡萄糖转运蛋白(GLUT)、髓样分化因子(MYD88)、热休克蛋白(Hsp70、Hsp20)和凋亡抑制因子(cIAP)基因的表达水平。
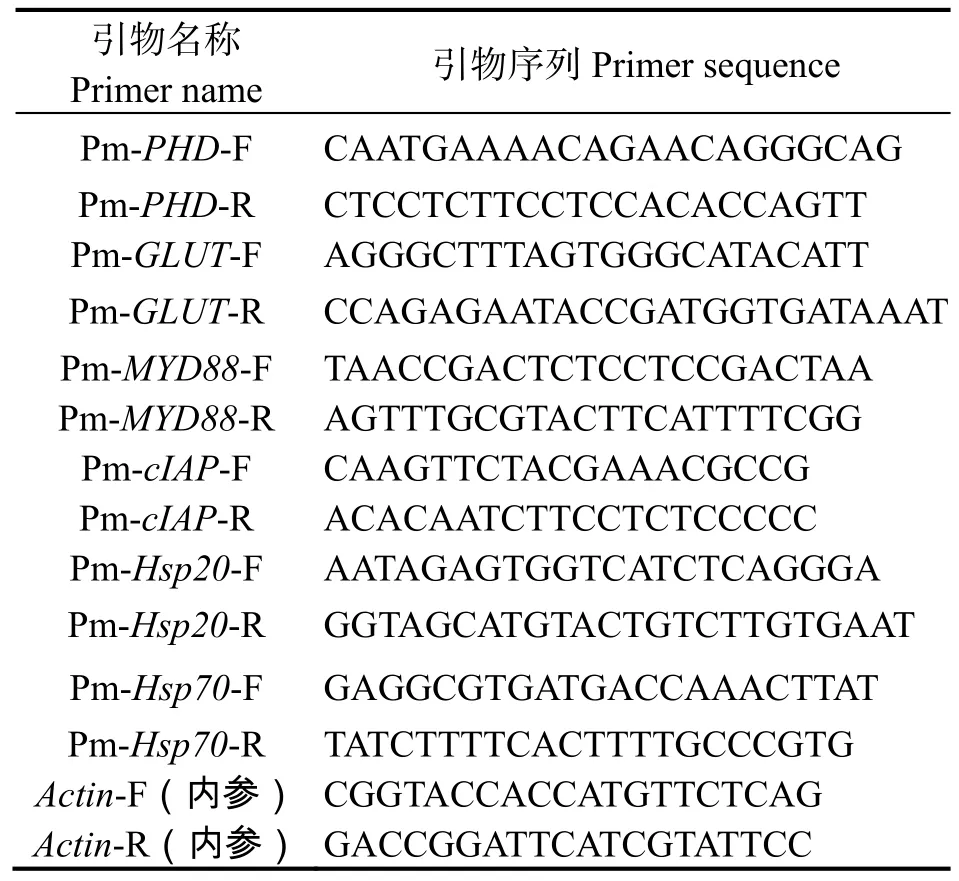
表1 引物序列Table 1 Primer sequences
相关基因表达采用qRT-PCR检测,qRT-PCR反应体系为0.4 μL cDNA,0.4 μL上游引物和0.4 μL下游引物和5 μL SYBR,总体积10 μL。反应条件为:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。通过观察每个反应后的解链曲线确认 PCR 产物的特异性。以 β-肌动蛋白为内参照建立各基因的标准曲线,验证基因表达的线性。使用delta CT 法[2Δ(Cтβ-actin-Cт目的基因)]计算相关基因在两组不同时间点的表达量,利用SPSS软件对相对表达量均值做显著性差异分析,显著性水平设定为α=0.05。
1.2.3实验III:干露敏感组与耐受组植核后休养期的存活率比较 2019年10月(秋季)和2020年4月(春季),分别取5 000只黑壳色系马氏珠母贝,秋季插核贝壳长为(61.54 ± 3.28)mm,春季插核贝壳长为(62.17 ± 4.05)mm,在室温下(约26 ℃)进行干露,以选择强度8%将最先开口的400只贝作为干露敏感组;第4 600只开口后,剩余的400只为干露耐受组,将两组珍珠贝转移到徐闻大井村海区暂养7 d后,剔除每组死亡个体,随机选择200只贝,由同一组技术员按照常规育珠技术插核,在海区养殖30 d后统计存活率。利用SPSS 19.0比较组间存活率差异,显著性水平设定为α=0.05。
2 结果
2.1 温度对马氏珠母贝干露耐受能力的影响
分别在22、26、30和34 ℃下进行干露胁迫,记录各组马氏珠母贝的时间—开口率的变化,如图1所示。4 h时,34 ℃组马氏珠母贝的开口率已达(82.36 ± 1.47)%,22、26和30 ℃组均低于45%,依次为(17.68 ± 0.97)%、(23.28 ± 1.98)%和(33.72 ± 6.04)%;12 h时,34 ℃组马氏珠母贝全部开口,26 ℃和30 ℃组也高达90%以上,分别为(93.80 ±2.27)%和(97.36 ± 1.84)%,然而22 ℃组的开口率仅为(52.39 ± 7.08)%;当干露时长达28 h时,22 ℃组才全部开口。
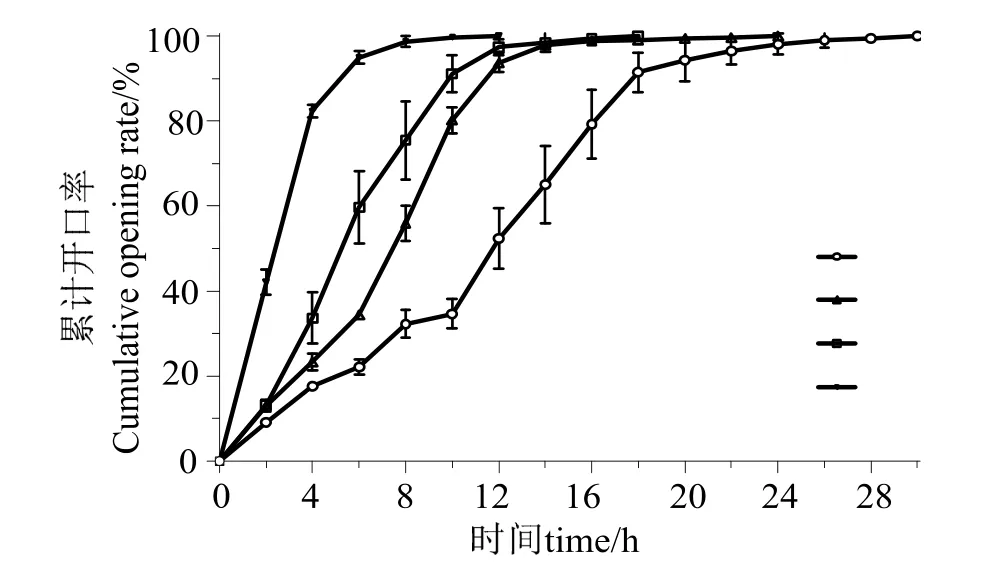
图1 不同温度干露胁迫下马氏珠母贝开口率的变化Fig.1 Changes of periodic opening rate under air exposure stress in experimental groups at different temperatures
如图2所示。12 h时,34 ℃组马氏珠母贝的累计濒死率为(51.01 ± 5.60)%,其余各组均低于15%,依次为(6.15 ± 1.66)%、(3.26 ± 0.25)%和(9.23 ± 1.66)%;20 h时,34 ℃组马氏珠母贝的累计濒死率为100%,30 ℃组也高达(84.90 ± 4.91)%,然而22 ℃和26 ℃组均低于30%,分别为(23.44 ± 5.29)%和(14.51 ± 7.24)%;44 h以后,22 ℃和26 ℃组的累计濒死率接近100%。
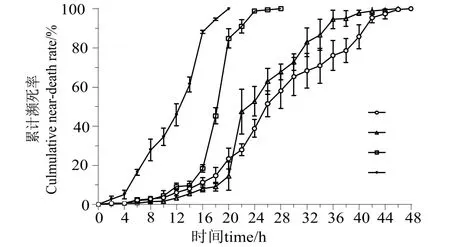
图2 不同温度干露胁迫下马氏珠母贝累积濒死率的变化Fig.2 Changes of cumulative near-death rate under air exposure stress in experimental groups at different temperatures
2.2 干露敏感组(S)与耐受组(T)免疫指标比较
2.2.1脯氨酸羟化酶(PHD)、葡萄糖转运蛋白(GLUT)表达差异 图3可知,两组PHD和GLUT表达总体呈上升趋势,而T组在2 hPHD表达量较0 h有一定下降,之后上升。且在0、2和14 h时,S组PHD和GLUT表达量高于T组;在14 h时,其中S组PHD和GLUT表达量显著升高于0、2 h时(P< 0.05),且14 h时显著高于T组(P< 0.05)。
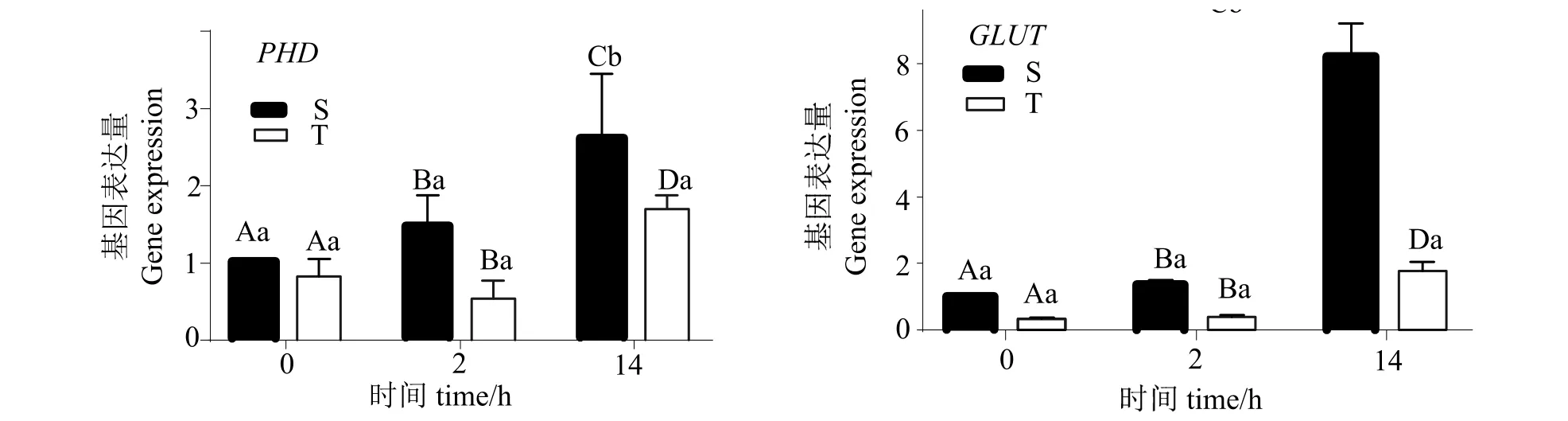
图3 S组及T组不同时间点PHD、GLUT表达量的变化Fig.3 Changes of PHDand GLUT expression in S and T groups at different time points
2.2.2髓样分化因子(MYD88)表达差异 由图4可知,随着干露时间延长,两组MYD88的表达量均表现上升趋势,S组的表达量在2 h和14 h显著升高(P< 0.05),T组在14 hMYD88表达量较其在0、2 h显著上升(P< 0.05)。
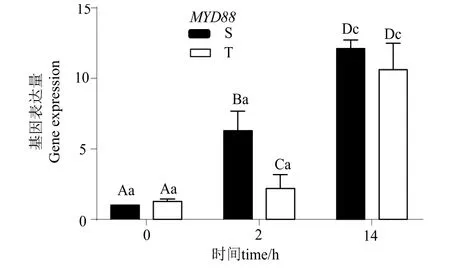
图4 S组及T组不同时间点MYD88表达量的变化Fig.4 Expression levels of MYD88 in S and T groups at different time points
2.2.3热休克蛋白(Hsp70和Hsp20)表达差异 图5可知,Hsp70和Hsp20表达随干露时间延长呈相同变化趋势,表现为上升趋势,且两组均在14 h相较于各组0、2 h时显著上升(P< 0.05),且T组Hsp20表达量在14 h时显著高于S组(P< 0.05)。
2.2.4凋亡抑制因子(cIAP)表达差异 图6可知,两组cIAP表达随干露时间延长呈现相同上升趋势,且在不同时间点S组表达量均高于T组,两组在14 h相较于各组的0、2 h表达显著上升(P< 0.05)。
2.3 干露育珠贝休养期存活率的影响
由表2可知,干露耐受组在春、秋季植核后珠休养期存活率均显著高于干露敏感组(P< 0.05)。

图5 S组及T组不同时间点Hsp70、Hsp20表达量的变化Fig.5 The expression levels of Hsp70 and Hsp20 in Groups S and T at different time points
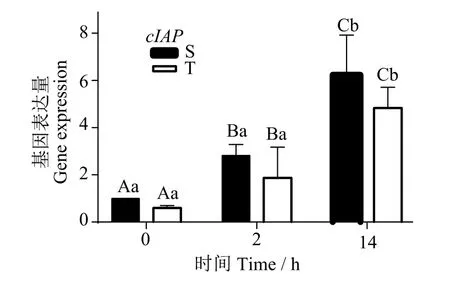
图6 S组及T组不同时间点cIAP表达量Fig.6 Expression levels of cIAP in Groups S and T at different time points

表2 干露对育珠贝休养期存活率的影响Table 2 Influence of exposed to air on survival during resting period of Pinctada fucata martensii%
3 讨论
温度是制约双壳贝类生长发育和干露耐受能力的主要因素之一,已有研究表明,夏季高温双壳贝类的死亡率显著升高[9]。干露时长也影响着双壳贝类的干露耐受能力,如对西施舌稚贝的研究[10]表明,短时间的干露对西施舌稚贝生长无不利影响,但时间过长则会导致死亡,且随温度提高死亡时间显著提前;刘毅等[11]对黑足鲍研究表明,黑足鲍的干露耐受能力随着温度升高而降低,随着干露时间的延长,黑足鲍代谢系统和免疫相关功能紊乱,严重影响其生存;孙遗阳等[12]对厚壳贻贝稚贝的研究表明,厚壳贻贝稚贝干露后存活率与干露时间呈显著负相关(P< 0.05),且低温时干露耐受能力是高温时的3倍以上;王文文[13]的研究表明蛤仔在25 ℃以下,干露48 h内存活率高于90%。本研究表明,不同温度下干露胁迫对马氏珠母贝影响较大,高温条件下贝体对干露耐受能力低,而在适宜温度下,贝体对干露的耐受力强,且干露耐受力随干露时间延长而下降,与上述学者研究结果一致。
生物系统密切监视环境条件的急性变化,启动调节反应,并使用负反馈回路来限制这些反应的程度。为适应慢性变化,许多环境传感器都能够调整其阈值,从而可以对现在不同的设定点的急剧偏差做出响应。细胞的一组酶直接控制由去稳定低氧诱导因子(HIF),以降低氧的细胞应答感测环境氧[14]。这些氧气感应酶包括脯氨酸-羟化酶(PHD),PHD是脯氨酸羟基化酶-低氧诱导因子氧感受体系相关基因[15]。在生物受到低氧胁迫时,PHD会根据氧浓度的变化迅速调控羟基化活性,启动低氧响应从而激活下游转录因子,包括糖酵解的相关基因[16-17],如葡萄糖转运蛋白(GLUT)。PHD在S组中的表达量都随着干露时间的延长而不同程度增加,在S组濒死的时候PHD的表达量显著增加,这可能意味着S组在干露应激情况下,此时机体内对氧气的调节已经出现较大紊乱,从而显著上调其表达以代偿,而T组则在干露下,PHD的表达量较为稳定增加,在此期间,T组可能在干露应激下,做出防御反应的同时也在调整着自身的氧气耐受阈值。本研究中,两组在干露后GLUT表达量均有不同程度增加,这与Yang等[18]研究结果一致,在缺氧条件下,水生动物会针对减少的O2环境启动多种代谢适应,将代谢从有氧氧化转换为糖酵解途径是增加葡萄糖摄取以促进对低O2应激反应的一种策略[19]。因此,对葡萄糖的更高需求导致细胞膜上葡萄糖转运蛋白的数量增加。在干露期间T组中GLUT表达量低于S组,可见T组中对葡萄糖的摄取需求可能弱于S组,机体还处于稳定状态,而与有氧代谢相比,厌氧代谢的产能效率更低,更不利于维持机体能量。因此干露T组较低的GLUT表达量可能与其较强的低氧耐受性有关。
在干露应激下,机体细胞表面受到非己信号刺激时会激活信号转导途径从而转录相关基因发挥一系列免疫应答反应。MYD88是Toll样受体(Toll-likereceptor,TLR)信号通路中的一个关键接头分子[20-21],MYD88介导的信号通路在无脊椎动物免疫反应中起关键作用[22]。在两组干露胁迫后都表现出随时间延长显著增加的趋势,然而,T组的MYD88在此过程中表达水平低于S组,这可能表明,在干露状态下T组中免疫反应弱于S组,这可能是T组对干露不敏感的原因之一,T组通过调节自身免疫应答反应抑制以抵御干露胁迫。
热激蛋白(HSPs)是机体应激相关的蛋白质[23],HSPs还充当其他蛋白的细胞内伴侣,并作为细胞修复系统的一部分[24]。在缺氧期间,HSPs的产生会应压力而增加[25],这可能是信号转导调节的结果,并且可能是某些组织中的早期转录调节的结果。因此,这些mRNA随时准备对任何压力情况做出快速反应[26]。本研究发现干露胁迫使贝体Hsp70、Hsp20的表达显著变化,这与Bao等[27]研究结果一致。两组Hsp70和Hsp20的表达量都在干露期间有上升趋势,研究指出,Hsp70分子伴侣蛋白在细胞氧化应激过程中蛋白酶体的解离和结合中有重要介导作用,可降解氧化损伤的蛋白质并能承受应力暴露的最初影响[28]。而Hsp20蛋白可以在压力下参与多种细胞过程,包括经历构象破坏的底物蛋白的ATP依赖性稳定作用或与脂质分子结合以调节膜结构的流动性,提示Hsp20可能参与应激刺激的感知,从而导致信号转导通路的激活[29]。本研究发现在0、2 h两者的表达量S组都高于T组,对S组来说,氧化应激对其造成的影响可能远超T组,机体在应激下大量调动Hsp70伴侣蛋白来增强自身对细胞的保护力,并上调Hsp20表达以调节膜结构流动性,以维持细胞稳定性。而T组在14 hHsp70、Hsp20表达量高于组,S组此时处于濒死状态,机体内基因表达处于紊乱状态,尽管机体可能还在利用上调的基因表达来抵抗应激,但难以修复其氧化应激造成的严重损伤,而此时T组在耐受干露胁迫的情况下,仍能显著增加其表达,推测T组对氧化应激的耐受力强于S组,且机体在降解氧化损伤的蛋白质或参与应激刺激感知等方面显示出优势差异有关。
细胞凋亡是机体维持内环境稳定,由基因控制的细胞自主的有序的死亡[30]。凋亡调控是机体维持平衡稳定的前提,而调控包含促进和抑制凋亡的两方面作用,其中抑制凋亡的作用由凋亡抑制因子IAP家族蛋白承担[31]。本研究发现cIAP在S组各个时间点表达量都高于T组,这表明,S组机体在面对干露胁迫时,大量表达cIAP使机体抗凋亡作用更显著。凋亡抑制蛋白虽然可以抑制细胞内的caspases活性,阻止凋亡的进行,但细胞发生了严重损伤,如线粒体的不可逆性变化,导致ATP 生产的缺乏时,细胞将进入不可逆的凋亡反应。因此IAP 阻断细胞凋亡的调控受多种因素影响,它不仅依赖于刺激的种类,而且还和刺激的强度有关[32]。但是在2 h时间点,cIAP发生较大变化,这可能是S组进入濒死状态且细胞发生严重不可逆的损伤有关。因此可见,抗凋亡对机体和单个细胞不同干露时间的意义并不相同。
马氏珠母贝是重要的育珠母贝之一,而插核育珠是珍珠养殖的中心环节。本研究结果显示,在经历干露胁迫后,春季和秋季插核后耐受组休养期存活率均显著高于敏感组,这表明干露耐受能力的差异可以作为马氏珠母贝抗逆性的重要且易于利用的指标,应用于养殖品种培育工作,同时也验证了课题组之前的生产实践经验理论。
在马氏珠母贝养殖、育珠过程中,经常遭受干露胁迫,引起贝体的应激反应,严重时影响其生存,极大地制约了马氏珠母贝的养殖与育珠,而干露耐受能力强的个体显现出优于敏感个体的表型特征。本研究首先分析在不同温度下干露胁迫对马氏珠母贝的影响,并在适温条件下获得干露敏感组和干露耐受组,分析比较两组马氏珠母贝的免疫基因表达量和植核后休养期的存活率,探究干露敏感组和干露耐受组的差异,为马氏珠母贝健康养殖和选育耐干露品种提供理论指导。
