时实荧光定性PCR 实验室内质控方法的建立及探讨
2021-04-11字立源兰晓燕黄苏金杨婧涓陈桂余胡付娟尹潇朱碧姝李维锦谢函凌杨雪朱荣华保山市中心血站检验科办公室云南保山678000
字立源,兰晓燕,黄苏金,杨婧涓,陈桂余,胡付娟,尹潇,朱碧姝,李维锦,谢函凌,杨雪,朱荣华保山市中心血站检验科办公室,云南保山 678000
目前, 实时荧光定量PCR 已广泛应用于疾病临床诊疗和医学研究,如用于抗病毒药物治疗监测的外周血病毒含量测定,基因表达等方面。中国在2015 年底在无偿献血者中全面开展了核酸检测,有效缩短窗口期,大大降低了输血传播病原体的风险[1]。核酸检测室内质量控制对于保证NAT 结果的可靠性具有重要意义, 然而目前尚未能建立统一的NAT 质量控制方法。《血站核酸检测实验质量保证指南》中提到血站核酸测室内质控的基本要求:每一批检测应至少有一个弱阳性室内质控品。该实验室结合检测系统的混样方式及检测下限,CT 值(实时监测扩增过程的荧光信号达到指数扩增时的循环周期数)与原始扩增模板数量呈负相关,可通过其与原始模板的函数关系,来计算原始模板的数量,评价该实验室室内质控模式的可行性,监控室内质控体系的运行情况。
1 材料与方法
1.1 试剂与仪器
试剂: 质控品标准物质采用北京康切斯特批号201706005, 试剂盒为苏州华益美公司, 批号MA20171209,MA20180604 两个试剂批号。 仪器:全自动核酸提取仪(HAMILTON STAR);ABI 7500 荧光扩增仪(美国ABI 公司)。
1.2 标准品浓度的选择
标准品浓度的选择原则覆盖高中低浓度值,室内质控浓度应尽可能接近试剂与系统最低检测限,检测用于检测限浓度的质控品检测的稳定性较差[2]。 根据最低检测限,标准曲线制作选择相应浓度值。
1.3 质控图的绘制
连续测定20 次质控数值,计算其均值(X)和标准差(S),以X 为中心线,以质控值超过X±2S 为警告限, 超过X±3S 为失控限,作图建立一个质控框架[3]。
1.4 实验有效性判断
试剂盒提供的阴性质控品对照阴性、阳性质控品对照阳性、内标的CT 有效值≤40;外部质控值超过(X±2S)为警告限, 超过(X±3S)为失控限。 同时,以Westgard 多规则质控方法进行辅助判断,10 个质控值均落在均值一侧,判定为失控。
1.5 统计方法
用Excel 表格绘制质控图,统计学分析采用SPSS 17.0 统计学软件。
2 结果
2.1 标准品浓度(IU/mL)与CT 值
理论浓度与检测CT 值结果见表1。

表1 配制理论浓度与检测CT 值
2.2 标准品浓度与CT 值在0.05 水平呈高度负相关
HBV-DNA、HCV-RNA、HIV-RNA 与CT 值的相关系数分别为(r=-0.873,-0.966,-0.797)。 CT 值与标准品浓度的函数关系依次为Y=-0.0236X+39.16,R2=0.762;Y=-0.0122X+41.452.16,R2=0.934;Y=-0.0016X+40.913,R2=0.635。
2.3 结果正态性检验
对2 个批次试剂119 次实验质控CT 值以及通过相关函数计算浓度值进行正态性检验,试剂批号为MA20171209 的73 次实验CT 值通过相关函数计算浓度值均服从正态分布(P>0.05);试剂批号为MA20180604 的46 次实验CT 值及通过相关函数计算浓度值均服从正态分布(P>0.05),见表2、3。
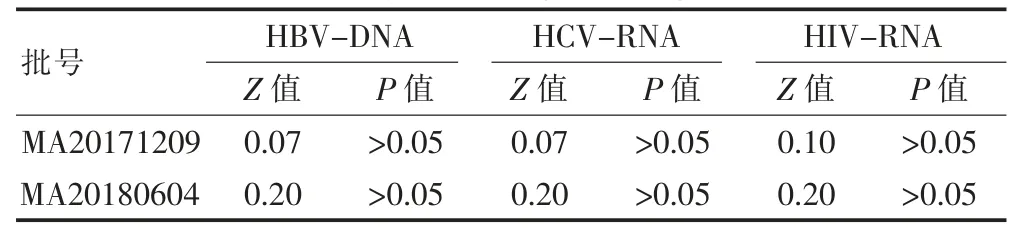
表2 质控品CT 值正态性检验
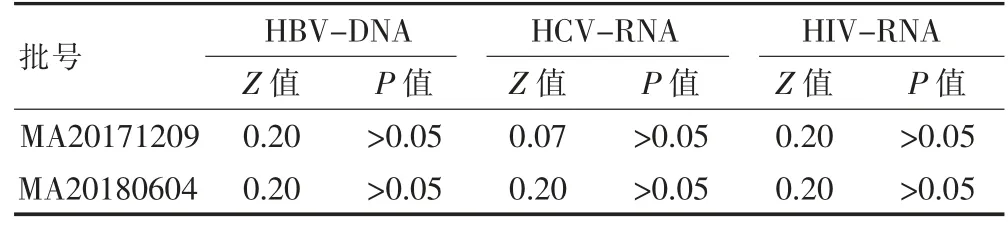
表3 质控品CT 值与对应函数关系计算浓度正态性检验
2.4 用“即刻法”进行室内质控情况
用HBV-DNA、HCV-RNA、HIV-RNA 的浓度值进行前20 次实验的质量控制, 只有HBV-DNA 能完成20 次的控制过程均为在控状态,HCV-RNA 和HIV-RNA 在未能到20 次,均有失控状态发生。
2.5 Levey-Jennings 质控图的建立
用CT 值与质控品浓度之间的函数关系分别计算HBV-DNA、HCV-RNA、HIV-RNA 的浓度值,计算结果经过正态性检验,服从正态分布,说明可以采用L-J 质控图及相应的质控规则进行室内质控。 HBVDNA 前20 次采用即刻法,剔出离群值,计算前20 次均值(X),标准差(S),建立L-J 室内质控框架,从第21 次开始用L-J 质控。 HCV-RNA、HIV-RNA 采用预设固定框架法:即在更换试剂或质控品批号时,以上一批号浓度值均值(X)和标准差(S)建立框架。
3 讨论
CT 值是当前实时荧光PCR 的主要定量参数。 它是实时PCR 的基本参数, 也是获得准确且重现性好的数据的基础。 起始模板量越多,荧光信号在统计学上显著高于背景信号所需的PCR 循环数越少, 反之则越多。 基于PCR 原理的检测方法可以用循环阈值(CT 值)作为检测值做质控图[4]。
但是直接利用CT 值原始数值作“即刻法或Levey-Jennings 图”室内质控,很难满足条件。 缺点有:①CT 值越小,起始浓度拷贝数越大;CT 值越大,起始浓度拷贝数越小;所以建立的质控图不够直观,高值失控在L-J 质控图上表现为低值失控, 实际结果刚好相反;②因采用的是PCR 定性实验, CT 值的不精确度(CV)很小,容易造成假失控,在实际室内质控工作中很难实现,达不到监控核酸实验有效性的目的。
在实时荧光PCR 中,每个模板的CT 值与该模板的起始拷贝数的对数存在线性关系, 起始拷贝数越多,CT 值越小。利用已知起始拷贝数的外部标准品可做出校正曲线。 因此,只要获得未知标本的CT 值,即可从校正曲线上计算出该标本的起始拷贝数,这是采用外标进行实时荧光PCR 绝对定量的基本原理[5]。笔者实验室证实,室内质控品浓度与CT 值在0.05 水平呈高度负相关,HBV-DNA、HCV-RNA、HIV-RNA 与CT 值的相关系数为(r=-0.873,-0.966,-0.797)。 根据相应检测项目的回归方程,计算出相应检测项目外部质控品的浓度值。 这就是我们利用CT 值来定量起始拷贝数比用PCR 反应终点时所测得的PCR 产物量推断的起始拷贝更可信的主要原因。赵航等[5]人用CT值与RNA 标准品拷贝数建立回归曲线, 证明用此方法可以定量检测相应病毒。
PCR 扩增产物呈指数增长, 扩增过程中, 影响PCR 反应的因素较多,稍有不同就可能会导致结果产生较大的变化。建立该实验室可行的核酸标准化质量控制方法是实验结果准确可靠的有力保障。 HBVDNA、HCV-RNA、HIV-RNA 浓度值与CT 值呈负相关,利用回归方程计算值,将检测CT 值转换为浓度值,再建立质控框架,所得数据直观,结果准确可靠。CT 值利用回归方程计算浓度值经过正态性检验,均服从正态分布, 可以采用Levey-Jennings 作质控图。笔者在更换试剂批号或质控品批号前20 次实验采用即刻法, 只有HBV-DNA 能完成20 次的控制过程均为在控状态,HCV-RNA 和HIV-RNA 在未能到20次, 均有失控状态发生。 原因主要是DNA 标准品与RNA 标准品相比,DNA 有相对较好的稳定性、重复性和敏感性。 所以即刻法在本实验室只适用于HBVDNA 的前20 次实验的控制, 而HCV-RNA 和HIVRNA 不适用即刻法。 HCV-RNA 和HIV-RNA 前20次实验采用预设固定框架(上一批号的均值和标准差),第21 次实验以前20 次实验数据为基础建立质控框架。 根据检测前20 个点结果计算HBV-DNA 的CV值 为17.92%,HCV-RNA 的CV 值 为30.77%,HIVRNA 的CV 值为23.82%。按照国家标准,酶免法的反应板内CV≤15%, 而常规IQC 的CV 可以达到30%左右[6]。所以根据此方法建立的质控框架有效。该实验室的质控规则定为以质控值超过(X±2S)为警告限,超过(X±3S)为失控限,质控值10 个点在均值一侧为失控。 从HBV-DNA 质控图可以看出,L-J 质控图上有4 次警告,提示有随机误差。HCV-RNA 质控图有1次失控,10 个质控值均落在均值一侧,提示可能存在系统误差。需要采取纠正和预防措施改进实验室的检验质量[7-8]。
由于数据的有限, 今后加大对检测数据的验证。该方法也有一定的局限性, 标准曲线的制作是关键。有好的标准曲线,是检验结果准确的基础。
