盐度对威氏海链藻生长和生化指标的影响
2021-04-11陈墅鑫罗莎莎张吉澳李长玲黄翔鹄
陈墅鑫,罗莎莎,张吉澳,李长玲,2,黄翔鹄,2
(1.广东海洋大学水产学院,广东 湛江 524088;2.广东海洋大学深圳研究院,广东 深圳 518000)
威氏海链藻 (Thalassiosira weissflogii) 隶属于中心硅藻纲 (Centricae) 海链藻属 (Thalassiosira),是我国南方养殖虾塘的优势藻种之一[1-3]。其富含多不饱和脂肪酸,尤其是EPA和DHA,可促进对虾幼体的生长发育,可作为对虾开口饵料或桡足类等浮游动物营养强化饵料,已广泛应用于对虾育苗[4]。
威氏海链藻可有效去除养殖水体中的氨氮,有净化养殖水质的功能。王培明等[5]利用威氏海链藻和侧孢短芽胞杆菌(Brevibacillus laterosporus)组成的菌藻联合体吸收水体氨氮,指出威氏海链藻为菌藻复合体吸收氨氮的主要贡献体,其最高贡献率可达84%。因此,定向培养威氏海链藻有重要意义。盐度是微藻生长的重要生态因子,然而,已有研究主要针对绿藻门和硅藻门部分种类在不同盐度条件下对于某物质的吸收或者同化效果等,鲜见关于威氏海链藻藻细胞在不同盐度下的适应性研究。本研究分析在不同盐度条件下威氏海链藻生长和生化组分变化,为定向培育威氏海链藻并应用于养殖池塘水环境水质调控提供参考。
1 材料与方法
1.1 材料
实验用威氏海链藻由广东海洋大学藻类资源开发与养殖环境生态修复实验室中国南方对虾池塘分离纯化并保种。取指数生长期藻液用于实验。
主要仪器有上海博讯BSG-300光照培养箱、250 mL三角锥瓶(蜀牛)。采用f/2培养基进行连续不充气密封培养。培养体积为200 mL。实验初始接种密度为5×105个/mL,实验期间光/暗周期为16 h L/8 h D,温度为 (28 ± 0.5) ℃,照度为 (3000 ± 100) lx,pH 8.0 ± 0.2。实验盐度梯度为5、15、25、35、45,每个梯度设3个生物学重复。培养周期为8 d。每天早中晚3次定期摇匀藻液,每2 d取样1次。
1.2 藻细胞密度测定
实验期间,每次取样后使用血细胞计数板(25 mm×16 mm)在光学显微镜下计数威氏海链藻细胞密度。比生长率μ(d-1) 计算:

式中,N1和N0分别是t1和t0时的细胞密度。
1.3 色素含量测定
采用热乙醇提取法[6]。用5 μm的混合纤维素膜收集5 mL藻液,弃滤液,将收集的滤膜置冰箱-20 ℃条件下暗处理16 h,加入体积分数为95%、80 ℃预热的乙醇5 mL,置于80 ℃水浴锅中2 min,避光室温静置4 h,以5 000 r/min离心10 min,用分光光度计测定上清液在480、510、630、664、750 nm处测定光密度值D。根据下式计算叶绿素a[7]和类胡萝卜素[8]含量。
ρ(叶绿素a)=11.47×D664-0.40×D630,
ρ(类胡萝卜素)=7.6 × [(D480-D750) -1.49 × (D510-D750)]。
式中,D480、D510、D630、D664、D750分别为480、510、630、664、750 nm下光密度。
1.4 藻细胞可溶性总糖含量测定
用苯酚硫酸法[6,9]测定,葡萄糖含量标准曲线:
Y=0.005 4X+0.260 3,R2=0.998 7,
其中,Y为光密度值,X为葡萄糖浓度(μg/mL)。
样品前处理参照韩谦等的碱提法[9]。每次取藻液5 mL,于5 000 r/min 条件下离心10 min,去除上清液,用各盐度梯度海水洗涤两次。加入0.305 mol/L的NaOH溶液1 mL,混匀,置58.5 ℃下水浴68 min,以5 000 r/min离心10 min,取200 μL上清液用于可溶性总糖含量的测定。
1.5 藻细胞总蛋白含量测定
参照洪廷等[10]方法对样品进行前处理。每次取2.5 mL藻液,以5 000 r/min 离心10 min,去除上清液,用各梯度海水洗涤2次,藻泥加入0.305 mol/L的NaOH溶液1 mL,混匀,置74.5 °C下水浴69 min。以5 000 r/min离心10 min,取100 μL上清液,用考马斯亮蓝法[6,11-12]测定总蛋白含量。以牛血清蛋白为标准品制作标准曲线。蛋白含量标准曲线:
Y=0.002 4X+0.736 4,R2=0.997 2,
其中,Y为光密度值,X为总蛋白质量浓度(μg/mL)。
1.6 藻细胞中性脂含量测定
取藻液适量,用磷酸盐缓冲液(PBS)重悬藻细胞至350 nm下光密度值D(350 nm) 为1.0。取1 mL藻液,以5 000 r/min离心5 min,去除上清液,藻细胞沉淀用PBS洗2次,加入1 mL 体积分数20%二甲基亚砜溶液。于38 ℃下水浴18 min,每1 mL藻液加入20 μL尼罗红染料(质量浓度为0.1 mg/mL丙酮溶液),混匀,染色5 min,取250 μL于酶标板中,使用多功能酶标仪,激发波长480 nm,测定其在570 nm的荧光强度。
1.7 数据分析
用SPSS 19.0对实验数据进行单因素方差分析,用Duncan’s 多重比较对均值进行差异显著性分析,P< 0.05 表示有显著性差异。
2 结果与讨论
2.1 不同盐度对威氏海链藻细胞密度和比增长率的影响
图1可见,不同盐度条件下,威氏海链藻8 d时各组藻细胞密度平均值达到最高,盐度对威氏海链藻生长影响显著(P< 0.05),培养6 d时,盐度25组威氏海链藻细胞数显著高于盐度5组和45组(P< 0.05);培养8 d时,盐度25和盐度35组细胞密度平均值均为2.0×106mL-1,较实验初始密度(5×105mL-1)增长4.0倍。但培养期间,盐度变化对比生长率影响无统计学意义(P> 0.05)(表1)。

图1 不同盐度条件下威氏海链藻细胞密度Fig.1 Cell density in Thalassiosira weissflogiiunder different salinity conditions

表1 不同盐度条件下威氏海链藻比生长率Table 1 Specific growth rate of Thalassiosira weissflogiiunder different salinity conditions
可见,盐度25时藻细胞生长最佳,盐度5和盐度45组生长较慢,各组藻细胞密度平均值在培养8 d时达到最大。这与陈长平等[13]对底栖硅藻新月筒柱藻(Cylindrotheca closterium)的研究结果一致。盐度25与盐度5、盐度35组培养期间,藻细胞密度无显著差异(P> 0.05),但当盐度变化对藻细胞形成胁迫时,藻细胞生长速度则显著降低。当硅藻细胞受到盐度胁迫时,藻细胞可通过主动运输将离子输送出细胞膜或进入液泡[14],以及通过细胞渗透调节剂来减少盐胁迫的影响[15]。这些细胞活动均需耗能,因此盐度胁迫可延缓或抑制细胞分 裂[16]。同时高盐等不良环境易导致硅藻细胞产生一种细胞外多聚物 (Extracellular Polymeric Substances,EPS) 的黏性物质[17],EPS可在细胞遭遇不良环境时起保护作用,有抗失水、防止细胞硅质壁溶解、减少渗透压的作用,还有稳定群落组成功能[18-19]。综上,盐度过高或者过低均会对微藻细胞增长产生抑制作用,但威氏海链藻藻细胞有硅质细胞壁,可在一定程度上抵抗外界渗透压改变对藻细胞造成的影响。细胞自身有一定的渗透压调节能力,所以在培养8 d时,各盐度环境下威氏海链藻藻细胞密度均可达到较高水平。
2.2 不同盐度条件下威氏海链藻色素含量
图2表明,盐度对威氏海链藻叶绿素a含量有显著影响(P< 0.05),培养2~6 d期间各组叶绿素a含量均呈现不同程度积累,且盐度45组叶绿素a含量显著低于盐度15和25组(P< 0.05)。盐度15时,培养6 d时叶绿素a质量浓度平均值最高,为3.4814 μg/mL,较初始值(2.2183 μg/mL)增加1.6倍,显著高于盐度45组。推测当盐度处于45时,盐度胁迫对藻细胞的光合系统产生抑制作用,导致其光合色素合成受抑制。这与余锦兰等[20]对小新月菱形藻 (Nitzschia closteriumf.minutissima) 高盐度胁迫响应的研究一致。据报道,高盐度会影响叶绿体内囊体膜的稳定性,同时细胞内的Na+和Cl-增加,影响叶绿素和叶绿素蛋白的亲和性,同时激活叶绿素酶活性,加速叶绿素分解[21]。

图2 不同盐度条件下威氏海链藻叶绿素a含量Fig.2 Chlorophyll A content in Thalassiosira weissflogiiunder different salinity conditions
如图3所示,培养期间各实验组类胡萝卜素含量均呈现上升趋势,盐度15组培养8 d时类胡萝卜素质量浓度平均值最高,为2.354 9 μg/mL,较初始值(1.079 3 μg/mL)增加2.2倍,显著高于盐度5和盐度45组(P< 0.05)。类胡萝卜素是威氏海链藻的重要色素组成,可反映藻细胞的生长状态,同时有抗氧化作用,可清除氧化自由基。据报道,在一定范围内提高盐度可增加藻类类胡萝卜素的积累[22-23]。但当盐度过高或过低而对藻细胞形成胁迫时,类胡萝卜素的合成将受到明显抑制。
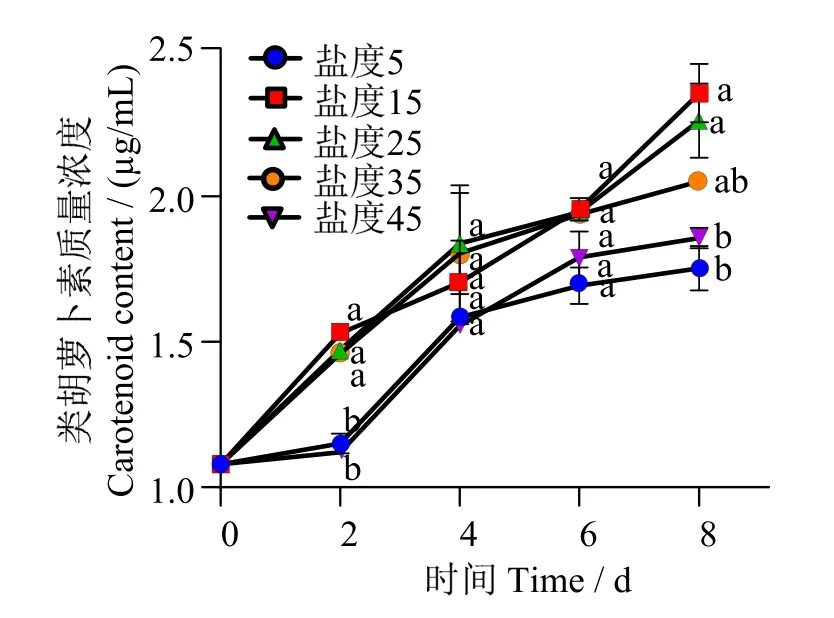
图3 不同盐度条件下威氏海链藻类胡萝卜素含量Fig.3 Carotene content in Thalassiosira weissflogiiunder different salinity conditions
2.3 不同盐度条件下威氏海链藻总糖含量
图4可见,实验期间各组藻细胞可溶性总糖含量均呈先降后升的趋势,且不同盐度环境对藻细胞总糖积累效果有显著影响(P< 0.05)。这与陈长平等[13]对新月筒柱藻的研究一致。实验0~2 d,各组总糖含量均呈下降趋势,推测此时藻细胞处于接种后的恢复期,需分解糖类为细胞正常生理活动提供能量。盐度25组在培养4~6 d期间,总糖含量积累显著优于盐度5和盐度45组(P< 0.05)。盐度15组培养8 d时总糖质量浓度平均值最大,为123.17 μg/mL,较初始值(40.430 μg/mL)增加3.0倍。盐度45组培养0~4 d总糖含量持续下降,推测是细胞处于接种后高盐状态,生长受到抑制,需持续以糖类为供能物质,培养4 d后呈上升趋势,藻细胞出现补偿性生长效应,藻细胞可溶性总糖含量上升,且藻细胞增加糖类合成可维持细胞渗透压稳定,是藻类应对盐度环境改变的一种生理调节反应[24-25]。
2.4 不同盐度条件下威氏海链藻可溶性蛋白含量
如图5所示,盐度35组培养6 d时可溶性蛋白质量浓度显著高于其他实验组(P< 0.05),均值为142.9 μg/mL,较初始值(61.28 μg/mL)增加2.3倍,且盐度45组可溶性蛋白含量显著低于其他实验组 (P< 0.05)。

图4 不同盐度条件下威氏海链藻类总糖含量Fig.4 Total sugar content of Thalassiosira weissflogii under different salinity conditions
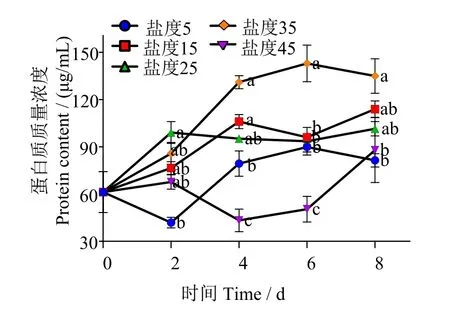
图5 不同盐度条件下威氏海链藻可溶性蛋白含量Fig.5 Soluble protein content of Thalassiosira weissflogiiunder different salinity conditions
在培养过程中,盐度5组可溶性蛋白含量在0~2 d时呈现下降趋势,2~6 d时呈现升高趋势,而盐度45组则在培养2~4 d时出现明显下降,在4~8 d期间呈逐渐升高趋势,推测这可能是威氏海链藻细胞应对低盐和高盐的不同策略。当外界盐度过高或过低时,藻细胞渗透压发生改变,细胞短期大量积累脯氨酸[26]、牛磺酸[27]等渗透保护剂、硫代甜菜碱(dimethylsulfoniopropionate,DMSP)[28]等有机硫化合物以及其他氨基酸以维持细胞内环境的相对稳定,抵消渗透胁迫[29-30]。研究表明,隐秘小环藻(Cyclotella cryptica)藻细胞内游离脯氨酸浓度增加是缓解高渗透胁迫的主要机制[31-32],细胞内脯氨酸积累在稳定生物大分子结构、降低细胞酸性、解除氨毒及作为能量库调节细胞氧化还原势等方面有重要作用[33],渗透胁迫可诱导小环藻(Cyclotella nana)甘氨酸甜菜碱和DMSP合成,且该诱导在转录本和蛋白水平上均受到调控[34-35]。
2.5 不同盐度条件下威氏海链藻中性脂含量
如图6所示,实验期间各组中性脂含量均呈上升趋势。盐度5组,培养 2~6 d时,中性脂荧光强度明显高于其他实验组(P< 0.05),盐度45组,培养4~8 d时中性脂的积累速度高于其他实验组(P< 0.05),培养8 d时中性脂荧光强度平均值达到最高,较初始荧光强度增加4倍,且显著高于盐度15和盐度25组(P< 0.05)。推测盐度45组藻细胞培养0~4 d时处于接种后的恢复期,细胞处于高盐环境,增长速度慢,培养4~8 d,细胞持续受到高盐胁迫,中性脂积累速度加快。梁英等[36]对硅藻在不同盐度下脂肪酸组成的研究表明,硅藻主要脂肪酸为中性脂质,分别为16:0、16:1(n-7)和20:5(n-3),随着盐度增加,三角褐指藻(Phaeodactylum tricornutum)和新月菱形藻(Nitzschia closterium)单不饱和脂肪酸增加,纤细角毛藻(Chaetoceros gracilis)和细柱藻(Cylindrotheca fusiformis)单不饱和脂肪酸减少。盐度对微藻中性脂含量有显著影响[37]。宫钰莹 等[38]研究表明,高盐环境使盐生杜氏藻(Dunaliella salina)细胞生长受到抑制,进而积累中性脂肪储能。魏东等[39]研究发现,盐度升高可显著促进胶球藻(Coccomyxa subellipsoidea)C-169中性脂质积累。所以,盐度变化可导致藻细胞中性脂质的积累。

图6 不同盐度条件下威氏海链藻中性脂含量Fig.6 Neutral lipid content of Thalassiosira weissflogiiunder different salinity conditions
3 结论
本研究探究威氏海链藻对不同盐度环境的短期响应。结果表明,不同盐度对威氏海链藻生长和生化组分有显著影响,盐度为15~35时,威氏海链藻生长速度较快,生化组成较为稳定,盐度15时最有利于藻细胞叶绿素a和类胡萝卜素、总糖的合成,盐度25和盐度35时,藻细胞平均增长速度较快,盐度35时最有利于藻细胞可溶性蛋白积累。研究结果将为进一步开发威氏海链藻在对虾养殖环境水质调控方面的应用提供参考。
