波吉卵囊藻胞外滤液对铜绿微囊藻转录水平的影响
2021-04-11王孝谦黄翔鹄李长玲罗国玲王新宇张玉蕾
王孝谦,黄翔鹄,李长玲,罗国玲,张 宁,王新宇,张玉蕾
(1.广东海洋大学水产学院//2.广东省藻类养殖及应用工程技术研究中心,广东 湛江 524088)
目前,地表水多面临水体富营养的环境问题[1],水体浮游藻类营养过量,有害微藻暴发增长,形成有害藻华,危及水生动物、植物乃至人类健康[2-4]。铜绿微囊藻(Microcystis aeruginosa)是一种常见的水华蓝藻,它形成藻华频率快,破坏力巨大[5]。有害藻华防控方法已成为研究热点。黏土法是目前常用物理学方法,主要通过黏土颗粒黏连藻体形成絮团沉降,但该方法耗费巨大且会影响底栖生物生长[6];化学方法中,水体稀释消耗的试剂量巨大及化学试剂残留,对生态环境造成二次破坏;生物法主要利用生物间的竞争作用,控制有害藻生长。有些微藻可通过化感作用干扰其他微藻生长,获得竞争优 势[7]。大部分化感物质可天然合成并可自我降解,对环境的二次污染小[8]。因此,利用生物法防控蓝藻水华,投入人力财力较少,且生态环境友好[9]。
波吉卵囊藻(Oocystis borgei)是对虾高位池常见的优势绿藻,所形成的优势群落可维持40~50 d,有利于水体稳定[10]。其对复杂的养殖环境有极强的适应性[11-13],还可吸收水体的氨氮[14-15],对弧菌也有一定抑制效果[16]。有研究报道,可用波吉卵囊藻控制蛋白核小球藻(Chlorella pyrenoidosa)的生长速度,防止小球藻生长过快破坏水体生态平衡[17]。波吉卵囊藻胞外滤液可破坏铜绿微囊藻细胞膜,有效抑制铜绿微囊藻生长,但具体机制尚未明确[18]。应用波吉卵囊藻防控蓝藻有巨大潜力[19]。
转录组指细胞或组织在特定情况下所表达的所有RNA,可反映基因表达情况及生物代谢途径变化[20]。转录组学技术可快速筛选出植物应对胁迫的相关因子,反映能量代谢、信号传导等生物学途径和抗逆应激的关系,对了解有毒物质与细胞间作用机制,探究细胞对不良环境的免疫耐受机制有重要意义[20-23]。Zhao等[24]通过转录组技术发现,在高氨氮胁迫下,亚心型扁藻(Platymonas subcordiformis)受到氧化损坏,而添加植物激素可使其抗氧化、解毒能力加强。Du等[25]发现,在C60集聚体处理一周后,栅藻(Scenedesmus obliquus)与三羧酸循环相关的基因表达量显著变化,推断是循环产物蔗糖的积累导致其光合能力损伤。为进一步探索波吉卵囊藻胞外滤液对铜绿微囊藻的抑制机制,本研究通过高通量测序技术对在波吉卵囊藻胞外滤液中培养的铜绿微囊藻进行测序,分析波吉卵囊藻对铜绿微囊藻的化感作用,为蓝藻防控研究及蓝藻应对逆境胁迫的分子机制研究提供参考。
1 材料与方法
1.1 材料
波吉卵囊藻由广东海洋大学藻类资源开发与养殖环境生态修复实验室提供,所用培养基为BG11培养基[26],初始密度1×106mL-1,培养条件:温度(25±1)℃,照度3 500 lx,光/暗周期12 h/12 h。每天摇匀3次,防止微藻挂壁和沉降。培养10 d后,收集上清液,依次用孔径0.45、0.22 μm的滤膜过滤,获得波吉卵囊藻的胞外滤液。经测定,波吉卵囊藻滤液的总氮、总磷浓度与BG11培养基相差较小,按照BG11培养基配方补齐氮、磷营养盐,可满足铜绿微囊藻正常生长所需。
铜绿微囊藻(FACHB-905)购自科院水生淡水藻种库。分别使用BG11培养基(对照)和波吉卵囊胞外滤液培养铜绿微囊藻,初始密度为1×106mL-1,设置3组生物学重复,培养条件同上。胞外滤液培养下的铜绿微囊藻记为OB1、OB2、OB3组,BG11培养下的铜绿微囊藻记为C1、C2、C3组。培养4 d后,对照组密度为3.14×106mL-1,实验组密度为0.971×106mL-1,生长差异显著(P< 0.05),实验组生长受到抑制。离心收集藻细胞,用液氮速冻,储存于-80 ℃超低温冰箱,用于转录组测序。
1.2 RNA提取及cDNA文库构建与测序
使用天根RNAprep Pure多糖多酚植物总RNA提取试剂盒提取冷冻藻细胞总RNA,操作过程严格按照说明书进行。采用Nanodrop检测提取样品质量,RNA专用琼脂糖电泳检测样品完整性。将质检合格的样品进行转录组文库构建,采用第2代测序技术,基于Illumina测序平台,对转录组文库进行双末端测序。转录组文库构建和高通量测序均委托上海派森诺科技股份有限公司进行。
1.3 转录组数据分析
用Cutadapt软件对测序后的原始数据进行低质量及接头过滤。通过Bowtie2(http://bowtie-bio.sourceforge.net/index.shtml)建立参考基因组索引,将过滤后Reads与参考基因组(GCF_002095975.1_ ASM209597v1_genomic.fna)进行比对。使用HTSeq 0.6.1p2 (http://www-huber.embl.de/users/anders/HTSeq) 进行基因表达的定量分析。
1.4 差异表达基因分析
通过DESeq(Version 1.18.0)对基因表达进行差异性分析。log2(差异倍数) > 1时,基因表达上调,log2(差异倍数) < 1时表达下调。将log2|差异倍数| > 1、P< 0.05的基因作为表达差异显著基因。使用topGO进行GO富集分析(P< 0.05时,显著富集),确定差异基因的主要生物学功能。统计各KEGG通路不同层级上包含的差异表达基因数目,进而确定差异表达基因主要参与的代谢途径和信号通路,以整个基因组为背景,采用超几何分布计算差异基因显著富集的通路。
1.5 实时荧光定量PCR验证
为检验测序结果的准确性,选取14个表达差异显著的基因,设计相应引物(表1),以铜绿微囊藻16S rRNA基因(GenBank ID:U03402.1)作为内参,进行实时荧光定量PCR验证(qRT-PCR验证)。实验过程严格按照TransStart®Tip Green qPCR SuperMix说明书进行。每组样品重复3次,以2-ΔΔCt法计算差异基因的表达水平[27]。

表1 铜绿微囊藻qRT-PCR引物序列Table 1 Sequences of the primer pairs in M.aeruginosa for real-time PCR
2 结果与分析
2.1 转录组数据整体评价
转录组样品建库、测序后的原始序列质量见表2。铜绿微囊藻在波吉卵囊藻滤液中培养4 d,得到 (6.17±0.39)×107原始读数(Reads),在BG11培养基中培养4 d(对照组)得到 (6.04±0.31) × 107原始读数。分析表明,实验组和对照组Q20(碱基识别准确率在99%以上的碱基占比)均高于97%,Q30(碱基识别准确率在99.9%以上的碱基占比)高于94%。经过滤,去除含接头、低质量读数,所得各样品过滤后读数占原始数据比例均高于81%。可见,转录组测序结果较佳,保证了后续分析准确性。
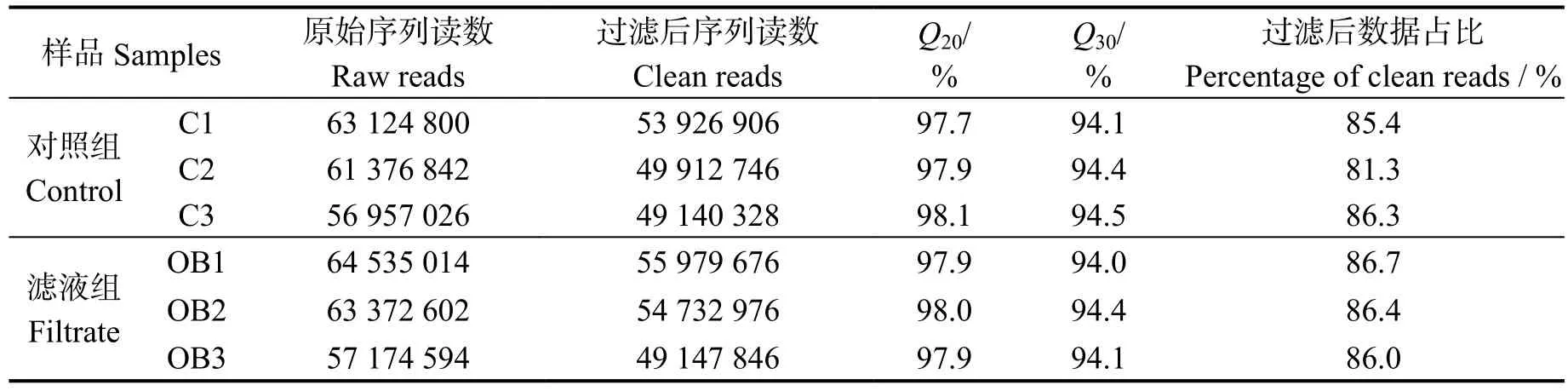
表2 转录组测序数据质量统计Table 2 Quality analysis of sequence after filtration
2.2 差异表达基因分析
经比较,获得1483个差异表达基因,其中788个上调,695个下调。基因差异表达火山图(图1)可见,除功能未知的假定蛋白外,上调最显著的基因功能分类为磷酸盐结合蛋白(Phosphate-binding proteins),而下调最显著的基因为短链脱氢酶(Short chain dehydrogenase)。差异表达最显著的前14个基因中,磷酸ABC转运蛋白(Phosphate ABC transporter)和 NADH 脱氢酶(NADH dehydrogenase)相关功能基因占比较高。

图1 差异基因表达分析火山图Fig.1 Volcanic map of differential expressed genes (DEGs)
2.3 差异基因的GO及KEGG分析
GO分类及富集分析结果(图2)显示,差异基因在GO的3个大类中所注释到的数量分别为:分子功能1 212个、生物过程1 276个和细胞组分1 216个。在分子功能子类别中,占比较高的为催化活性(643个)和结合(435个)。在生物过程子分类中,差异基因数量较多的类别为代谢过程(567个)、细胞过程(416个)和定位(111个)。在细胞组分子类别中,膜(348个)和膜部分(328个)占比较高。
将差异基因与KEGG 数据库比对分析后,516条注释基因被划分到108个通路中,level 1层级定位在代谢功能分类的通路最多,达84个。所有通路中富集最显著的20条通路见表3。氧化磷酸化通路最显著,有26个差异基因,其中20个基因上调,6个基因下调。富集最显著的前20条通路中,除RNA降解属于遗传信息处理功能,结核属于人类疾病功能,其余均属于代谢功能分类。
2.4 氧化磷酸化通路相关基因表达情况
结合KEGG通路分析及转录组测序结果,找到经过滤液处理后铜绿微囊藻中与氧化磷酸化通路相关且变化显著的基因(表4和图3)。ND3、ND4、ND5、NDUFS2、NDUFS3、ATPF0A、ATPF0B、ATPF0C、PPA、PPK等基因上调显著,其中,ATPF0B表达上调最为显著,达9.22倍。SDHA、SDHB、NDUFV2、COX1、NDUFS1、NDUFV1显著下调。
2.5 差异表达基因的qRT-PCR验证
14个表达差异显著基因实时qRT-PCR检测结果与转录组数据的比较如图4所示。各基因的 log2(差异倍数) 在RNA-seq和qRT-PCR中的数值分别是:NDUFS2,1.34 vs 2.28;ND4,0.98 vs 1.97;ATPF0B,3.65 vs 2.95;ATPF0C,3.15 vs 2.95;ATPBCF,4.85 vs 3.21;ATPF1A,3.2 vs 2.36;ATPF1D,3.07 vs 2.53;ATPF1G,2.04 vs 2.31;PSB27,4.23 vs 3.52;ND5,3.54 vs 2.43;ATPF0A,3.48 vs 2.74);SDHA,-3.06 vs -3.14;NDUFV2,-3.06 vs -3.67;NDUFV1,-2.90 vs -3.90。这些数值虽有一些差异,但上调和下调表达趋势均一致,证明了转录组数据的可信度。
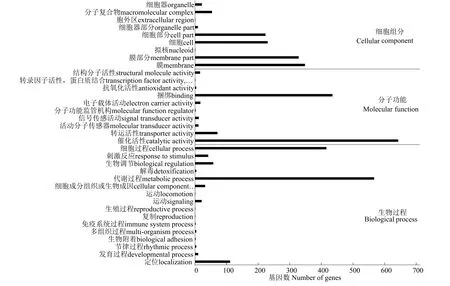
图2 差异基因GO分类Fig.2 GO classification of differential gene

表3 差异表达基因KEGG通路分析(前20)Table 3 Statistics of KEGG pathways for DEGs (top 20)
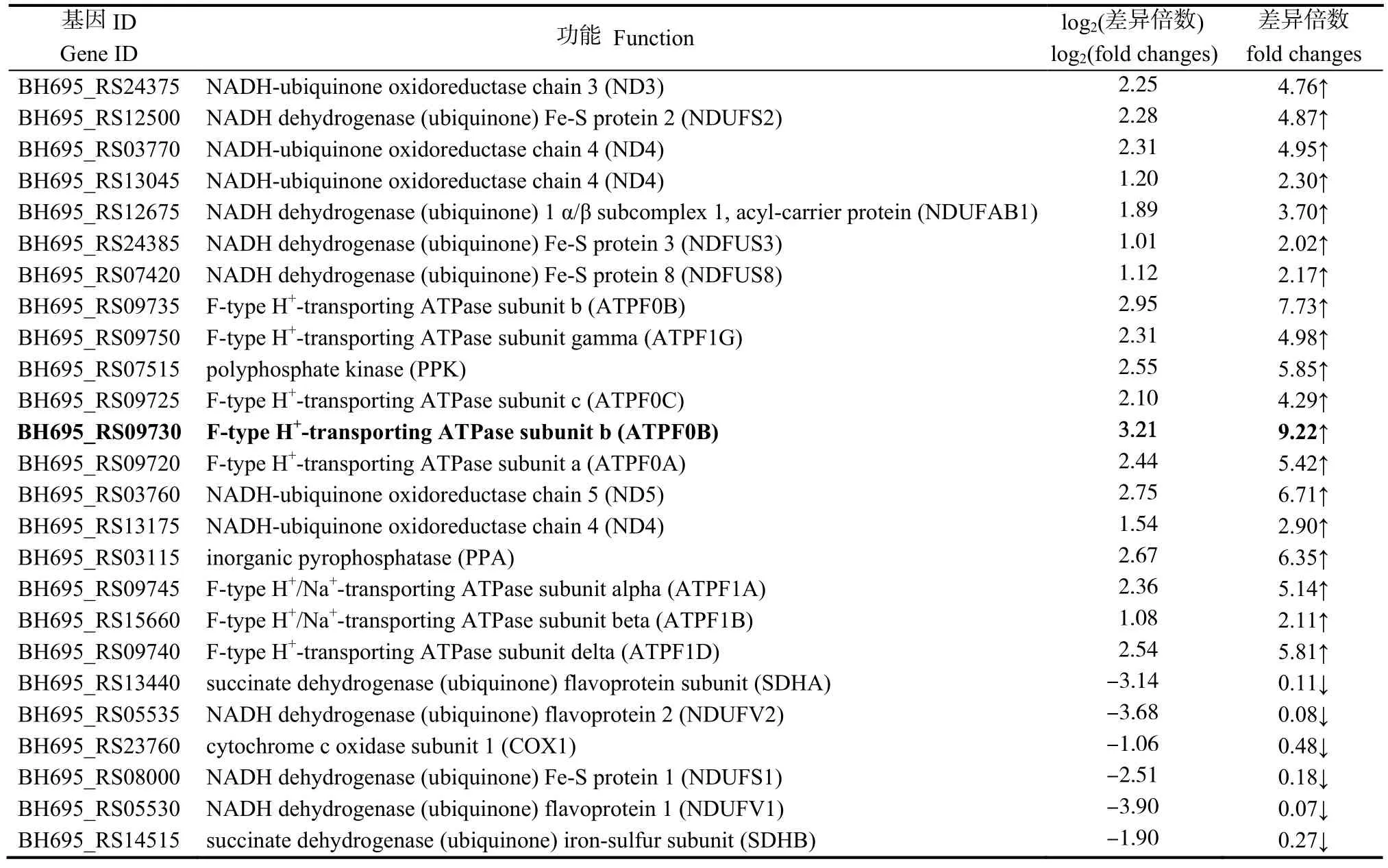
表4 氧化磷酸化通路相关基因表达情况分析Table 4 Statistics of oxidative phosphorylation pathways
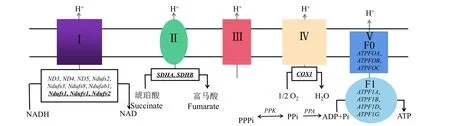
图3 滤液处理后铜绿微囊藻氧化磷酸化通路变化Fig.3 Schematic diagram of oxidative phosphorylation pathway of Microcystis aeruginosaafter filtrate treatment
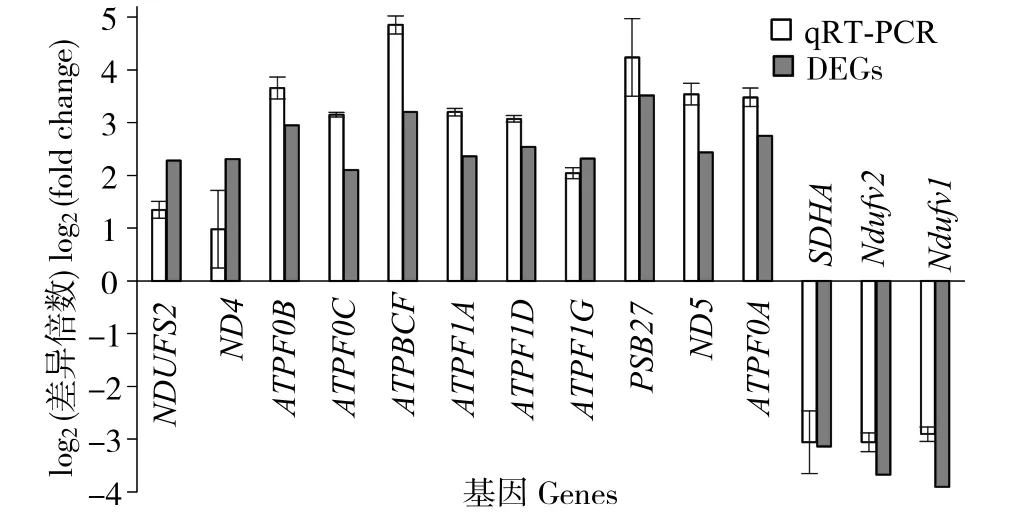
图4 转录组差异表达基因的qRT-PCR验证Fig.4 Validation of transcriptome data of differentially expressed genes by qRT-PCR
3 讨论
微藻可通过向外界分泌化感物质取得竞争优势,这些物质配合微藻自身对营养的争夺往往可有效抑制其他浮游生物生长。化感物质可自然降解,对环境非常友好[28]。研究植物化感作用及作用机制应用前景较广[29]。微藻间竞争往往伴随复杂的生物学反应,且影响因素多,而化感胁迫研究还局限于实验室阶段[30]。收集藻类细胞培养液,加入受体生物培养中,是一种研究化感效应有效手段[28]。水华鱼腥藻(Anabaena flos-aquae)生长渗出液可有效抑制铜绿微囊藻[31]。剧毒卡尔藻(Karlodinium veneficum)生长滤液可抑制东海原甲藻(Prorocentrum donghaiense)生长[32]。新月菱形藻(Nitzschia closterium)滤液可通过破坏东海原甲藻细胞光合作用、氧化酶及膜系统而抑制其生长[33]。波吉卵囊藻胞外滤液可破坏铜绿微囊藻的细胞膜,引起铜绿微囊藻脂酶活性及光合效率下降[18]。这些研究均通过测试受体微藻的各项生理指标来反映其所受胁迫情况,而在分子机制方面的研究较少。转录组测序技术应用范围广,精度高,可探索受体生物对胁迫的响应机制[23]。本研究通过对用波吉卵囊藻滤液处理的铜绿微囊藻的高通量测序,在转录水平上探讨波吉卵囊藻对铜绿微囊藻的抑制机制。
本研究中,DEGs富集到GO数据库中分子功能、生物过程和细胞组分的数量均高于1200,Wang等[34]在研究硫酸铜对铜绿微囊藻胁迫中亦有类似结果,说明铜绿微囊藻响应类似毒物胁迫需进行一系列复杂生理过程。GO富集到的子类别主要包括催化活性、结合、代谢过程、细胞过程、膜等。拟南芥(Arabidopsis thaliana)响应镉胁迫[35],茶树(Camellia sinensis) 响应高温胁迫均有相似结果[36]。可见,无论是高等植物还是微藻,应对胁迫均有相似的响应机制。许多研究报道了化感抑制效果对膜的损伤,大麦(Hordeum vulgare)秸秆浸出液可有效破坏铜绿微囊藻的细胞膜[37],邻苯二甲酸二丁酯导致短裸甲藻(Gymnodinium breve)发生氧化应激而膜脂过氧化[38],本研究GO分类富集结果显示,大量与生物膜相关的功能基因富集到一起,说明铜绿微囊藻的生物膜受到了滤液影响,与波吉卵囊藻胞外滤液可破坏铜绿微囊藻膜结构结果相吻合[18]。
KEGG路径数据库可整合大量生物学途径路径图,代表目前学术研究对代谢、遗传和环境信息处理、细胞过程等分子相互作用和反应网络的认识[23],广泛应用于富集通路分析。本研究中,富集到代谢功能的通路占比最高,其中氧化磷酸化最显著,与Wang等[34]结果相似。氧化磷酸化是一种代谢途径,其中细胞使用酶氧化营养物质,体内物质氧化过程所释放能量提供了合成ATP的偶联反应过程ADP和无机磷酸盐[39]。这种代谢途径在真核生物发生线粒体中,原核生物则发生在浆膜上,比其他厌氧糖酵解等发酵过程更有效释放能量,因此氧化磷酸化过程存在于大多数需氧生物[40-41]。虽然氧化磷酸化途径是代谢的主要部分,但它会产生活性氧(ROS),导致自由基增殖,破坏细胞,导致衰老和疾病[42]。富集到氧化磷酸化中的基因,20个上调,6个下调,上调基因多,其中与ATP合成酶有关的基因均显著上调。ATP合成酶是氧化磷酸化最后一步,也是产生ATP的关键步骤[43]。说明铜绿微囊藻在胁迫环境下提高了氧化磷酸化功能,提升了ATP合成效率,更有效获得能量,以保证正常生命活动;另一方面铜绿微囊藻也可能因此受到氧化损伤。谷胱甘肽(GSH)是一种极重要抗氧化剂,可清除生物体内多余氧自由基,保护细胞膜防止膜脂过氧化[44]。ABC转运蛋白可利用ATP水解产生的能量协助细胞排出胞内有毒物质和废物,有助于细胞抵抗氧化胁迫[45]。本研究中,谷胱甘肽通路富集程度高,ABC转运蛋白相关基因差异表达显著,说明铜绿微囊藻可能正在面临氧化损伤的威胁。光合作用是微藻最重要的生理生化过程之一[46]。Wang等[34]发现,在硫酸铜胁迫下,铜绿微囊藻细胞可调控大量与氧化磷酸化和光合作用有关的基因。本研究也出现相似结果,但是光合作用通路的显著性小于氧化磷酸化。张礼[47]通过分析通路富集情况,认为银离子对斜生栅藻(Scenedesmus obliquus)光合过程的影响明显大于氧化磷酸化。本研究结果则相反,波吉卵囊藻滤液对铜绿微囊藻的氧化磷酸化影响更大。
当氧化应激发生时,呼吸链中复合物Ⅰ、Ⅱ、Ⅲ和Ⅳ的基因表达量和活性均受影响,其中复合物Ⅰ、复合物Ⅱ和复合物Ⅲ均为ROS的重要来源,复合Ⅳ则不会直接产生ROS[27,48]。本研究中,复合物Ⅰ的ND3、NDUFS2等基因显著上调,仅NDUFV2、NDUFS1、NDUFV1下调,复合物Ⅱ的SDHA、SDHB下调。其中上调的NDUFS2、NDUFS3是铁硫蛋白亚基,铁硫蛋白对维持呼吸链中电子传递功能稳定有重要作用,同时在各物种中比较保守[49]。黄德玉[49]报道,在T-2毒素诱导24 h的GH3细胞中,NDUFS3及多数呼吸链亚基表达显著增加,与本研究结果相似。这是因为ROS的增加可激活解偶联蛋白2表达,减少ROS含量[50]。呼吸链复合物Ⅱ在三羧酸循环和呼吸电子传递链中发挥关键作用,其中SDHA、SDHB与ROS的产生有关,SDHA突变会导致复合物Ⅱ下降,引起ROS上升[51-52]。此外,SDH活性可一定程度上反映细胞代谢水平[53]。赵文鹏[54]研究显示,过量氟暴露会诱导ROS大量累积,干扰小鼠卵巢组织中NDUFV2、SDHA的表达,引起呼吸链损伤。本研究出现相似结果,说明波吉卵囊藻滤液可能诱导铜绿微囊藻产生过量的ROS,造成氧化损伤。
抗氧化酶系统是化感物质的主要作用靶点,抗氧化系统损伤往往引起膜损伤及光合损伤一系列连锁反应[55-56]。结合Wang等[18]的研究,推测波吉卵囊藻滤液可能刺激了铜绿微囊藻的氧化磷酸化途径,在胁迫状态使其产生过量氧自由基,引起抗氧化酶系统损伤,抑制其生长。生物间相互作用机制极为复杂,本研究是在转录水平对波吉卵囊藻抑制铜绿微囊藻作用机制的初步探索。转录水平的基因表达并不能代表该基因的具体功能,需要由基因编码的蛋白质水平体现[23]。本研究所得转录组数据可结合蛋白组学、代谢组学进行进一步研究,从而更深刻地剖析波吉卵囊藻对铜绿微囊藻的抑制机理,并应用于蓝藻防控工作。
