分析化学课程融入思政元素的若干探索
2021-04-10甘峰朱芳
甘峰,朱芳
中山大学化学学院,广州 510275
中国特色社会主义高等教育的一个重要目标是培养社会主义的合格建设者和接班人。为了实现这个目标,在高等教育中加强学生的思想政治教育就是一件非常重要的工作。随着中国的改革开放日益扩大,国外的多元化思想也通过各种渠道进入到了国内,对于高校学生的思想政治观念产生了巨大的影响。鉴于此,2005年3月9日,中宣部和教育部就印发了加强和改进高等学校思想政治理论课的指导意见,明确要求高等院校加强学生的政治思想教育[1]。习近平总书记敏锐察觉到当今之世界正面临百年未遇之大变局,两次在重要场合对高等院校政治思想工作做出新的指示[2,3],不但要求提升政治思想课的教学水平,还要求“其他各门课都要守好一段渠、种好责任田,使各类课程与思想政治理论课同向同行,形成协同效应。”为了更好地贯彻党中央的重要指示,教育部专门发布了《高等学校课程思政建设指导纲要》,对于专业课程教学中如何引入思政元素给出了详细的指导[4]。由此可以看出,我国对于思想政治教育的重视程度达到了一个前所未有的高度。对于专业课教学而言,如何在讲授专业知识的同时融入思政元素,就是每个专业课教师必须思考和探索的课题。
分析化学是高校教学内容体系中的一门重要基础课程,许多专业都将分析化学课程作为专业必修课或选修课,学生受众非常广,分析化学的教学课堂因而也是进行思政教育的一个重要阵地。各高校或专业讲授分析化学课程的教学时间会有不同,一般都在一、二年级完成。这个时期的学生处于一个非常特殊的状态,一方面他们已经学习了相关的思想政治课程,另一方面他们又可以从各种渠道广泛接触到各种媒体信息,各种观念对于他们的思想造成反复的冲撞,因而这个时期如何延续思政教育对于学生形成正确的思想观念至关重要。所以,如何在这个时期的分析化学课程教学过程中融入思政元素,如何引导学生沿着正确的世界观方向继续发展就显得非常的重要。从文献调研的情况看,在分析化学教学中融入思政元素的探索工作也是在近年才展开[5-9],还有许多工作需要去做。
本文的目的是探索在分析化学教学过程中如何融入思政元素。与以往工作的不同之处是,作者拟从酸碱滴定法、配位滴定法和滴定终点误差计算式三个方面来探索如何引入思政元素,从而实现从专业知识体系内涵的深度发掘和知识体系的创新来达到思政教育的目标。
1 酸碱滴定法中的两个课程思政元素
1.1 从共轭酸碱定义的深度剖析提升学生的认知水平
1923年,布朗斯特(N.Brønsted)提出酸碱质子理论,定义酸是质子的供体,碱是质子的受体。酸给出质子后变成了它的共轭碱,碱接受质子后变成了它的共轭酸。这个定义的出现是为了解决阿伦尼乌斯(S.A.Arrhenius)提出的酸碱电离理论的不足而提出的一个新的酸碱定义。酸碱电离理论的框架中,把电离出的阴离子全部都是OH-的物质定义为碱。然而,越来越多的化学事实证明,很多的物质会导致其水溶液中OH-的增加,但是这种增加不是该物质电离出OH-,而是因为它们夺取了水中的氢离子,由此导致水溶液中的OH-的增加。
布朗斯特的酸碱定义放弃了以物质释放出氢离子或氢氧根离子的方式来定义酸或碱,而是从释放或得到氢离子的角度来重新定义酸或碱。从文字上看虽然平平淡淡,但是这个定义却蕴含着把酸和碱看作是辩证统一体的这样一种思想。在酸碱质子理论的框架下,酸与碱可被视为是同一物质的两种表现形式,它们借助于氢离子作为纽带进行转化。实际上,基于酸碱质子理论,可以得到一个学生们熟知的式子(式(1))。(本文出现的式子,非必要时不做额外解释。下同。)

式(1)表明,Ka和Kb两个参数其实只需要一个就足够了,这也是我们需要向学生强调的一个关键点。这个结果究竟意味着什么呢?更进一步的思考可以发现,酸碱质子理论实际上包含了更深一层的涵义:酸与碱只是在释放氢离子的能力方面存在差异。基于这层涵义,可以要求学生从酸的角度去看待物质,对于学生认知能力是一个挑战。但是,如果学生一旦深入领会到了这一层涵义,对于他们在后续内容的学习方面就会起到巨大的帮助。为了让学生更好地理解这一思想,我们直接给出氨的水溶液中两种型体的分布分数计算式,如下:

我们在给出这两个式子时,不解释这个溶液体系是来自于氨气溶于水中,还是铵盐在水中解离。只是让学生从共轭酸碱体系中的型体在释放质子的能力方面去分析和思考这两个式子。同时,我们布置一道作业,让学生从NH3的Kb值去建立氨溶液体系中各型体的分布分数,并转化为式(2)和式(3)。这样一来,可以让学生带着疑惑进行思考,最终提升学生对于共轭酸碱理论的认知水平。
1.2 从酸碱滴定通式的建立过程领会从量变到质变
酸碱滴定方程描述滴定过程中随着滴定剂的加入体系中pH的改变,酸碱滴定法根据滴定过程中pH的突变位置进行定量分析。所以,酸碱滴定方程的建立和滴定曲线的计算是酸碱滴定法教学内容体系中的核心内容。国内外的许多学者在建立酸碱滴定方程方面做了大量的工作,其中以德勒维(R.de Levie)[10]建立的酸碱滴定通式达到一个相对完美的境界。德勒维建立的酸碱滴定通式如下:

这里,下标t表示滴定剂;下标s表示样品;Δ = [H+]- [OH-];η = Vt/Vs;F是质子结合(或解离)函数,它是与溶液中的型体的分布分数相关的量,反映出得失质子的能力。
这个滴定方程在数学上是非常优美的,因为如果不区分下标,则分子项和分母项完全一样!分子项和分母项究竟放入什么物质,并无特殊的限制,只是在F函数的计算上按照一定的规则进行即可。然而,令人感到不解的是,如此优美的数学表达式自1996年建立起来之后,一直都没有进入到国内外的主流分析化学教材中。国内只有本文作者之一甘峰[11,12]将酸碱滴定通式引入到教学内容体系之中,这是符合“守正和创新相统一”的要求的。
在教学的过程中,我们首先把上述的问题提出来,让学生们思考。然后,我们针对有代表性的滴定体系,采用从易到难的方式推导出相应的滴定方程。例如,用氢氧化钠溶液分别滴定盐酸、醋酸和磷酸时,可以从质量平衡和电荷平衡建立相应的滴定方程,它们如下:
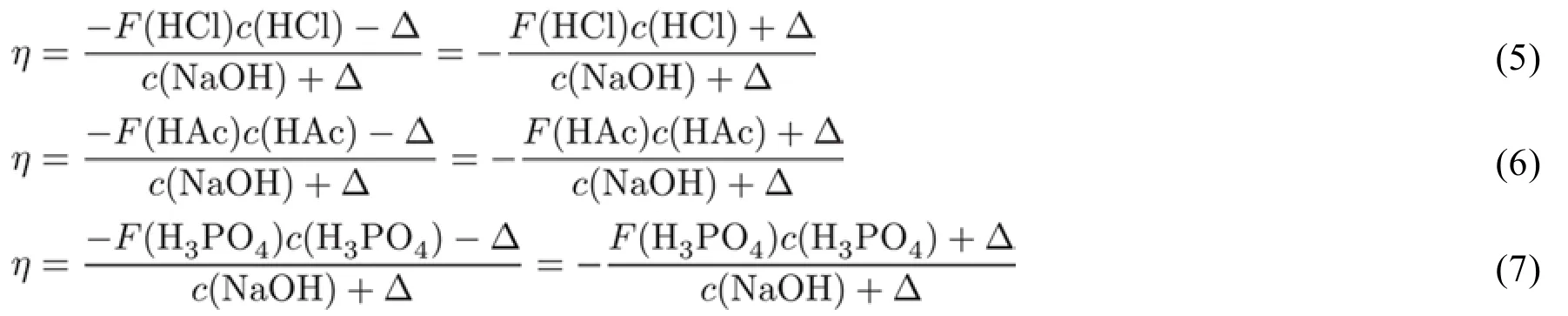
从式(5)至式(7)的建立过程中,学生会发现:看似复杂的体系,居然有着非常简洁的滴定方程。并且,这些滴定方程有着这两个共性:(1)作为滴定剂的氢氧化钠总是在分母项;(2)分子项都是酸的分析浓度乘以一个F函数并加上Δ项。这种由简到难的过程,一方面可以消除学生的畏难情绪,另一方面也可以激发挑战更为复杂体系的欲望。
在上面的基础上,我们再度增加难度,提出这样一个问题:如果用氢氧化钠溶液滴定由盐酸、醋酸和磷酸构成的混合酸,滴定方程应该有怎样的形式?当然,在课堂上可以推导出这种情况下的滴定方程为:
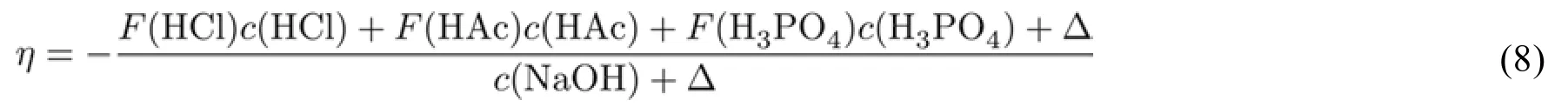
式(8)又包含怎样的内在涵义呢?它意味着在滴定过程中,混合体系中每个组分都是独立的项。类似地,如果用混合碱滴定混合酸体系,那么分母项也会是混合碱中各组分的独立的项的加和。德勒维正是在这样的思维基础上,直接给出滴定通式(4),由此实现从量变到质变的一个突跃。在教学过程中,要让学生充分领会到这个量变到质变的过程,不是简单的堆积实例,而是在对于共轭酸碱概念的深入理解,以及正确地认识到酸与碱是辩证统一体的基础上升华实现的。借助基于酸碱滴定通式开发的辅助教学工具[13],学生可以对各种复杂的体系进行学习和研究,对于酸碱滴定方法的技术细节有更为深入的理解。这样的教学途径,对于学生而言不但是一个知识进步的过程,也是一场思维洗礼的过程。
2 配位滴定法中的两个课程思政元素
2.1 对配位滴定体系主、副反应泛化处理以消除思维桎梏
配位滴定法是较酸碱滴定法更为复杂的一类方法,原因在于该类方法所涉及的影响因素太多,且理论体系并不完善,常常使得学生感到难于把握。例如,一个最基本的问题是配位反应体系中主、副反应的划分方式,从形式上似乎合理,但是从逻辑上看又存在难于逾越的困境。图1所示是我们在教学过程中所使用的主、副反应划分方式[12]。

图1 配位滴定法主、副反应示意图
图1中所示的主、副反应划分方式与当前国内外主流分析化学教材不同,我们有意将EDTA与其他金属离子的副反应忽略掉了。我们之所以采用这样的做法,目的是为了消除经典教学内容体系中存在的逻辑缺陷。原因在于,其他干扰金属离子固然会在滴定过程中争夺EDTA因而表现为副反应,但是设定为主反应的金属离子也会与其他干扰金属争夺EDTA,故相对于其他干扰金属离子,它也是副反应,由此陷入了逻辑循环。更糟糕的情况是,滴定过程中所有金属离子的浓度实际上都发生改变,这就使得副反应系数本身成为一个变量而不是固定值,从而难以准确地描述副反应的影响程度。这类问题在教学过程中常常有学生提出来,如果不能把这些问题阐述清楚,就无法让学生对配位滴定法的理论体系获得正确的认知。
打破这个逻辑循环的一个简单做法就是如图1所示,放弃将EDTA与其他金属离子的反应作为副反应这一划分方式。这样的做法从表面上看似乎不合理,但是实际上又蕴藏着合理的成分,因为它符合EDTA与所有金属离子都会发生很强的配位反应这一事实。通过这种“分析问题、思考问题”的方式,而不是回避学生发现的问题,才能以隐性的方式实现思政教育之目的。在后面建立配位滴定通式的过程中,学生将会看到,这种对于副反应的泛化处理,拓展了配位滴定理论体系的疆界。
2.2 以配位滴定通式的建立过程激发学生的“创新意识”和“文化自信”
本文作者之一甘峰[11]在编著《分析化学基础教程》一书时,首先撰写的是酸碱滴定法这一章,紧接着开始撰写配位滴定法这一章的内容。由于酸碱滴定通式的优美性和有效性一直感染着作者,促使作者思考能否为配位滴定建立一个通式。最终经过深入的研究建立了基于EDTA的配位滴定通式[14],如式(9)、式(10)所示(注:按照新版教材重新表达[12]):
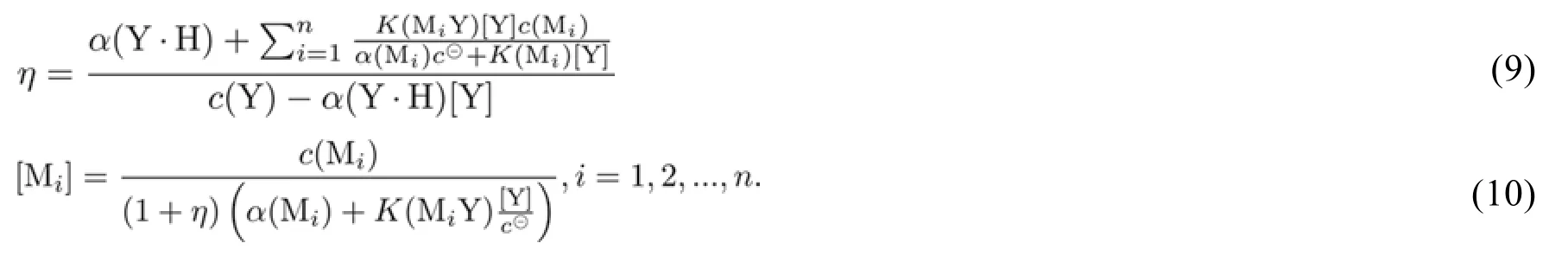
式(9)和式(10)共同构成配位滴定通式,理论上可以计算EDTA通式滴定任意多个金属离子的情形。配位滴定通式之所以能够建立,其中一个重要的条件是泛化了主、副反应的处理方式。而配位滴定通式的建立,又为学生深入理解配位滴定的详细过程提供了条件。图2和图3所示分别为用EDTA滴定铜、锌离子构成的混合体系的滴定曲线和形成的配合物的浓度变化曲线。
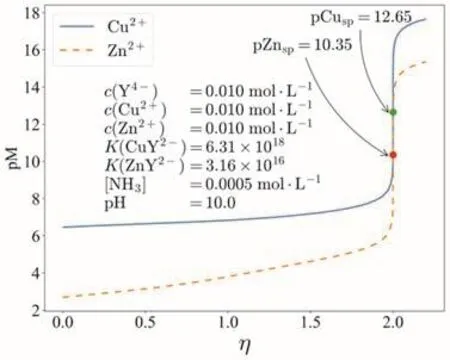
图2 EDTA滴定铜、锌离子混合溶液的滴定曲线
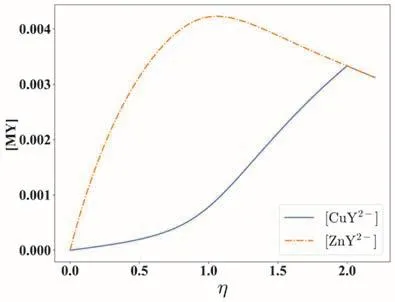
图3 滴定中形成配合物的浓度变化曲线图
由于铜离子与EDTA的标准形成常数大于锌离子与EDTA的标准形成常数,正常情况下应该是优先滴定铜离子。但是,当前的外部条件发生了改变:溶液中存在氨。氨可以与铜、锌离子形成配合物,它使得整个反应体系发生了主、次易位。图3的结果也表明锌离子与EDTA的配合物优先形成。这个例子表明,配位滴定通式的建立,让我们有了更好的分析配位滴定体系的理论工具。类似的例子在新版的教科书中有很多[12],限于篇幅不一一列举。这个理论是由中国人建立的,它改变了当前分析化学教科书中的内容多为外国人所建立的这样一种状况,是让学生形成“文化自信”的一个很好的示例。
实际上,配位滴定通式的作用远不止此。从图3可以看到,配合物ZnY2-的浓度最大值在化学计量点的附近,大量的计算均表明类似的规律总是出现。在10多年前,本文作者之一甘峰就关注到这一规律可用于定量分析[15],并进行了长期的思考和研究,最终在2020年发表了另一篇科研论文[16],建立了基于仪器分析的绝对定量分析的数学理论。这一工作表明,中国人不但有能力建立起原创性的配位滴定教学内容,也有能力建立起原创性的科研工作。这种从教学到科研的贯通过程,显然可以成为激发学生更加重视教学内容学习的一个很好的示例。
3 滴定终点误差计算式中的课程思政元素
分析化学中滴定终点误差的计算非常重要,它用于衡量一个滴定方法的准确度。一个滴定方法的终点误差只有在一个可接受的范围内,这个方法才有实用价值。当前国内的分析化学教材中绝大多数使用林帮公式计算终点误差[17]。但是,从我们所能找到的欧美的一些主流分析化学教材中却看不到林帮公式的身影,这不但困扰着教师,也困扰着学生。在教学领域,国内一直提倡与国际接轨,但是为什么在计算滴定终点误差计算方面又与国际脱轨呢?这背后的真相究竟是什么?谁是真理,谁是谬误!不仅教师应思考,学生也时常会问到。而教师的回答正确与否,对于学生真理观的形成显然有极大的影响。
实际上,在分析化学教学界对于林帮公式一直有质疑之声。例如,毕凤丽等[18]质疑林帮公式推导过程采用了近似处理,因而自身就是一个近似公式。邵利民[19,20]质疑其计算上的复杂性,提出以滴定的化学计量点和终点时的体积值计算终点误差,该法实际上也是国外主流分析化学教材中普遍采用的方法。但是,仅仅从林帮公式的近似性以及计算过程的复杂性进行质疑,显然不能从根本上揭示林帮公式的对错问题。
2019年,本文作者发表了一篇论文,对林帮公式再度进行讨论[21]。本文作者的做法是直接以终点误差的主流定义为基准,从数学上揭示林帮公式的本质。滴定终点误差的主流定义如下:

林帮的滴定终点误差计算式及其展开过程如下:
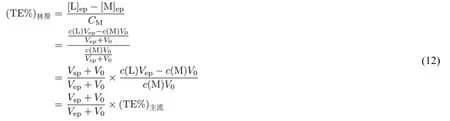
从式(12)的结果可以看到,由于Vep≠ Vsp,所以林帮公式从数学上就偏离主流的终点误差计算结果。这个结果表明,如果我们接受主流的滴定终点误差定义,那么选择林帮公式作为计算滴定终点误差的做法就是不合适的。并且,如果再考虑到林帮公式在建立过程中还采用了近似处理[17],则林帮公式的真理性是完全值得怀疑的。以严格的数学推理的方式来回答林帮公式的真理性问题,暗合了马克思所说的:“理论只要彻底,就能说服人。”相较于其他的做法,式(12)显然更具有说服力,更容易被学生所接受。
从式(12)的推演过程来看并不复杂,只需具有中学数学知识就可以做到。在课堂上强调这一点非常重要,如此才能让学生体会到否定前人提出的理论有时候并不需要很高深的知识,也才能起到打动学生和引导学生的效果,实现在显性地讲授专业知识的同时,以一种隐性的方式培养学生敢于挑战现有的理论知识体系的勇气和信心,为他们未来从事创新性研究奠定思想基础。
4 结语
本文以三个方面的实例对于分析化学教学中引入思政元素进行了初步的探索。从中可以看到,教学内容体系自身及其发展过程其实就蕴含着许多的思政元素。要达到好的思政教育效果,挖掘当前知识体系的内涵是很重要的一个方面,而“及时更新教学内容、丰富教学手段”也是非常重要的一个方面。酸碱滴定通式的引入和配位滴定通式的引入,是在原有教学内容体系的基础上对于相关知识的深入推进和拓展,它以启发学生进行辩证思考的方式使学生掌握滴定方程的建立方法。而对林帮公式的再度讨论,则是启发学生理性分析现实问题。我们相信,通过从教学内容中发掘思政元素,是可以实现专业课教学与思政教育同向同行,互相促进,实现“立德树人”之最终目标。
