‘凤丹白’成熟胚愈伤诱导、增殖及组织学观察
2021-04-10,,,,,
,, ,,,
(上海市农业科学院 a.林木果树研究所;b.上海市设施园艺技术重点实验室,上海 201403)
‘凤丹’Paeonia ostii为原产我国的芍药属名贵花卉,栽培历史悠久,集观赏和药用价值于一身,素有“花中王后”的美誉。‘凤丹’籽油分含量高,可食用,因富含亚麻酸等对人体健康有益的不饱和脂肪酸,具增强人体免疫力和延缓衰老等保健功能[1]。目前,我国牡丹产业蓬勃发展,对于新优品种的需求与日俱增,然而牡丹育种技术单一落后,多采用传统杂交育种,无法满足市场需求。利用先进的转基因、基因编辑技术进行新优品种选育是牡丹产业发展的方向,而这些技术的应用均依赖于高效诱导与再生体系的建立。
高等植物再生主要包括组织修复(tissue repair)、器官发生(organogenesis)和体细胞胚胎发生(somatic embryogenesis)[2]。体细胞胚胎发生一般是指在未经生殖细胞融合的情况下植物体细胞模拟合子胚胎发生发育形成完整新个体的过程,是诱导植物细胞实现全能性的一种形式。20 世纪90年代,Sangwan 等[3]和Wu 等[4]报道了以拟南芥未成熟合子胚作为外植体诱导产生胚性愈伤组织,进而诱导体细胞胚胎发生。之后,在较多木本植物中也成功诱导了体细胞胚胎发生。在体细胞胚胎诱导过程中,植物激素起非常重要的作用,通常用生长素类似物(如2,4-D)等处理后,可观察到愈伤组织和胚性细胞团的产生[5]。近年来,毒莠定(Picloram,PIC)、麦草畏(Dicamber,DIC)等生长素类除草剂也被用于植物体细胞胚再生的相关研究中,并取得较好的效果。国内外关于牡丹组织培养及再生相关研究已有报道,主要涉及快繁体系的建立和优化[6-9],以合子胚为外植体的愈伤组织再生技术体系的建立[10],以鳞芽为外植体建立快繁体系[11],诱导外植体愈伤组织[12-16],通过茎尖培养获得再生苗[17],减轻牡丹愈伤褐化现象发生[18-19],促进生根[20]等方面。关于牡丹体细胞胚胎发生途径的研究报道相对较少。殷丽青等[21]以牡丹品种‘凤丹’的不同外植体为材料,研究了不同浓度PIC 对愈伤组织及体细胞胚胎发生的影响,并建立了牡丹高频体细胞胚发生体系,但获得的再生植株较少。朱向涛等[22]建立了‘凤丹’的体胚诱导技术体系,但诱导率仅38.33%。秦磊等[23]开展了牡丹‘Golden era’愈伤组织发生和分生结节形成的细胞组织学研究。虽然关于牡丹组织培养再生体系已有一定的研究基础,但是仍存在愈伤分化率低、极易褐化、生根困难等难题,再生效率和生根率等有待提高,而且目前完整的再生体系成功应用于转基因的研究鲜见报道。‘凤丹白’为江南牡丹群‘凤丹’的系列品种之一,本研究中以‘凤丹白’成熟的合子胚为试验材料,通过摸索适宜的植物生长调节剂及其浓度,建立愈伤组织诱导及增殖技术体系,并对不同状态的愈伤组织开展形态学和组织细胞学鉴定,确定具分化潜能的胚性愈伤组织,旨在为牡丹再生技术体系的建立提供参考。
1 材料与方法
1.1 试验材料
单瓣白花‘凤丹白’成熟种子由武汉市农业科学院林业果树科学研究所提供。
1.2 试验方法
1.2.1 愈伤组织诱导培养
选取健康饱满的‘凤丹白’成熟种子,用洗涤剂清洗表面,流水冲洗30 min,无菌水中浸泡2 ~3 d 后进行消毒。在无菌环境下先将种子用70%的酒精浸泡30 ~60 s,再用10%的次氯酸钠表面消毒30 min,无菌水冲洗6 次,无菌滤纸吸干备用。用手术刀切开种子,剥取成熟胚接种于愈伤诱导培养基。
在改良MS 培养基(按WPM 培养基添加硝酸钙)中添加0.5 g/L 水解酪蛋白(购自上海宇涵生物技术公司)和生长调节剂作为愈伤组织诱导培养基。其中,生长素类生长调节剂包括PIC、DIC、2,4-D、NAA,细胞分裂素类生长调节剂包括6-BA、TDZ、KT,均购自Sigma 公司,各处理中植物生长调节剂种类及其质量浓度配比见表1。用NaOH 将培养基pH 调为5.8±0.1,121 ℃灭菌20 min。每个处理接种3 瓶,每瓶接种10 个外植体,每个处理重复3 次。培养温度为(25±2)℃,黑暗条件下培养,并观察愈伤组织诱导情况,30 d后统计成活率和愈伤组织诱导率。
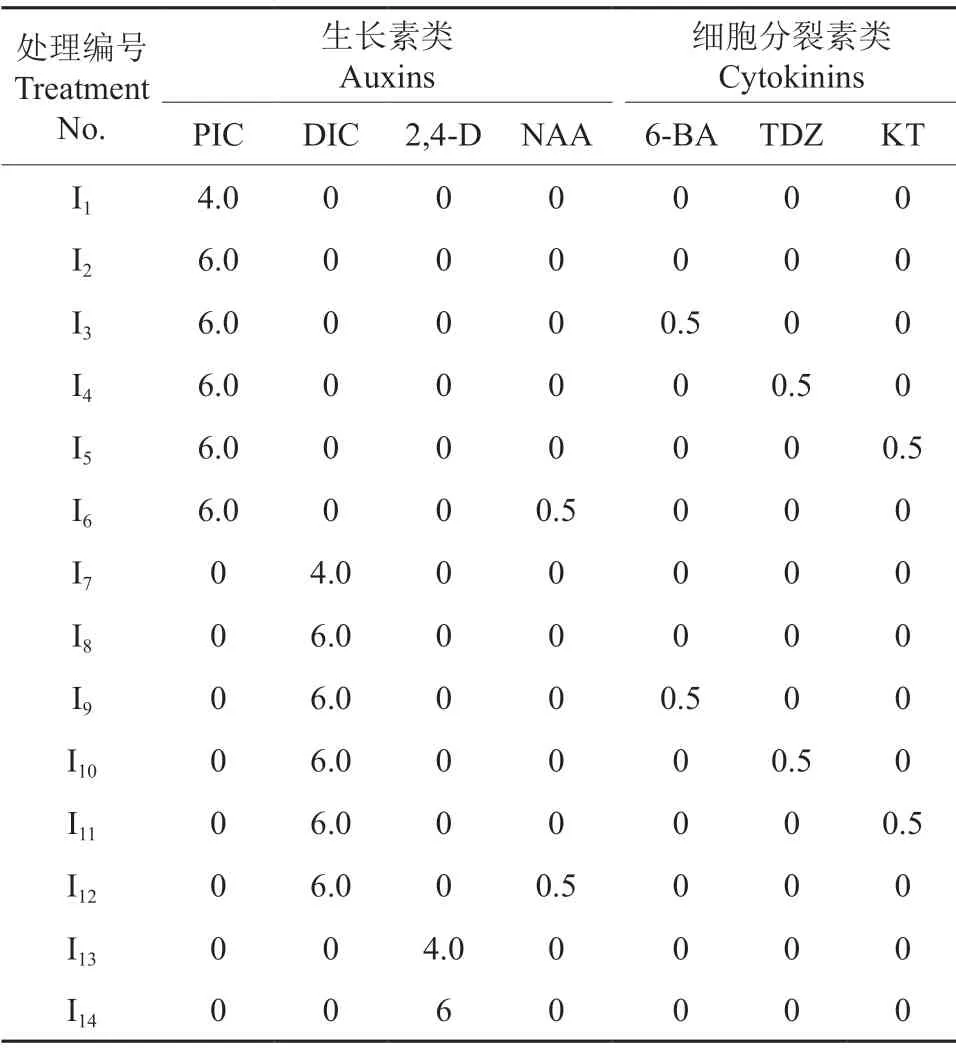
表1 ‘凤丹白’成熟胚愈伤组织诱导培养基中植物生长调节剂的种类及其质量浓度Table 1 Types and concentrations of plant growth regulators used in callus induction medium of P.ostii cv.‘Phoenix White’ mg/L
1.2.2 愈伤组织增殖培养
将初代培养诱导的愈伤组织接种于愈伤组织增殖培养基中。除添加的植物生长调节剂外,愈伤组织增殖基本培养基与诱导培养基成分基本相同。其中,添加的生长素类包括PIC、DIC、NAA,添加的细胞分裂素类包括6-BA、TDZ、KT,均购自Sigma 公司。各处理中植物生长调节剂种类及其质量浓度配比见表2。每处理接种3 瓶,每瓶接种10 个外植体,每个处理重复3 次。培养温度为(25±2)℃,黑暗条件下培养,并观察愈伤组织增殖情况,30 d 后统计愈伤组织扩增率和扩增系数。

表2 ‘凤丹白’愈伤组织增殖培养基中植物生长调节剂的种类及其质量浓度Table 2 Types and concentrations of plant growth regulators used in callus proliferation of P.ostii cv.‘Phoenix White’ mg/L
1.2.3 愈伤组织分类和鉴定
根据继代培养后愈伤组织的生长情况、颜色、质地、形态、分散程度等对愈伤组织进行分类。将分割成小块的不同状态的愈伤组织置于体视显微镜(Nikon SMZ 745T)下观察拍照,参照文献[24]中的方法制作常规石蜡切片,并在光学显微镜(Nikon ECLIPSE E200)下采集图像信息。结合形态学特征与石蜡切片鉴定是否为胚性愈伤组织,并统计诱导率等指标。
1.3 数据分析
外植体成活率为成活的外植体数占接种外植体数的百分比;愈伤诱导率为诱导出愈伤组织的外植体数占成活外植体数的百分比;愈伤扩增率为扩增愈伤数占接种愈伤数的百分比;愈伤扩增系数为培养30 d 后外植体质量较其初始质量的增加值占外植体初始质量的百分比。
使用SPSS 16.0 软件采用单因素方差分析法(ANOVA)进行数据分析。
2 结果与分析
2.1 愈伤组织的诱导培养
将成熟胚接种于培养基培养3 d后膨大,培养5 d后子叶边缘膨松(图1A),培养9 d 后子叶边缘出现裂缝(图1B),培养14 d 后部分子叶边缘膨大形成愈伤组织(图1C),培养21 d 后2 片子叶均膨大形成愈伤组织(图1D),培养30 d 后子叶基部膨大形成愈伤组织(图1E)。部分外植体子叶边缘膨大为白色球状,后期不能继续发育(图1F)。

图1 ‘凤丹白’成熟胚在愈伤组织诱导培养基上的状态Fig.1 The status of mature embryo of P.ostii cv.‘Phoenix White’ on callus induction medium
诱导培养基中生长调节剂的配比对种胚的愈伤诱导影响较大,各培养基中‘凤丹白’成熟胚愈伤组织诱导情况见表3。由表3可知,在14种诱导培养基中,添加6.0 mg/L PIC 和0.5 mg/L NAA 的培养基中外植体成活率最高,为93.33%;添加6.0 mg/L PIC 和0.5 mg/L TDZ 的培养基中愈伤组织诱导率最高,为70.61%;添加4 mg/L 2,4-D的培养基中外植体成活率和愈伤组织诱导率均最低,且均为21.88%。诱导培养基中添加PIC、DIC、2,4-D 均能促进外植体愈伤组织的诱导,但添加PIC 和DIC 的促进效果明显好于添加2,4-D。除了生长素类物质外,培养基中添加细胞分裂素对愈伤组织的状态有影响,在添加相同质量浓度PIC 的培养基上,添加TDZ 的效果优于添加6-BA,极显著优于添加NAA 和KT。

表3 不同培养基中‘凤丹白’成熟胚愈伤组织诱导情况†Table 3 The effect of plant growth regulators on callus inductivity of P.ostii cv.‘Phoenix White’ %
2.2 愈伤组织的增殖培养
在添加不同配比的植物生长调节剂的培养基上,‘凤丹白’胚性愈伤组织的增殖情况见表4。由表4可知,添加6.0 mg/L PIC 和0.5 mg/L NAA的培养基中愈伤扩增率最高,为97.78%,愈伤扩增系数最高,为19.97。
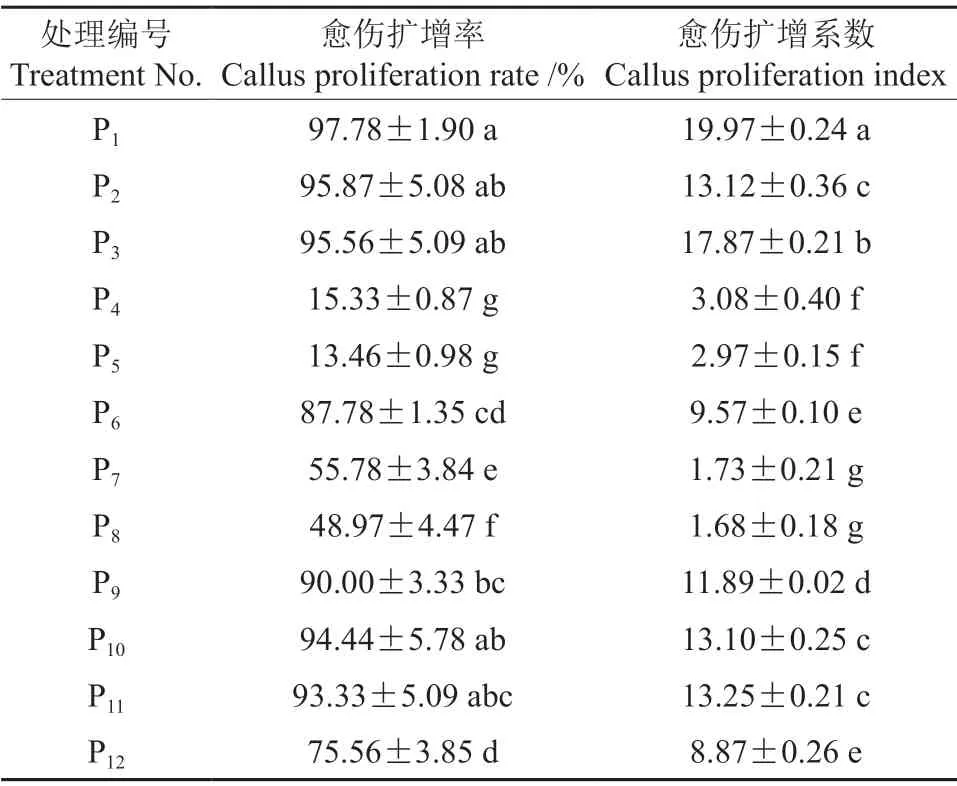
表4 不同培养基中‘凤丹白’成熟胚愈伤组织增殖情况Table 4 The effect of plant growth regulators on callus differentiation of P.ostii cv.‘Phoenix White’
在培养基中单独添加0.2 或0.4 mg/L PIC 时,愈伤扩增率分别为55.78%、48.97%,且长期培养后会出现褐化现象。在培养基中添加0.2 mg/L DIC时,愈伤扩增率为87.78%,长期培养后会出现褐化死亡。结果表明,高质量浓度的PIC 与低质量浓度的NAA 或6-BA 配合使用,利于愈伤组织增殖生长,愈伤组织胚性保持较好;培养基中添加低质量浓度的NAA、KT、PIC 和DIC,也有利于愈伤组织的增殖生长,但愈伤扩增率低于添加高质量浓度PIC 的处理;培养基中添加高质量浓度NAA 的处理中,有胚性愈伤组织分化为根的现象,培养基中添加细胞分裂素不利于愈伤组织的生长与分化。
2.3 愈伤组织的形态特征
2.3.1 外观形态特征
初代培养中诱导的‘凤丹白’成熟胚愈伤组织经继代培养2 ~3 次后,外观如图2所示。愈伤组织出现6 种形态特征:1)松散透明状愈伤组织,继代培养后仍为松散状(图2A);2)致密白色雾凇状愈伤组织,在解剖镜下观察其为颗粒状(图2B);3)绿色愈伤组织,在解剖镜下观察其为绿色颗粒状(图2C);4)致密片状愈伤组织,解剖镜下观察其为透明状细胞(图2D);5)絮状披针形愈伤组织,整体呈松软状态,部分膨大增殖,无胚性(图2E);6)透明褐色愈伤组织(图2F)。在这6 类愈伤组织中,松散透明愈伤组织的分散性最好,随着培养时长的增加不褐化,仍保持良好的胚性,可增殖;致密白色愈伤组织和致密绿色愈伤组织质地较硬,增殖较快。这3 种愈伤组织为胚性愈伤组织。絮状披针愈伤组织增殖快,质地松软;致密片状愈伤组织及透明褐色愈伤组织状态差,不增殖。这3 种愈伤组织为非胚性愈伤组织。

图2 ‘凤丹白’成熟胚愈伤组织的外观形态Fig.2 The status of subcultured callus of P.ostii cv.‘Phoenix White’ on callus proliferation medium
在添加了6 mg/L PIC 和0.5 mg/L TDZ 或添加了6 mg/L PIC 和0.5 mg/L 6-BA 的培养基上,成熟胚外植体的愈伤诱导率高,诱导效果较好,且愈伤组织扩增2 ~3 代后形成松散透明、致密白色和致密绿色愈伤组织的比例高,分别为88.89%、82.35%和63.63%。在培养基中添加其他植物生长调节剂后,愈伤组织经扩增产生致密片状、絮状披针形及透明褐色愈伤组织的比例较高,分别为70.00%、62.50%和83.30%。
2.3.2 组织细胞学形态特征
胚性和非胚性愈伤组织不但外观形态差异明显,而且其形态细胞学形态也存在明显差异,‘凤丹白’成熟胚愈伤组织的组织细胞学形态如图3所示。松散透明状愈伤组织的细胞排列较紧密,细胞染色深,细胞核小,且有明显的分生中心(图3A);致密白色愈伤组织的细胞排列紧密,细胞染色较浅,细胞核小(图3B);致密绿色愈伤组织的细胞排列紧密,细胞染色深,细胞核小,有明显的分生中心。结果表明,松散透明、致密白色和致密绿色愈伤组织的细胞为胚性细胞,有进一步分化出植株的可能。致密片状愈伤组织的细胞染色浅,无明显的胚性细胞及分生组织中心;絮状披针形愈伤组织的细胞有明显的细胞核,但细胞分散、排列不规则,无明显的分生中心;透明褐色愈伤组织的细胞染色浅,部分细胞有细胞核,且细胞核大,大多数细胞排列不规则,无明显的胚性细胞及分生组织中心。这3 类为非胚性愈伤组织,较难进一步分化出植株。

图3 ‘凤丹白’成熟胚愈伤组织的组织细胞学形态Fig.3 Histological observation of callus tissues on P.ostii cv.‘Phoenix White’
3 结论与讨论
本试验中研究了不同的植物生长调节剂种类及其质量浓度对‘凤丹白’成熟胚愈伤组织增殖的影响,结果表明不添加植物生长调节剂的培养基上愈伤组织易褐化,添加少量NAA 易使胚性愈伤组织发育为根,极少分化出芽,添加高浓度的生长素PIC 和少量细胞分裂素容易使愈伤组织增殖,这一研究结果与张建伟等[25]对粗枝云杉的研究结果一致。诱导14 d 后,成熟胚开始形成愈伤组织,PIC 和TDZ 为适宜‘凤丹白’成熟胚愈伤组织诱导和扩增的生长调节剂,继代培养后松散透明、致密白色和致密绿色的愈伤组织具有分化潜能。
3.1 植物生长调节剂对成熟胚愈伤组织的诱导与增殖的影响
植物生长调节剂是诱导木本植物(如樟树[26]、冬青[27]等)外植体形成愈伤组织的关键因素,应用于愈伤组织诱导的植物生长调节剂的种类越来越多。PIC 是一种化学结构类似于2,4-D 的除草剂[28],目前已被广泛应用于球根类植物胚性愈伤组织的诱导,且已取得良好效果[29-31]。DIC 是一种安息香酸系的除草剂,近年来也开始被应用于植物愈伤组织的诱导[32-33]。本试验中研究了培养基添加PIC 或DIC 对成熟胚愈伤组织诱导效果的影响,结果表明培养基中添加这2 种植物生长调节剂对牡丹成熟胚愈伤组织的诱导效果均优于添加2,4-D,胚性愈伤组织诱导率高,胚性好。殷丽青等[21]报道,在添加4.0 mg/L PIC 的培养基上,‘凤丹’幼胚的愈伤诱导率达98.1%,效果优于2,4-D,与本研究结果一致。本研究中培养基添加DIC 后的愈伤诱导率略低于添加PIC,但诱导效果的差异不显著,说明除了PIC 外,DIC 也适用于牡丹成熟胚外植体愈伤组织的诱导。高浓度的生长素类和细胞分裂素类植物生长调节剂共同添加能显著提高‘凤丹白’的愈伤诱导率。TDZ 是一种人工合成的植物生长调节剂,具有细胞分裂素和生长素的双重功能,在植物体内较为稳定,比BA 活性高[34-35]。本研究中,在牡丹愈伤组织诱导培养基中添加TDZ 较添加6-BA 和KT 这2 种细胞分裂素有更好的效果,与Zheng 等[36]在大蒜愈伤组织诱导研究中得出的结果一致。
3.2 愈伤组织解剖结构
植物体细胞胚间接发生途径一般是体细胞经过重编程后形成胚性愈伤组织,再从愈伤组织中的胚性细胞分化形成体细胞胚。一般情况下,诱导体细胞胚产生的胚性愈伤组织从中柱鞘细胞和非中柱鞘类细胞发育而来,胚性愈伤组织形成后,其表面或内部产生由分裂旺盛、排列相对紧密的小细胞组成的胚性细胞团[37]。而非胚性愈伤组织的构成细胞一般大小不一致,细胞质稀,液泡较大,细胞分化能力差。
本研究中,牡丹愈伤组织经继代培养后出现不同的颜色和质地,组织学鉴定结果表明有的为胚性愈伤组织,有的为非胚性愈伤组织。在培养基中同时添加PIC 和细胞分裂素类植物生长调节剂,更容易诱导出具有再生潜能的胚性愈伤组织。在添加了6.0 mg/L PIC 和0.5 mg/L TDZ 或添加了6.0 mg/L PIC 和0.5 mg/L 6-BA 的培养基上,成熟胚外植体的愈伤诱导率高,诱导效果较好,且愈伤组织扩增2 ~3 代后形成松散透明、致密白色或致密绿色愈伤组织的比例高。在培养基中添加其他植物生长调节剂后,愈伤组织经扩增产生致密片状、絮状披针形及透明褐色愈伤组织的比例较高。在仙客来[38]和朱顶红[39]等植物的研究报道中也存在类似现象。
非胚性愈伤组织与胚性愈伤组织之间可以相互转换,其取决于所添加植物生长调节剂的种类及其浓度和愈伤组织本身的状态,只有具胚性的愈伤组织才可能分化出体细胞胚或再生植株。因此,对愈伤组织进行组织形态学鉴定有利于筛选可分化的组织材料。为实现不同类型胚性愈伤组织再生能力的早期鉴定,缩短不同品种牡丹再生体系建立的周期,下一步拟观察统计胚性愈伤组织成苗率,并进行不同类型愈伤组织的转录组分析,尝试开发与愈伤组织胚性和再生潜能相关的分子标记,并从分子水平阐明植物生长调节剂和培养基添加物促进胚性愈伤组织诱导的机制。
