荧光假单胞菌的溶磷机制及其在杨树菌根际的定殖动态*
2021-04-10吴小芹叶建仁
刘 辉 吴小芹 叶建仁 陈 丹
1.南京林业大学林学院 南方现代林业协同创新中心 南京 210037; 2.安徽师范大学生态与环境学院 芜湖 241002)
土壤磷素存量大,但其中约95%不能被植物直接吸收利用,溶磷微生物(phosphate-solubilizing microorganisms, PSM)是一类参与土壤磷循环的重要微生物类群,其可将土壤磷库中的难溶性磷酸盐转化为可溶性磷,从而显著提高土壤有效磷含量,促进植物生长和发育(Kuceyetal., 1989; 陈哲等, 2009)。目前,学者们已对 PSM 的种类、溶磷能力和应用效果等开展了广泛而深入的研究(Oliveriaetal., 2009; Wangetal., 2017; Chenetal., 2019)。有研究发现,许多在离体条件下表现出明显溶磷能力的 PSM 在实际应用中效果并不理想(Collavinoetal., 2010; 张英等, 2015)。影响 PSM 应用效果的因素很多,分析其原因主要有2方面: 一方面是由于 PSM 种类较多,溶磷过程十分复杂,其潜在机制也因 PSM 种类和菌株不同而有所区别(Antoun, 2012),当前对 PSM 溶磷机制认识的局限性制约了该类菌肥的研发和推广应用进程; 另一方面是由于磷在土壤中的移动性较小,PSM 释放到土壤中的磷必须在植物可以吸收的范围内(根际)才能被利用(朱培淼等, 2007)。Gupta 等(2011)研究发现,产气肠杆菌(Enterobacteraerogenes)10208 的溶磷能力是唐菖蒲伯克氏菌(Burkholderiagladioli)10216 的 13.8 倍,但对甜叶菊(Steviarebaudiana)促生效应和地上部磷吸收量之间的差异并不显著,分析其原因发现可能是 10216 菌株在甜叶菊根际定殖数量比 10208 菌株高1个数量级造成的。可见,PSM 能否在植物根际成功定殖也是影响其应用效果的关键因素(Mamtaetal., 2010)。在自然和半自然生态系统中,植物的根部常常被菌根真菌侵染,根际的概念已扩大到包括菌根真菌部分而被称作菌根际(Mycorrhizosphere)(Johanssonetal., 2004)。据报道,PSM 和菌根真菌在磷素资源可持续利用方面具有重要作用,但只有PSM 在植物根际或菌根际高效定殖才能达到更好为宿主植物提供有效磷的目的(Antoun, 2012)。因此,在评价 PSM 的应用潜力时,其与菌根真菌的相容性问题不容忽视。
笔者课题组前期研究发现,荧光假单胞菌(Pseudomonasfluorescens)菌株JW-JS1和红绒盖牛肝菌(Xerocomuschrysenteron, Xc)共接种对NL-895杨(Populus×euramericanacv. ‘Nanlin-895’)的生长、光合效应、氮代谢、矿质元素含量、土壤酶活性和微生物多样性等的影响均表现出显著的正交互效应(姚如斌等, 2012; 刘辉等, 2018; 2019),但关于JW-JS1菌株的溶磷机制及其在杨树根际和菌根际的定殖动态尚不明确。鉴于此,本研究以荧光假单胞菌菌株JW-JS1和红绒盖牛肝菌 Xc 为研究对象,通过分析JW-JS1菌株溶磷能力与pH、可滴定酸含量以及有机酸种类和含量的关系,初步揭示其溶磷机制, 利用抗利福平标记筛选稳定的标记菌株,采用灌根法对其在杨树根际和菌根际的定殖动态进行深入研究,进一步揭示溶磷细菌与外生菌根真菌的互作机制,以期为杨树专用复合菌剂的开发与应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 溶磷细菌: 荧光假单胞菌菌株JW-JS1,从杨树根际土壤中分离筛选获得(Liuetal., 2011),保藏于中国典型培养物保藏中心,编号CCTCC M 209027; 外生菌根真菌: 红绒盖牛肝菌,保存于南京林业大学森林病理实验室。
1.1.2 供试试剂与培养基 利福平(Rifampicin)购自美国 Sigma 公司; 磷酸盐生长培养基(NBRIP): 葡萄糖 10.0 g,MgCl25.0 g,MgSO4·7H2O 0.25 g,KCl 0.2 g,(NH4)2SO40.1 g,Ca3(PO4)25.0 g,蒸馏水1 000 mL,pH 7.0; 细菌活化培养基(NA): 牛肉膏 3.0 g,蛋白胨 10.0 g,NaCl 5.0 g,琼脂 15.0~20.0 g,pH7.2~7.4,蒸馏水1 000 mL; 细菌发酵培养基(NB): 牛肉膏 3.0 g,蛋白胨 10.0 g,NaCl 5.0 g,蒸馏水 1 000 mL,pH7.2~7.4。以上培养基均于 121 ℃条件下灭菌 20 min,备用。
1.1.3 供试植物材料 采用0.5% 高锰酸钾水溶液浸泡美洲黑杨(Populusdeltoides)种子(采自南京林业大学实验基地)10 min,杀菌处理后播种于分别盛有灭菌盆栽基质和含有0.5% 红绒盖牛肝菌 Xc 固体菌剂(曾丽琼, 2010)的灭菌盆栽基质的花盆中,置于日光温室培养,出苗2周后按照每盆中央1株、周围5株的方式保留6株实生苗,定期浇水保湿,培养 3 个月后备用。花盆规格为12 cm×9 cm×12 cm(上口径×下口径×高),装干盆栽基质每盆质量0.6 kg; 盆栽基质为土壤(pH7.56,有机质2.65 g·kg-1、采自南京林业大学校园后山)、砂子、蛭石按2∶1∶1比例混合并搅拌均匀在1.01×106Pa 压力下灭菌120 min 后备用。 经检测,接种Xc的美洲黑杨实生苗菌根侵染率约为 70%。
1.2 试验方法
1.2.1 JW-JS1菌株溶磷能力测定 将供试菌株活化后接种于 NB 培养基中,28 ℃、180 r·min-1振荡培养 18~24 h 制成种子液,菌数约 109cfu·mL-1。按 1% 接种量接入 NBRIP 培养基,以不接菌处理为对照,30 ℃、180 r·min-1振荡培养。每隔 24 h 取 3 个重复,培养液离心 20 min(4 ℃、10 000 r·min-1),上清液采用钼锑抗比色法测定可溶性磷含量(扣除对照后的值)(刘辉等, 2013),滴定法测定可滴定酸含量(刘辉等, 2010), pH 计(上海雷磁 pHS-3C 型号)测定上清液pH 变化。
1.2.2 JW-JS1菌株分泌有机酸的种类及含量测定 按1.2.1方法制备JW-JS1菌株的种子液,按1% 接种量接入NBRIP 培养基,以不接菌处理为对照,30 ℃、180 r·min-1振荡培养 72 h 后,培养液离心 20 min(4 ℃、10 000 r·min-1)。取 5 mL 培养液上清液过 0.22 μm 孔径滤膜,采用高效液相色谱仪(HPLC)(Agilent 1100 series,美国产)测定有机酸种类和含量。色谱条件: 色谱柱为菲罗门 C18柱,缓冲液为 0.05 mol·L-1磷酸二氢钾(pH 2~3),柱温 30 ℃,流速 1.0 mL·min-1,检测波长 214 nm。有机酸标准样品: 乙酸、草酸、酒石酸、柠檬酸、顺丁烯二酸、反丁烯二酸、丁二酸和乳酸。
1.2.3 抗利福平标记菌株的筛选及稳定性分析 采用抗利福平标记法(王长方等, 2006)筛选JW-JS1菌株的标记菌株,直至所筛选菌株在含有 300 μg·mL-1利福平的 NA 平板上能稳定生长,菌落形态与原始菌株保持一致,菌株编号为JW-JS1Rif。按1.2.1方法,测定 JW-JS1和JW-JS1Rif菌株的溶磷能力。
1.2.4 JW-JS1Rif在杨树根际和菌根际的定殖动态测定 将标记菌株JW-JS1Rif活化后接种于 NB 培养基中,28 ℃、180 r·min-1振荡培养 36 h制成接种剂,菌数约109cfu·mL-1。采用灌根法将标记菌株接种剂均匀浇灌于各植株周围土壤,接种量为每盆50 mL,以清水为对照(CK),每处理3次重复(3盆)。参照居正英(2008)菌株分离回收方法,分别于接种后第 1、2、3、4、5、7、9、11、16、20、25、30、40 和 50 天取杨树处理组和对照组进行目标菌株分离回收。使用抖土法收集杨树根际和菌根际的土壤样品,采用平板稀释法计数菌落,具体方法如下: 称取杨树根际和菌根际待测土样各1.0 g,加入9.0 mL无菌水进行梯度稀释,选取10-2、10-3、10-4土壤梯度稀释液各100 μL均匀涂布于 NA 培养基平板上(含300 μg·mL-1利福平),28 ℃培养48 h后,分别计数每皿菌落数,并换算成每克干土中的菌落数(cfu·g-1)。每处理 3次重复。
1.3 数据分析
采用Excel 2016和SPSS 22.0软件进行数据统计分析并制图,利用单因素(One-way ANOVA)和Duncan法进行方差分析和多重比较(α= 0.05)。图表中数据为平均值 ± 标准差。
2 结果与分析
2.1 JW-JS1菌株的溶磷能力
JW-JS1 菌株在 NBRIP 培养基中培养后培养液可溶性磷含量随接种时间延长逐渐增加。由图 1 可知,可溶性磷含量在培养 1~3 天时增速较大,3 天后基本达到平衡状态,增速明显变缓(4~7 天),7 天后含量达 616.39 mg·L-1。培养液 pH 在培养1天时迅速下降,从初始的 7.0 降至 3.73,随后(2~7 天)基本维持在这一水平(图 1)。相关分析表明,JW-JS1 菌株培养液 pH(X)与可溶性磷含量(Y)呈极显著负相关(r=-0.889**)。
培养液可滴定酸含量的变化趋势与可溶性磷基本一致。由图2可知,可滴定酸含量在培养1天时迅速增加,随后增速变缓(2~7 天),7 天后含量为 56.30 mmol·L-1。相关分析表明,JW-JS1 菌株培养液可滴定酸含量(X)与可溶性磷含量(Y)呈极显著正相关(r= 0.958**)。进一步分析JW-JS1 菌株培养液 pH 与可滴定酸含量的关系发现,二者呈极显著负相关(r=- 0.980**)。
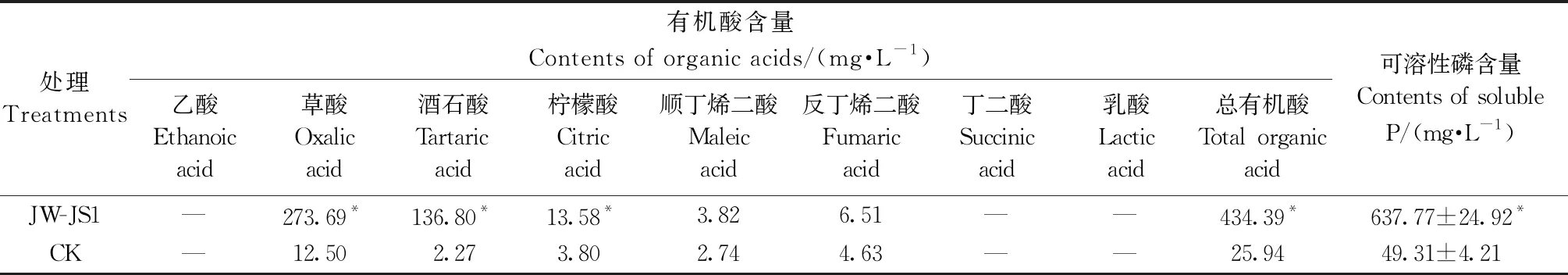
表1 荧光假单胞菌菌株JW-JS1分泌有机酸种类和含量及可溶性磷含量①

图1 荧光假单胞菌菌株JW-JS1的溶磷能力与pH的关系
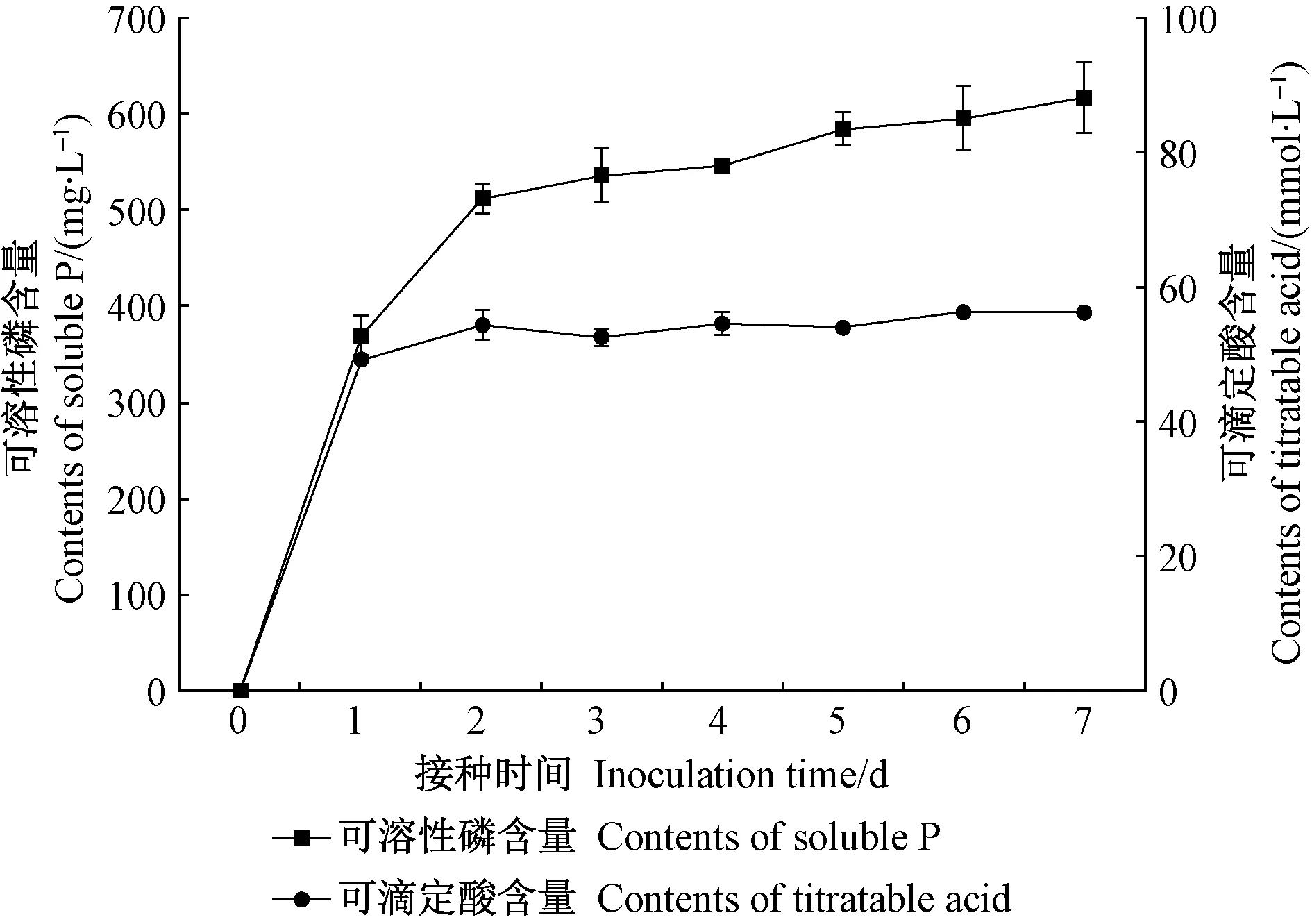
图2 荧光假单胞菌菌株JW-JS1的溶磷能力与可滴定酸含量的关系
2.2 JW-JS1菌株分泌有机酸的种类和含量
HPLC分析表明,JW-JS1 菌株在 NBRIP 培养基中培养 72 h 后能够分泌多种有机酸。由表1可知,JW-JS1 菌株分泌的总有机酸量(434.39 mg·L-1)明显高于 CK(25.94 mg·L-1),是 CK 的 16.74 倍。在培养液中共检测出为草酸、酒石酸、柠檬酸、顺丁烯二酸和反丁烯二酸 5 种有机酸,其中,草酸含量(273.69 mg·L-1)明显高于其他种类有机酸,约占总有机酸量的 63.01%,这说明 JW-JS1 菌株分泌的草酸可能在溶磷过程中发挥重要作用。
2.3 JW-JS1菌株在杨树菌根际的定殖动态
2.3.1 抗利福平标记菌株的筛选及稳定性 通过对JW-JS1菌株进行抗利福平标记,筛选得到抗利福平(300 μg·mL-1)突变菌株JW-JS1Rif。标记菌株在不含利福平的NA平板上连续传代10次,转接于含300 μg·mL-1利福平的NA平板上生长良好,菌落形态和颜色等与原始菌株基本相同,即 JW-JS1Rif菌株与JW-JS1菌株的菌落均为乳黄色,圆形菌落小,湿润,边缘整齐,说明突变菌株抗性标记稳定。由表2可知,原始JW-JS1菌株培养液可溶性磷含量为584.17 mg·L-1,在NBRIP培养基中培养 72 h 后,标记菌株JW-JS1Rif培养液可溶性磷含量为579.26 mg·L-1,二者差异不显著(P<0.05),这说明标记菌株JW-JS1Rif的溶磷能力基本未退化,可作为溶磷细菌的靶标细菌,适合开展定殖试验研究。
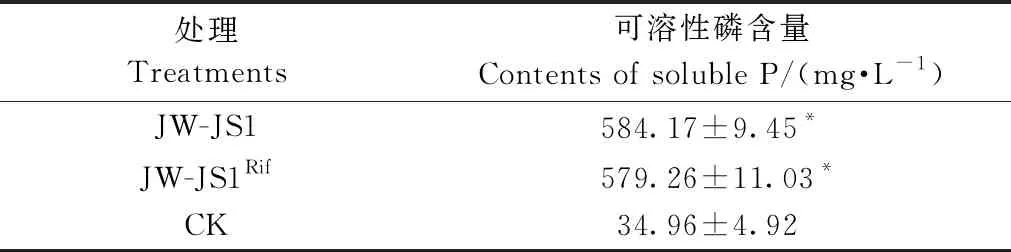
表2 JW-JS1Rif 菌株与 JW-JS1 菌株溶磷能力比较
2.3.2 JW-JS1Rif菌株在杨树根际和菌根际的定殖动态 采用灌根法接种后,在杨树根际和菌根际中均回收到标记菌株JW-JS1Rif,而无菌水对照组在含300 μg·mL-1利福平的NA平板上未见细菌菌落生长。灌根接种处理后,标记菌株在杨树根际和菌根际均能长期稳定存活并保持一定的定殖数量,随接种时间延长定殖数量呈下降趋势,定殖动态基本一致(图3)。接种第 1 天时JW-JS1Rif菌株在杨树根际和菌根际的定殖数量最大,分别为2.34 × 106和1.34 × 106cfu·g-1,第 2 天时急剧下降,之后趋于平缓,进入稳定期。接种后第1~9 天JW-JS1Rif菌株在杨树根际的定殖数量高于菌根际,随着接种时间延长,第9~50 天定殖数量基本保持一致,接种50 天后定殖数量分别为 5.2×104和4.5×104cfu·g-1。
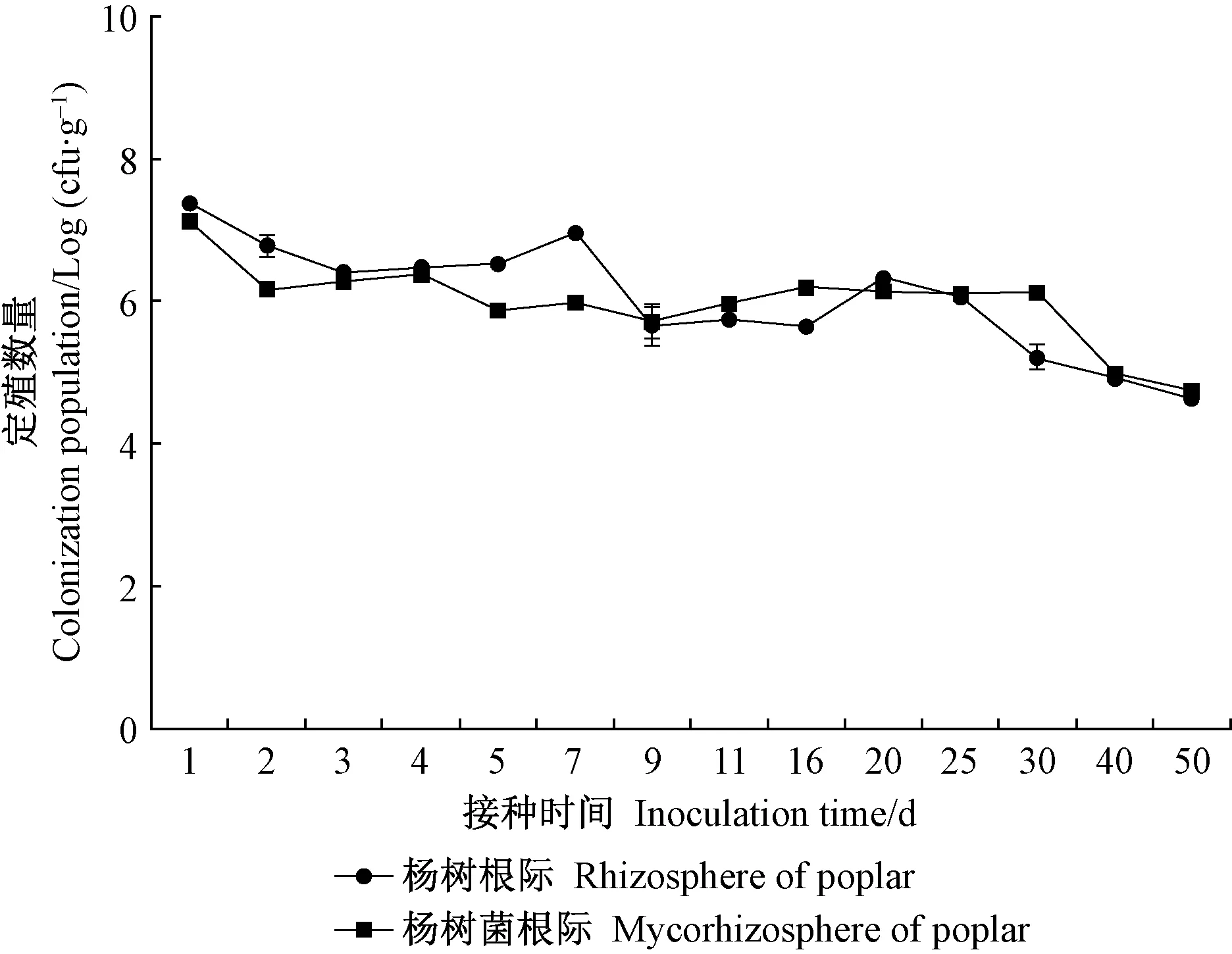
图3 JW-JS1Rif菌株在杨树根际和菌根际的定殖动态
3 讨论
不同种类溶磷微生物的溶磷过程存在较大差异,溶磷机制也不尽相同。有研究发现,培养介质 pH 降低是溶磷的重要条件而并不是必要条件(Kucey, 1988),但近年来的研究认为培养介质 pH 与溶磷量之间存在一定的负相关(Seshadrietal., 2004)。本研究 JW-JS1 菌株在溶磷过程中,随着 pH 快速下降,培养液可溶性磷含量迅速上升,当 pH 降到一定值时可溶性磷基本达到平衡状态,其含量虽有少量增加,但增速明显变缓,与荧光假单胞菌RAF15 菌株的溶磷规律基本一致(Parketal., 2009)。分析其其原因可能是: 随着接种时间延长,培养液中碳源、氮源等营养物质逐渐被消耗,一定时间后微生物生长进入稳定期,可溶性磷含量不再增加。相关分析发现,JW-JS1 菌株的溶磷能力与培养液 pH 呈极显著负相关(r=-0.889**),与赵小蓉(2002)、Antoun(2012)和张英等(2015)研究结论基本一致。可滴定酸含量可间接反映有机酸的变化情况(Tyletal., 2017),JW-JS1菌株的溶磷能力与可滴定酸含量呈极显著正相关(r= 0.958**),与刘辉等(2010)和 Tyl 等(2017)研究结论基本一致。进一步分析发现,JW-JS1菌株培养液pH与可滴定酸含量呈极显著负相关(r=- 0.980**),这说明培养液 pH 降低和可滴定酸含量增加可能是由于JW-JS1 菌株分泌有机酸引起的。
分泌有机酸是微生物溶解无机磷的主要机制之一,分泌的酸既可降低培养介质 pH,又可通过羟基或羧基与 Ca2+、Fe3+、AL3+等金属阳离子螯合,使难溶性磷转化为可溶性磷(Khanetal., 2007)。目前,已报道的 PSM 产生的有机酸多种多样,主要包括草酸、乳酸、苹果酸、琥珀酸、酒石酸、柠檬酸、丁二酸、乙酸和葡萄糖酸等(Chenetal., 2006; Songetal., 2008)。本研究通过 HPLC 检测发现, JW-JS1 菌株在溶磷过程中能够分泌草酸、酒石酸、柠檬酸、顺丁烯二酸和反丁烯二酸。不同微生物在溶解不溶性磷酸盐时,产生的有机酸种类和数量有很大不同,特定的溶磷微生物在溶磷过程中分泌的有机酸种类和数量也在变化(Vyasetal., 2009),与本研究结果相一致。草酸属共轭酸,草酸根遇到 Ca2+会形成草酸钙沉淀,从而使与 Ca2+结合的磷酸根得以释放,对提高难溶性磷酸钙盐的溶解性起到重要作用(王树起等, 2009)。本研究发现,在检测出的5种有机酸中,草酸分泌量最大,其含量明显高于其他种类有机酸,这说明 JW-JS1 菌株分泌的草酸可能在溶磷过程中发挥重要作用,与 Li 等(2016)、冯哲叶等(2017)研究论相似。近年来,随着分子生物学的发展,有关溶磷基因的报道很多,如pqq基因(焦子伟等, 2016)、gab-Y基因(Babu-khanetal., 1995)、GDH基因(杨美英等, 2016)等;gcd基因(Sulemanetal., 2018)的成功克隆不仅说明了溶磷基因的丰富性,而且也佐证了溶磷机制的复杂性。因此,今后应采用分子生物学技术深入揭示溶磷相关基因的种类和功能,从而更深入地阐明荧光假单胞菌菌株JW-JS1的溶磷机制。
植物根际有益微生物一直面临着应用效果不稳定的问题,而造成不稳定的因素主要是有益微生物在植物根际的定殖能力存在差别(孙真等, 2017)。李阜棣(1996)研究认为,外源微生物介入土壤必须经过与土著微生物生态位的竞争(包括营养、空间等),才能在根际定殖并发挥作用。王恒煦等(2019)利用利福平标记3株芽孢杆菌(Bacillussp.),明确了其在水稻(Oryzasativa)根际的定殖能力。本研究利用利福平标记筛选出含 300 μg·mL-1利福平抗性的菌株JW-JS1Rif,灌根法定殖检测发现,JW-JS1Rif菌株在杨树根际和菌根际均能稳定存活并保持一定的定殖数量,随接种时间延长定殖数量呈下降趋势,定殖动态基本一致,分析其原因可能是标记菌株在杨树根际和菌根际定殖需要一个适应过程,定殖数量在早期迅速下降,但经过一段时间适应后逐渐趋于稳定,与Theoduloz等(2003)和王恒煦等(2019)研究结论一致。接种后第1~9天JW-JS1Rif菌株在杨树根际的定殖数量略高于菌根际,这可能是因为杨树根际环境不存在外生菌根真菌的竞争,更适于其繁殖,而杨树菌根际由于红绒盖牛肝菌Xc 的存在,可能对JW-JS1Rif菌株在营养、生态位等方面产生一定的竞争性,从而导致其定殖数量低于根际,但随着接种时间延长,二者定殖数量基本维持在同一水平,这也说明该菌株与Xc 生物兼容性较好,能够在同一生态位上形成稳定的功能菌群,在活化土壤磷营养和促进杨树生长上发挥协同互作作用,与姚如斌等(2012)、刘辉等(2018; 2019)研究结论一致。单一菌种向多种功能菌种的组合应用是提高微生物肥料效果的有效途径(杨顺等, 2018),本研究结果表明荧光假单胞菌菌株JW-JS1 与红绒盖牛肝菌 Xc 是构建杨树专用功能复合微生物肥料的理想材料。
4 结论
荧光假单胞菌菌株 JW-JS1 的溶磷能力与培养液 pH 呈极显著负相关、与可滴定酸含量呈极显著正相关,培养液 pH降低和可滴定酸含量增加可能是由于JW-JS1菌株分泌有机酸引起的。JW-JS1菌株在溶磷过程中能够分泌草酸、酒石酸、柠檬酸、顺丁烯二酸和反丁烯二酸,其中草酸可能在溶磷过程中发挥重要作用。JW-JS1 菌株在杨树根际和菌根际均能长期稳定存活并保持一定的定殖数量,定殖动态基本一致,荧光假单胞菌菌株JW-JS1与红绒盖牛肝菌 Xc 生物兼容性较好,能够在同一生态位形成稳定的功能菌群,具有开发成杨树专用功能复合微生物肥料的潜力。
