血液透析患者颈动脉内中膜厚度与血清学标志物及心血管疾病的相关性研究
2021-04-09吴杰闭雄杰廖婷婷黄龙骆字验
吴杰,闭雄杰,廖婷婷,黄龙,骆字验
(1.广西科技大学第一附属医院肾内科,广西 柳州 545002;2.广西科技大学第一附属医院检验科,广西 柳州 545002;
3.广西科技大学第一附属医院风湿科,广西 柳州 545002)
心血管疾病是血液透析患者主要并发症及死亡原因,近50%患者死于心血管疾病;颈动脉内中膜厚度是冠心病及脑卒中的重要危险因素,是早期动脉硬化的标志,可直接反映全身动脉硬化程度[1]。血管内皮损伤或功能紊乱是动脉硬化重要的始动环节,并贯穿于动脉硬化病变的始终[2]。目前已知血管内皮损伤、微炎症反应等因素均参与动脉硬化病变形成,是MHD 患者心血管疾病高发重要原因,但以上危险因素间相互关系尚不明确[3]。回顾性分析2015年6月至2019年6月本院收治的216例行血液透析患者的临床资料,分析血栓调节蛋白、炎症细胞因子对颈动脉内中膜厚度的影响,采用Logistic 回归分析心血管疾病发生危险因素,旨在探讨血液透析患者颈动脉内中膜厚度与血清学标志物及心血管疾病相关性,现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析本院2015年6月至2019年6月收治的216例行血液透析患者的临床资料,根据颈动脉中膜厚度分为无颈动脉内中膜增厚组(n=50),轻度颈动脉内中膜增厚组(n=56)及重度颈动脉内中膜增厚组(n=110),其中颈动脉斑块厚度<1.87 mm 为轻度增厚,≥1.87 mm 为重度增厚[1]。患者及家属均签署知情同意书,本研究获得医院伦理委员会批准。纳入标准:符合血液透析标准;透析时间≥3个月。排除标准:严重肝脏疾病;严重全身感染;重要脏器功能障碍;恶性肿瘤;免疫系统疾病;行腹膜透析。
1.2 方法 ①临床资料包括年龄、性别、收缩压、吸烟比例、透析时间、Kt/V、血脂指标、血红蛋白、血清白蛋白、血栓调节蛋白、CRP、IL-1β、IL-6 及TNF-α;②血栓调节蛋白检测采用ELISA法;③颈动脉中膜增厚判定标准为颈总动脉中膜厚度≥1.0 mm和/或颈动脉分叉IMT≥1.2 mm[4]。
1.3 统计学方法 采用SPSS 24.0 统计学软件进行数据分析,计数资料以[n(%)]表示,行χ2检验,计量资料以“±s”表示,行t检验;相关性分析采用直线相关性分析法;多因素分析采用Logistic回归模型;检验水准为α=0.05。
2 结果
2.1 3组临床资料比较 重度颈动脉内中膜增厚组患者收缩压、年龄、血栓调节蛋白、CRP、IL-1β、IL-6及TNF-α水平均显著高于无颈动脉内中膜增厚组患者(P<0.05);重度颈动脉内中膜增厚组患者血栓调节蛋白、CRP及IL-6水平均显著高于轻度颈动脉内中膜增厚组患者(P<0.05);3组性别、吸烟比例、透析时间、Kt/V、血脂指标、血红蛋白及血清白蛋白水平比较差异无统计学意义,见表1。
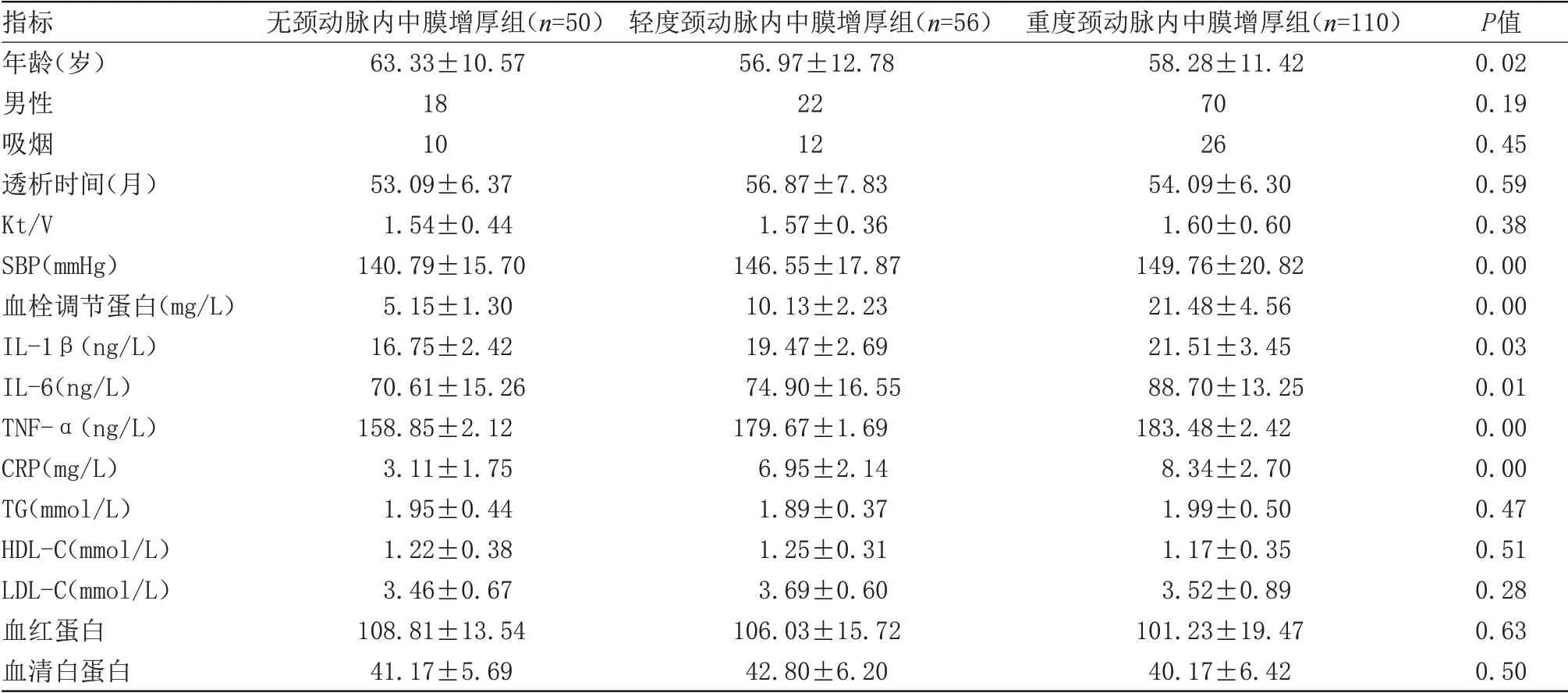
表1 3组临床资料比较
2.2 颈动脉内中膜厚度相关危险因素分析 多因素Logistic回归方程前进法分析结果显示,血栓调节蛋白和IL-6水平均与颈动脉内中膜厚度呈独立正相关(P<0.05),见表2。

表2 颈动脉内中膜厚度相关危险因素分析
2.3 血栓调节蛋白水平与炎症指标、血压相关性分析 行血液透析患者血栓调节蛋白水平与CRP、IL-1β、IL-6 及TNF-α 水平呈正相关(r=0.28,0.31,0.35,0.30,P=0.00,0.00,0.00,0.01)。
2.4 心血管疾病相关危险因素分析 随访1年内共发生心血管不良事件102例,其中无颈动脉内中膜增厚患者8例,轻度颈动脉内中膜增厚患者18例,重度颈动脉内中膜增厚患者76例;重度颈动脉内中膜增厚组患者血管不良事件发生率均显著高于无和轻度颈动脉内中膜厚度组(P<0.05)。因心血管事件死亡无颈动脉内中膜增厚、轻度颈动脉内中膜增厚及重度颈动脉内中膜增厚患者分别为2例、2例、14例;重度颈动脉内中膜增厚组患者因心血管事件死亡率均显著高于无和轻度颈动脉内中膜厚度组(P<0.05)。多因素Logistic回归方程前进法分析结果显示,颈动脉内中膜增厚和血栓调节蛋白水平升高是心血管疾病发生独立危险因素(P<0.05),见表3。
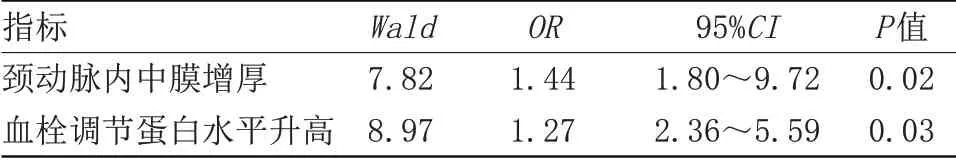
表3 心血管疾病相关危险因素分析
3 讨论
动脉粥样硬化性心血管病是导致血液透析患者死亡重要原因之一,以往认为高血糖、高血压及高血脂等危险因素往往难以全面解释该类患者高死亡风险;近年来,研究表明血管内皮损伤和功能异常均在动脉粥样硬化性心血管病病情发生发展过程中发挥关键作用[5]。
血栓调节蛋白属于凝血酶活化受体和辅助因子,其水平能敏感反映血管内皮损伤;已有研究显示,慢性肾脏病患者血栓调节蛋白水平较健康人群更高,同时血栓调节蛋白水平与颈动脉中膜厚度独立相关[6]。本研究结果显示,重度颈动脉内中膜增厚组患者血栓调节蛋白水平均显著高于轻度颈动脉内中膜增厚组患者(P<0.05);血栓调节蛋白水平与颈动脉内中膜厚度呈独立正相关(P<0.05);同时血栓调节蛋白水平升高是心血管疾病发生独立危险因素(P<0.05),进一步表明随着血管内皮损伤程度加重,颈动脉中膜厚度逐渐增加,颈动脉斑块阳性率升高。
有研究显示[7],行血液透析患者体内往往存在明显炎性细胞因子表达异常,包括IL-1、IL-6、TNF-α 及IL-10 水平等;而持续性微炎症反应状态已被证实是导致血管内皮细胞损伤潜在原因。本研究结果显示,重度颈动脉内中膜增厚患者CRP、IL-1β、IL-6 及TNF-α 水平均显著高于无颈动脉内中膜增厚组患者(P<0.05);血栓调节蛋白和IL-6水平均与颈动脉内中膜厚度呈独立正相关(P<0.05);同时行血液透析患者血栓调节蛋白水平与CRP、IL-1β、IL-6 及TNF-α 水平呈正相关(r=0.28,0.31,0.35,0.30,P=0.00,0.00,0.00,0.01),提示炎症反应与血管内皮细胞损伤密切相关,能共同促进心血管疾病进展。
颈动脉中膜增加是反映动脉粥样硬化及心血管疾病可靠指标之一,具有良好心血管事件预测价值[8];本研究多因素Logistic 回归方程前进法分析结果显示,颈动脉内中膜增厚是血液透析患者心血管疾病发生独立危险因素(P<0.05);国外学者报道显示[9],动脉粥样硬化、血管内皮损伤均与心血管疾病发生有关。
综上所述,颈动脉内中膜增厚和血栓调节蛋白水平升高与行血液透析患者远期心血管疾病发生独立相关,血管内皮细胞损伤和炎症反应可能协同加快颈动脉内中膜增厚。
