降钙素原在肺癌患者感染与癌性发热的鉴别诊断中的价值
2021-04-09胡欣荆昉宇
胡欣,荆昉宇
(1.辽宁省健康产业集团本钢总医院内科,辽宁 本溪 117000;2.本溪市中心医院内科,辽宁 本溪 117000)
癌症会对人体造成严重影响,威胁患者生命安全,其中,肺癌是最常见的癌症类型之一。肺癌又称为原发性支气管肺泡癌,即肺部原发性肿瘤,属于临床常见的恶性肿瘤之一。肺癌累及患者肝、肾、脑等系统,促使其产生严重并发症,降低患者机体免疫能力,增加感染发生率[1]。通常情况下,发生感染后患者体温会迅速上升,因此,在恶性肿瘤患者中,发热属于常见体征之一。同时,癌性发热也是恶性肿瘤患者的常见体征之一,但由于感染发热与癌性发热症状相似,经影像学检查,其检查速度、准确性均存在局限性,给临床鉴别增加了难度[2-3]。临床为准确证实癌症患者是否为感染发热,通常均会给予发热肺癌患者抗生素治疗,并根据治疗结果最终判断发热类型[4]。随着医学技术发展,PCT 被发现能有效提示肺癌患者发热类型。作为炎性指标之一,PCT对细菌感染判断具有较高的敏感性、特异性、准确性,通过检测PCT水平诊断感染已成为临床常用诊断癌症患者感染的方式之一。但相关研究表明[5],癌症患者在非感染状态下出现发热,其PCT 水平也会升高。基于此,本研究旨在探究PCT 在肺癌患者感染与癌性发热的鉴别诊断中的价值,以便为临床诊断癌症患者感染提供指导意义,现报道如下。
1 资料与方法
1.1 临床资料 选取2017年5月至2018年5月本院收治的肺癌伴发热患者82例作为研究对象,根据PCT检测结果分为感染组(n=40)和癌性发热组(n=42)。感染组男27例,女13例;年龄29~63岁,平均(52.54±3.43)岁;肺腺癌11例,肺鳞癌8例,肺腺鳞癌8例,小细胞肺癌13例。癌性发热组男28例,女14例;年龄26~64岁,平均(52.63±3.52)岁;肺腺癌10例,肺鳞癌10例,肺腺鳞癌11例,小细胞肺癌11例。两组年龄、肺癌分型等临床资料比较差异无统计学意义,具有可比性。本研究经医院伦理委员会批准,患者均知情且同意参与本研究。纳入标准:均符合肺癌诊断标准,病理检查结果显示肿瘤细胞;年龄>18岁。排除标准:合并有心脑血管疾病者;不配合者。
1.2 方法
1.2.1 血清PCT检测方式 ①于清晨患者空腹状态下采集静脉血液,采用全自动化学发光免疫分析仪(品牌:勤邦生物,型号:HMC-D2),使用该分析仪配套试剂;调节分析仪相关参数,0.02~100 ng/mL为检测范围,0.06 ng/mL为检测灵敏度。②PCT检测应用免疫发光法检查法进行,针对其中慢性发热患者,于第2天再次采集其静脉血液进行分析。
1.2.2 诊断感染方式 采用彩色多普勒超声检查、微生物学检查,并结合患者临床症状、抗感染治疗情况等,作为标准进行感染诊断。抗感染疗效判定标准:患者各项临床症状均好转,使用48~72 h 抗生素后,体温降低,血象降低,超声检查结果显示病灶吸收。
1.2.3 癌性发热诊断方式 采用彩色多普勒超声检查、实验室检查,并结合患者临床症状,结果显示无感染。根据临床经验对患者进行抗感染治疗,治疗时间1周,发热症状未消失。使用吲哚美辛片(临汾奇林药业有限公司,国药准字H14020549)25 mg进行降热治疗,效果显著,患者体温恢复正常。
1.3 观察指标 记录检查结果,并进行比较。PCT 水平>0.349 μg/L 为存在感染,敏感度=真阳性/(假阴性+真阳性)×100%;特异度=真阴性/(假阳性+真阴性)×100%;准确度=(真阳性+真阴性)/总例数×100%。
1.4 统计学方法 采用SPSS 18.0 统计学软件进行数据分析,计数资料以[n(%)]表示,行χ2检验,计量资料以“±s”表示,行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组肺癌患者PCT 水平比较 感染组血清PCT 水平为(0.649±0.112)μg/L,癌性发热组患者血清PCT 水平为(0.428±0.093)μg/L。感染组血清PCT水平明显高于癌性发热组,差异有统计学意义(t=9.740,P=0.000)。
2.2 血清PCT诊断敏感度、特异度、准确度分析 82例患者经血清PCT检测,阳性38例,癌性发热阴性2例。血清PCT诊断的敏感度为95.00%,特异度为95.24%,准确度为95.12%,见表1。
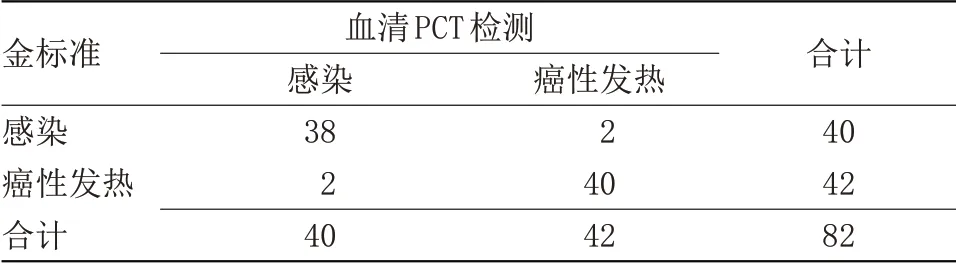
表1 血清PCT诊断敏感度、特异度、准确度分析Table 1 Analysis of sensitivity,specificity and accuracy of serum PCT diagnosis
3 讨论
癌症泛指所有恶性肿瘤,是人体正常细胞在诸多因素的作用下发生癌变,严重威胁患者生命安全,其中,以肺癌最常见。肺癌患者常见临床症状之一为发热,导致其发热的原因较多,如细菌感染所致发热,化疗促使机体产生发热反应,肿瘤组织生产过程中相应因子导致等,因此,肺癌患者发热可分为感染与非感染[6-7]。对于肺癌患者,及早诊断发热原因并尽快进行针对性治疗,能提升治疗效果,确保其生命安全,因此,有效的诊断方式对肺癌患者具有重要意义[8]。
近年来,临床将PCT 作为诊断感染的指标之一,主要由甲状腺C 细胞分泌产生,并不会释放进人体血液系统中,因此,在健康人血液中不存在PCT[9]。一般情况下,机体遭受细菌等感染后,会导致患者体内炎性细胞数量增加,迅速增加的炎性因子对机体相关组织产生刺激,促使其发生改变,进而促使PCT 水平升高。相关研究表明,患者在感染早期,其体内即能检测出PCT,随着感染发展,PCT 水平不断升高,且在感染发生24 h 后水平升至高峰。但由于发热属于恶性肿瘤患者常见体征之一,对其中发热患者进行血液检测,也能检测出PCT[10-11]。因此,增加临床诊断癌症患者感染难度。本研究结果显示,感染组血清PCT 水平明显高于癌性发热组,差异有统计学意义(P<0.05),说明患者发热程度越严重,其机体PCT水平越高;将PCT所检测的感染与癌性发热结果与金标准进行比较,即PCT水平>0.349 μg/L,结果显示,PCT 诊断的敏感度为95.00%,特异度为95.24%,准确度为95.12%,由此可判断,采用PCT 诊断肺癌患者感染发热与癌性发热具有较高准确性,可作为临床诊断方式之一。
综上所述,PCT在肺癌患者感染与癌性发热的鉴别诊断中的应用价值显著,诊断具有较高准确性。同时,检测患者机体PCT水平是操作方式简单的实验室检测方式之一,进一步提升其应用价值。
