HPVL1和EGFR在宫颈癌及癌前病变中的表达及意义研究
2021-04-09钟辉刘锦钰龙璐雯化金金马静
钟辉,刘锦钰,龙璐雯,化金金,马静
(安徽省淮北市妇幼保健院病理科,安徽 淮北 235000)
宫颈癌是女性常见的恶性肿瘤疾病,该病占居女性恶性肿瘤发病率第二位,严重威胁女性生命安全[1]。关于宫颈癌的发病,相关研究表明人乳头瘤病毒(human papillomavirus,HPV)为宫颈癌与癌前病变的重要致病因子,当前对HPV研究已深入到对各亚型分子中,其中主要的亚型分子为衣壳蛋白L1(HPVL1),通常而言,HPVL1蛋白若阳性表达可提示为低级别上皮内瘤变,阴性表达则提示为高级别上皮内瘤变与宫颈癌,因此,认为HPVL1 对判定宫颈癌及癌前病变具有一定的价值[2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)则是表皮生长因子(EGF)细胞增殖及信号传导受体,在很多的实体瘤中存在EGFR 高表达或异常表达情况,这与肿瘤细胞增殖、血管生成及肿瘤侵袭相关,分析EGFR 对判断宫颈癌及癌前病变具有一定价值[3]。本研究旨在探讨HPVL1与EGFR在宫颈癌及癌前病变中的表达与意义,现报道如下。
1 资料与方法
1.1 临床资料 选取2009年1月至2015年5月于本院门诊及住院的40例宫颈癌、300例宫颈癌前病变患者、10例子宫颈HPV感染及20例尖锐湿疣患者作为研究对象,所有宫颈癌病例均经过病例组织活检确诊,且均为初发病例。本研究经医院医学伦理委员会批准同意。
1.2 检测方法 对获取的病理标本,采取原位杂交技术对宫颈癌、癌前病变做HPV-DNA分型检测,HPV检测阳性的病例则开展HPVL1、EGFR检测,其中EGFR采用免疫组织化学标记,HPV-L1 采用核酸分子杂交技术和免疫组化技术,EGFR 检测试剂盒购自福州买新公司,HPV-L1 美国哀帝旺斯医疗科技有限公司,相关检测操作步骤严格参照试剂盒说明书进行,在光镜下进行检测。
1.3 观察指标 宫颈癌的分期参照国际产科协会制定的标准:原位癌或者上皮内癌为0 期;癌症发生局限于宫颈部位为Ⅰ期;癌症病变已经超出宫颈组织,但并未达到盆壁或者阴道下1/3 位置为Ⅱ期;癌症浸润至盆壁或者累及阴道下1/3 位置,存在肾盂积水为Ⅲ期;癌症扩散超过真骨盆或者侵犯膀胱或者直肠黏膜部位为Ⅳ期。
宫颈癌前病变的标准参照世界卫生组织(WHO)制定的标准(颈不典型增生依据细胞异型程度、上皮累及范围):①轻度不典型增生(CINⅠ级),细胞异型程度较轻,异型细胞仅占到上皮层的下1/3;②中度不典型增生(CINⅡ级),细胞出现明显的异型,局限在上皮层下2/3 的位置;③重度不典型增生(CINⅢ级),细胞明显异型,几乎累及全部上皮层。宫颈原位癌的特点是癌细胞仅局限于上皮内,基底膜完整无间质浸润。宫颈浸润癌依据分化程度分为Ⅰ级、Ⅱ级、Ⅲ级,其中Ⅰ级为高分化癌,表现为癌巢的中部多数角化并可见癌珠;Ⅱ级为中度分化癌,分化达到宫颈上皮中层细胞,细胞大小不一且癌巢无明显角化;Ⅲ级为未分化的小细胞。
阳性判断标准为细胞核出现黄色/棕黄色颗粒,阳性强度判断借助综合阳性细胞百分比、染色强度半定量积分法。对患者进行随访,在每年3~6 个月进行1 次供应细胞复查,必要时进行活检,随访5年,分析HPVL1、EGFR 在宫颈癌与宫颈癌前病变中的表达情况。
1.4 统计学方法 采用SPSS 21.0 统计学软件进行数据分析,计数资料以[n(%)]表示,行χ2检验,计量资料以“±s”表示,行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 基础资料 40例宫颈癌患者年龄29~80岁,平均年龄(56.1±2.4)岁;病理分期:Ⅰ~Ⅱ期26例(65.00%),Ⅲ~Ⅳ期14例(35.00%);癌细胞分化:高分化5例(12.50%),中分化22例(55.00%),低分化13例(32.50%);随访5年,随访率100%,5年期生存率为80.00%(32/40),死亡率为20.00%(8/40)。300例宫颈癌前病变患者年龄20~80岁,平均年龄(56.2±2.3)岁;病变增生情况上CIN Ⅰ~Ⅱ级235例(78.33%),CINⅢ级65例(21.67%)。10例子宫颈HPV 感染年龄21~50岁,平均(33.2±2.1)岁。20例尖锐湿疣年龄20~42岁,平均(29.1±1.5)岁。
2.2 HPVL1 在宫颈癌与癌前病变中的表达情况 宫颈癌HPVL1 阳性表达率明显低于其他患者(P<0.05),尖锐湿疣与癌前病变的阳性表达率高于子宫颈HPV 感染(P<0.05),但尖锐湿疣与癌前病变的阳性表达率比较差异无统计学意义,见表1,图1~3。随访宫颈癌患者,5年期生存的患者HPVL1蛋白表达显著高于死亡患者。
2.3 EGFR 在宫颈癌及癌前病变中的表达情况 在子宫颈HPV感染中无EGFR阳性表达,宫颈癌患者阳性表达率高于其他患者,癌前病变的EGFR阳性表达率高于尖锐湿疣,见表2。宫颈癌患者随着病理的分期的增加EGFR 阳性表达率也增高,EGFR 阳性表达随分化程度的降低而增强。癌前病变者随CIN分级提高EGFR阳性表达也提高。
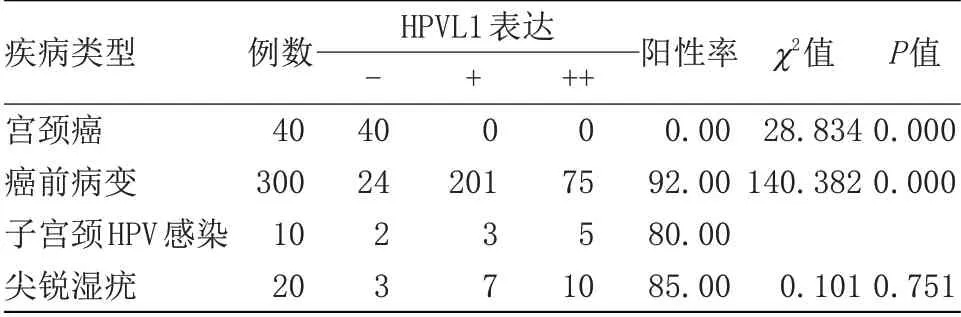
表1 不同患者HPVL1蛋白阳性表达情况Table 1 The positive expression of HPVL1 protein in different patients
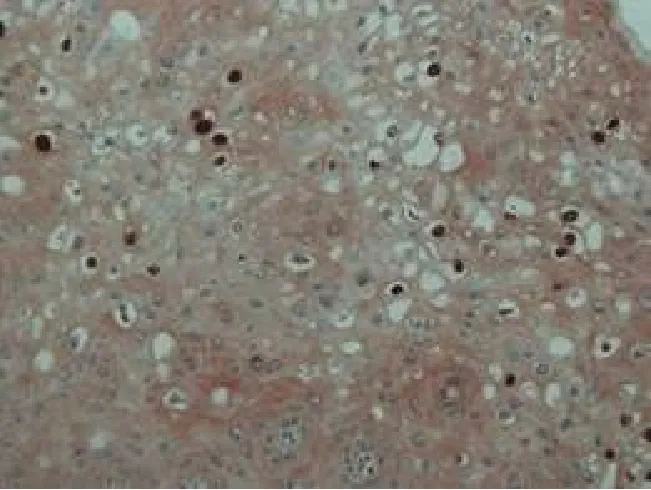
图1 尖锐湿疣中挖空细胞HPVL1阳性表达Figure 1 Positive expression of HPVL1 in knockout cells in condyloma acuminatum
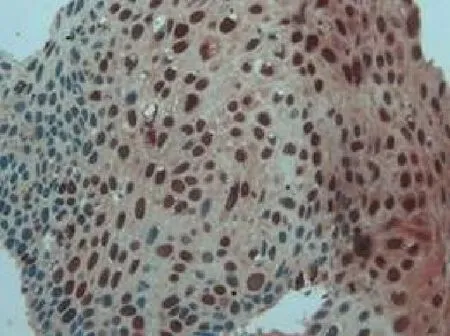
图2 低级别上皮内病变增生鳞状上皮HPVL1阳性表达Figure 2 The positive expression of HPVL1 in low-grade intraepithelial lesions and squamous epithelium
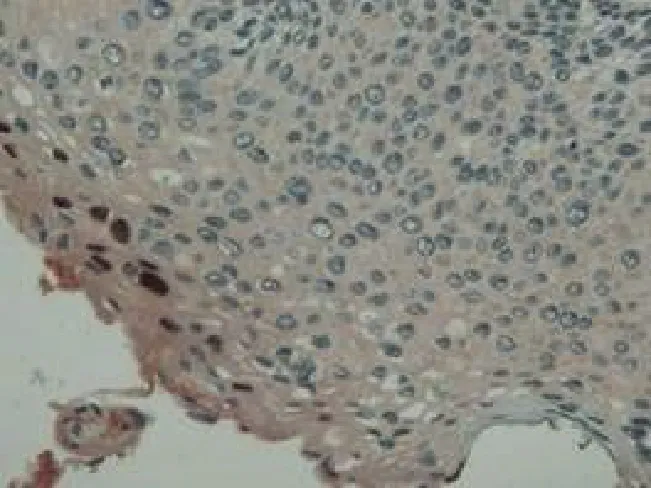
图3 高级别上皮内病变少量细胞HPVL1阳性表达Figure 3 HPVL1 was positively expressed in a few cells of high grade intraepithelial lesion
3 讨论
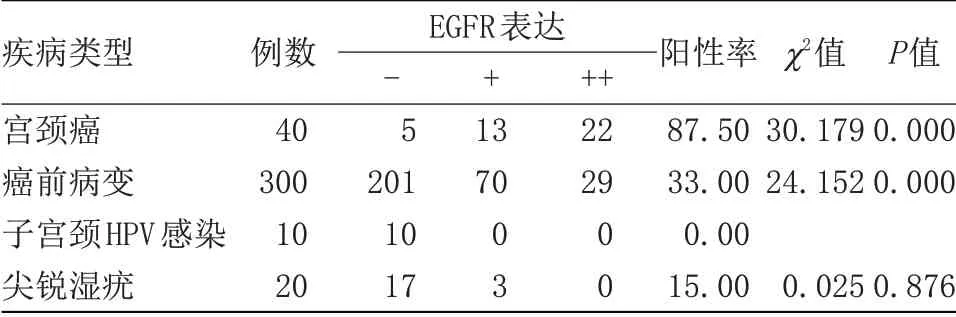
表2 EGFR在不同患者中的阳性表达情况Table 2 The positive expression of EGFR in different patients
HPV是宫颈癌发生的主要病因,HPV包含很多亚型,其中HPVL1亚型同病变发生存在关联[4-6]。本研究中显示,在宫颈癌患者中HPVL1阳性表达率低,癌前病变、尖锐湿疣及HPV阳性率高,提示可以将其作为检测宫颈癌的一项重要指标,主要是HPV-L1蛋白是HPV的主要衣壳蛋白,包裹病毒DNA于球心,防止病毒基因组不受核酸酶的破坏,实现病毒致病活性,是HPV感染复制早期的结构蛋白。对机体而言,HPV-L1蛋白作为外来抗原类物质,可以识别和侵袭宿主细胞的特定部位,HPVL1 表达在HPV复制早期阶段呈阳性表达,当HPV DNA整合到宿主细胞DNA后则呈阴性表达。但研究发现大部分的HPV并不一定会引起宫颈癌,需要其他因子协同,而EGFR就被认为是一种重要的协同因子[7]。EGFR是体内细胞表面的一种蛋白质,可与EGF结合,参与细胞正常生长及分离,而当EGFR基因发生突变则会使基因疯狂表达EGFR蛋白并组装于细胞膜表面,导致细胞膜表面EGFR受体过多,加速细胞异常生长及分裂,进而导致肿瘤发生及发展[8]。本研究结果显示,在EGFR的阳性表达率上,宫颈癌高于癌前病变,而癌前病变又高于尖锐湿疣与宫颈HPV感染,表明EGFR对预测宫颈癌及癌前病变有重要价值。此外,本研究结果还发现,在宫颈癌患者中,EGFR阳性表达率上均是随着病理分期增加而增加,随分化程度降低增加,癌前病变患者随CIN分级提高而增加,以上结果提示HPVL1与EGFR可作为监测宫颈癌与癌前病变的重要指标。
综上所述,宫颈癌与癌前病变患者通过监测HPVL1、EGFR 可为肿瘤的发生发展提供参考,进而为早期治疗疾病提供有利帮助。
