探究高考中的离子浓度问题
2021-04-09河北
河北
化学是以实验为基础的一门科学,高中化学实验大多数都是在水溶液中进行的。因此,正确理解电解质在水溶液中的离子浓度就尤为重要。下面以2020年全国卷Ⅰ为例总结电解质在真题中的考查角度。

试题高考考点考查角度所在题分值7次氯酸盐NaClO溶液消毒68氧化还原反应重铬酸钾溶液的氧化性69离子反应利用溶液除杂610催化反应过程信息给予题:配合物离子催化612电化学新型ZnCO2水介质电池中OH-浓度613中和滴定混合液中离子浓度关系626化工流程电解质溶液中离子反应、沉淀等1427氧化还原反应、电化学盐桥、离子浓度计算、电极方程式书写、离子检验等1535结构化学晶体变化后离子的物质的量15
2020年全国卷Ⅰ中与离子有关的知识占80分,正因如此,掌握离子浓度直接关系到高考化学分数的高低,学生务必重视起来。
经过一轮复习,大多数考生对于零散的离子浓度知识有了一定的掌握,二轮复习的重点则是将知识点系统的整合,并对易错点进行总结。下面从四个方面分析一下有关电解质溶液中离子浓度的易错问题。
水是弱电解质。25℃时,水电离出的c(H+)=c(OH-)=10-7mol·L-1。与水的电离有关知识需要掌握两点:一是任何水溶液中由水本身电离出的c(H+)=c(OH-);二是温度一定时,水溶液中c(H+)·c(OH-)为定值。
一、滴定过程中离子浓度的问题
化学反应随着标准液的滴入,混合液中的离子会因电离因素、水解因素、沉淀因素共同作用发生相应的变化。应正确分析图中曲线的起点、拐点、反应中点及终点。下面以图1为例进行分析,设曲线为用0.1 mol·L-1NaOH溶液分别滴定20 mL 0.1 mol·L-1盐酸和乙酸得到的结果。

图1
起点表示反应物的起始状态,由此可以判断出反应物的浓度、电离程度、微粒组成等。0.1 mol·L-1盐酸的pH=1,说明HCl是强电解质,完全电离,不存在氯化氢分子。0.1 mol·L-1乙酸的pH在2到4之间,说明乙酸未完全电离,是弱酸,溶液中存在分子、离子等,即c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1。
解决图像问题时可遵循图2所示流程

图2

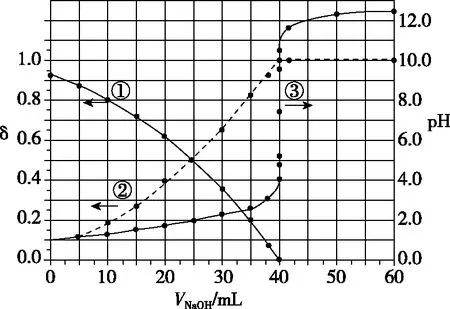
图3
下列叙述正确的是
( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
【答案】C
【解析】本题考查了学生对酸碱溶液混合时的定性判断和定量计算,重点考查识图能力。结合本题及以上滴定分析如下:
一看横纵坐标:横坐标为NaOH溶液的体积,纵坐标是未知浓度的二元酸H2A溶液中pH和分布系数δ。
二看起点:横坐标为0时,分布系数δ有两个点,二者相加和为1,说明未知浓度的二元酸H2A溶液中只存在两种含有A元素的微粒。若H2A为强酸,溶液中只有A2-;若H2A为二元弱酸,溶液中有三种微粒H2A、HA-、A2-。理论上H2A电离一定含有A2-,还剩一种含有A元素的微粒,因此,H2A第一步完全电离,第二步HA-部分电离。所以根据图像判断H2A溶液中含有HA-、A2-两种离子。




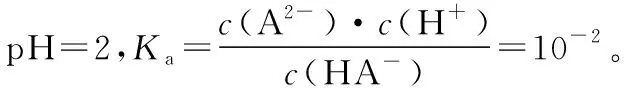
由以上方法可知,根据图像中的各点数值计算平衡常数时,通常选取可以进行计算的值,例如两种离子浓度相同的点或离子浓度存在倍数的点等。
根据上述分析,起点可以计算起始浓度、电离程度,交点用于计算常数,突变区间可以判断指示剂的选择,终点可计算反应物浓度关系。
二、稀释过程中的离子浓度问题
电解质溶液在稀释过程中,溶液中的主要离子浓度都在减小,但不是所有离子浓度都减小。如稀释酸时,氢离子浓度减小,但氢氧根离子浓度增大。强电解质稀释时离子浓度减小的程度与加入水的体积成正比;弱电解质稀释促进电离,稀释后主要离子的物质的量增大,但浓度减小,稀释弱电解质中的离子浓度减小趋势明显比强电解质溶液稀释时离子浓度减小趋势弱。
弱电解质平衡移动过程中,离子浓度比值的变化常用三种方法分析:一、将浓度比转化为物质的量比进行分析,忽略溶液体积变化,只分析微粒数目的变化。二、解题时将某些离子的浓度比值关系,乘以或除以某种离子的浓度,转化为一个平衡常数与某种离子浓度乘积或相除的关系。三、假设溶液无限稀释对其进行分析。
【例2】(2019·天津卷·5)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图4所示。下列叙述正确的是
( )

图4
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点

D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
【答案】C
【解析】分析本题,可引导学生分析等浓度的电解质和等pH的电解质的差别。如等浓度的HCl、HNO2和CH3COOH,溶液中c(H+)相差很大。当三者浓度都为0.1 mol·L-1时,HCl是强电解质,完全电离,即c(H+)=0.1 mol·L-1;CH3COOH的电离常数为1.7×10-5,由K可求得溶液中c(H+)=1.3×10-3mol·L-1;
同理HNO2的电离常数为5.0×10-4,溶液中c(H+)=2.24×10-2.5mol·L-1。由此可见,同浓度的电解质由于强弱不同,电离产生的c(H+)相差很大,这也可以解释同浓度的强酸、弱酸导电性差异以及与金属反应产生气泡速率不同。
反过来等pH的HCl和CH3COOH溶液,酸的浓度差异较大。pH=3的HCl,c(HCl)=1×10-3mol·L-1;而pH=3的CH3COOH,根据CH3COOH的电离常数1.7×10-5计算c(CH3COOH)=5.88×10-2mol·L-1。
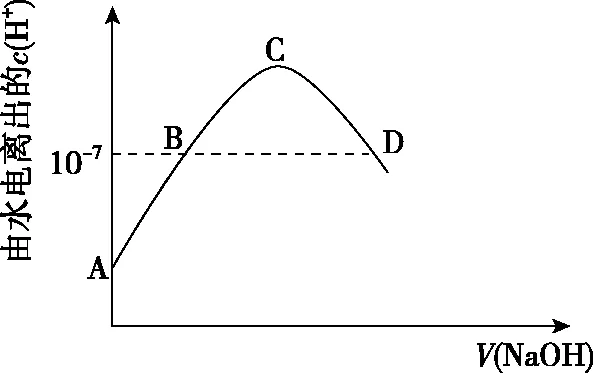
根据HNO2和CH3COOH的电离常数值,可知酸性:HNO2>CH3COOH,相同pH的两种酸溶液,稀释相同倍数时,酸性较弱的酸pH变化较小,故曲线Ⅰ代表CH3COOH溶液。酸电离出的H+对水的电离有抑制作用,酸性越强抑制作用越强。b点溶液pH小于c点溶液pH,则b点对应酸电离出的c(H+)大,对水的电离抑制程度大,水的电离程度b点 水本身电离出的c(H+)=c(OH-),酸或碱抑制水的电离,而盐类的水解促进水的电离。如25℃时,向醋酸溶液中滴加氢氧化钠溶液,变化曲线见图5。 图5 A点醋酸溶液电离出的H+抑制水的电离,由水电离出的c(H+)<10-7mol·L-1;随着氢氧化钠溶液的滴加,在醋酸溶液浓度减小和生成的醋酸钠的水解双重影响下导致由水电离出的c(H+)逐渐增大,B点由醋酸溶液电离出H+的抑制作用和醋酸钠水解消耗H+的促进作用相互抵消,使水电离出的c(H+)=c(OH-)=10-7mol·L-1,此时溶液显中性,pH=7;C点表示酸碱恰好中和,溶质是醋酸钠,溶液中只有盐的水解作用,此时水电离出的c(H+)最大,大于10-7mol·L-1;继续滴加碱,碱电离出的OH-对水的电离有抑制作用,由水电离出的c(H+)逐渐减小,当水电离出的c(H+)=10-7mol·L-1时到达D点,此时醋酸钠水解消耗H+的促进作用与氢氧化钠电离出的OH-的抑制作用等效,由水电离出的c(H+)=c(OH-)=10-7mol·L-1,但D点溶液pH并不等于7,因为D点是氢氧化钠和醋酸钠的混合液显碱性,pH>7。 反之,若向氢氧化钠溶液中滴加醋酸溶液,见图6。此过程与上图5情况类似。 图6 对于这类问题考生最容易出现的错误是认为B、D两点pH=7。水电离出的c(H+)=10-7mol·L-1,同时电离出的H+被CH3COO-结合生成了弱电解质醋酸,所以,实际溶液中图5中D点和图6中B点的c(H+)远小于10-7mol·L-1。 2020年7月浙江省高考化学选考试题19的C选项“常温下,pH=9的CH3COONa溶液中,水电离出的H+数为10-5NA”就涉及了水的电离。常温下,pH=9的CH3COONa溶液中存在的H+是水电离出的部分,另一部分与醋酸根结合成了醋酸,所以10-9mol·L-1只是水电离出的部分c(H+)。本题应该根据水的离子积计算,溶液中c(OH-)=10-5mol·L-1,实际上由水电离出的c(H+)=c(OH-)=10-5mol·L-1。 高中阶段我们认为强电解质完全电离,温度变化不影响强电解质的电离。而弱电解质电离是吸热过程,升高温度促进弱电解质的电离,弱电解质溶液中所有离子浓度可能都增大。如加热CH3COOH溶液,忽略CH3COOH挥发,CH3COOH和溶剂水的电离程度都增大,两种分子电离出的三种离子CH3COO-、H+和OH-浓度可能都增大。 【例3】(2019·北京卷·12)实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图7所示。下列说法正确的是 ( ) 图7 A.随温度升高,纯水中c(H+)>c(OH-) B.随温度升高,CH3COONa溶液的c(OH-)减小 C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果 D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同 【答案】C
三、由水电离出的离子浓度问题
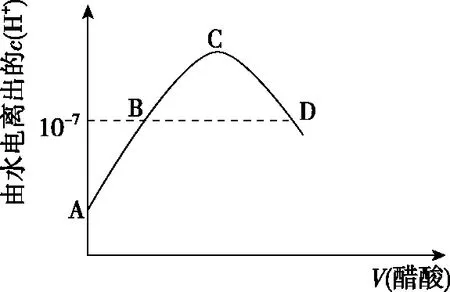
四、温度对离子浓度的影响