“变量控制”思想在化学实验教学和考试中的应用初探
2021-04-09重庆
重庆
科学研究中,多因素(多变量)影响的问题,常常采用控制变量法研究,使多因素影响的变化过程变成几个单因素影响的变化过程,分别加以研究,最后再将几个单因素的影响结果加以综合。被改变的因素叫“自变量”;随自变量改变而改变的因素叫“因变量”;其他可能产生影响的因素叫“控制变量”。“变量控制”的思想在化学实验教学和各类考试中有广泛的应用,现列举几例希望能引起各位读者的共鸣。
1 教材实验中的“变量控制”思想
1.1 人教版(2007年2月第3版)选修4《化学反应原理》20页实验2-2——浓度对反应速率的影响
实验步骤:取两支试管,各加入4 mL 0.01 mol/L的KMnO4酸性溶液,然后向一支试管中加入2 mL 0.1 mol/L H2C2O4(草酸)溶液,记录溶液褪色所需的时间;向另一支试管中加入2 mL 0.2 mol/L H2C2O4溶液,记录溶液褪色所需时间。
两个实验的情况,如表1所示:

表1
从对比可以看出,实验1和2的反应混合体系中均是草酸过量以保证溶液褪色;根据“变量控制”思想——两个体系中只有自变量“草酸浓度”不同。
按照“变量控制”思想,能否只控制“KMnO4溶液浓度”不同,其他变量都一致呢?答案是否定的。上面的实验中含有一个隐含变量“溶液的颜色”,原实验设计中此变量是相同的,但不同浓度KMnO4溶液的颜色差异较大,所以从本质上来说,改变KMnO4溶液的浓度是违背“变量控制”思想中的单一变量变化原则的。
1.2 人教版(2007年2月第3版)选修4《化学反应原理》21页实验2-3——温度对反应速率的影响
实验步骤:取两支试管各加入5 mL 0.01 mol/L Na2S2O3溶液;另取两支试管各加入5 mL 0.1 mol/L H2SO4溶液;将四支试管分成两组(各有一支盛有Na2S2O3和H2SO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并搅拌。记录出现浑浊的时间。
两个实验的情况,如表2所示:
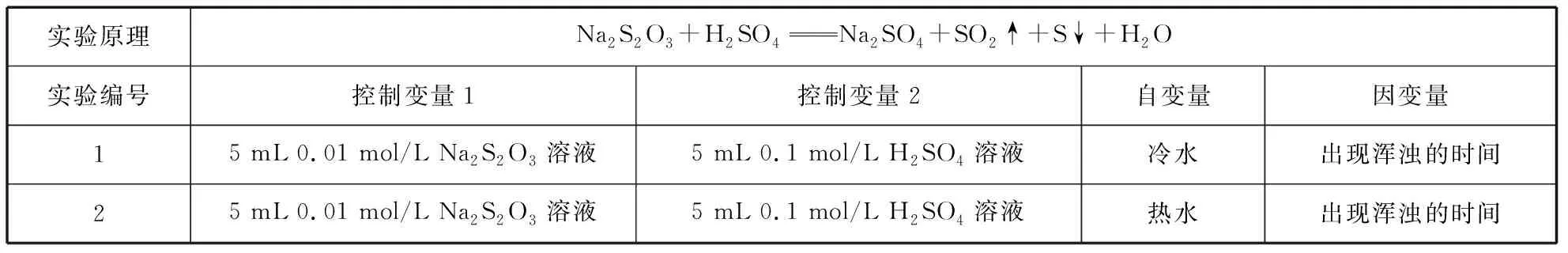
表2
本实验的“变量控制”思想非常明显:两支试管中,只有自变量温度不同。从反应特点来看“气体的产生”也可以作为因变量,但是在浑浊体系中此变量并不容易观察,所以在实际操作中因变量只能选择“出现浑浊的时间”,并且为了保证浑浊程度相同还需在试管外面用来作对比的白纸上画“十”字,使其刚好被浑浊掩盖为停止计时的标志。
1.3 人教版(2007年2月第3版)选修4《化学反应原理》21页——科学探究


表3
本实验的意图在于亲身体验实验方案的设计,落实“科学探究与创新意识”的化学学科核心素养。结合前面的方法,可利用表格做如下分析:

表4
对比实验中,控制变量c(H+)和c(I-)容易保持相同,自变量“反应温度”也较容易控制。所以本实验的关键是控制“可能影响实验结果的变量”,使其对本实验不影响或将其影响降到最低。结合表格中“试剂加入顺序及理由”一栏,读者应该可以得出:①H2SO4溶液、②KI溶液以及③指示剂(淀粉溶液),这三种溶液的加入顺序是实现“变量控制”的关键。
按照通常的实验操作规范,指示剂(淀粉溶液)加入的量只需要几滴,一般不最先加入。据此将所有可能的顺序及其相关分析列出如表5所示。

表5
2 在各类考题中的体现
2.1 模型认知
【例1】Fe(OH)3广泛用于医药制剂、颜料制造等领域,其制备步骤及装置(夹持装置省略)如下:在三颈瓶中依次加入16.7 g FeSO4·7H2O和40.0 mL蒸馏水。边搅拌边缓慢加入3.0 mL浓H2SO4,再加入2.0 g NaClO3固体,水浴加热至80℃。

图1
研究相同时间内温度与NaClO3用量对Fe2+氧化效果的影响,设计对比试验如表6:

表6
(1)m=________;n=________。
(2)若c>87.8>a,则a、b、c的大小关系为________。
【答案】(1)2.0 25
(2)c>b>a
【分析】结合题目已知和问题,可归纳出如图2的思维模型:

图2
该实验中涉及的变量有:温度、FeSO4·7H2O的质量、NaClO3的质量以及氧化效果。
①ⅰ、ⅱ对比:NaClO3的质量为自变量,氧化效果为因变量,温度和FeSO4·7H2O的质量为控制变量。结合表6中已知的数据即得m=2.0;ⅲ、ⅳ对比:NaClO3的质量为自变量,氧化效果为因变量,温度和FeSO4·7H2O的质量为控制变量。结合表格中已知的数据即得n=25。
②利用已知c>87.8,同时ⅲ、ⅳ对比能得出结论:其他变量相同时,NaClO3的用量越多,氧化效果越好;又根据a<87.8,同时ⅰ、ⅳ对比能得出结论:其他变量相同时,温度越高,对Fe2+的氧化效果越好。将上述两个结论用于ⅰ、ⅱ对比,则有b>a;ⅱ、ⅲ对比,则有c>b。故答案为c>b>a。
【例2】(2018·北京卷·27改编)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。


探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
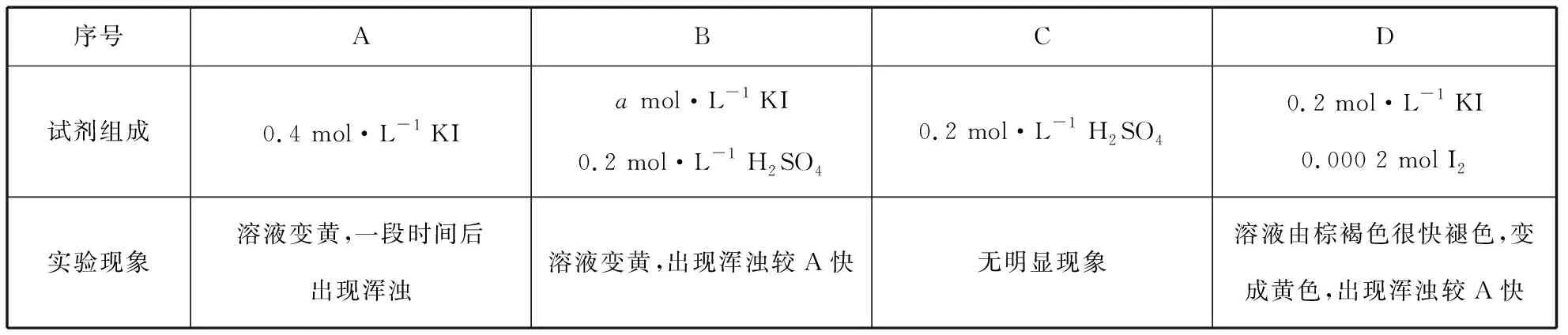
表7
(1)B是A的对比实验,则a=________。
(2)比较A、B、C,可得出的结论是。
(3)实验表明,SO2的歧化反应速率:D>A。结合ⅰ、ⅱ反应速率解释原因:。
【答案】(1)0.4
(2)I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
(3)反应ⅱ比ⅰ快;D中由反应ⅱ产生的H+使反应ⅰ加快
【分析】该实验中涉及的变量有:c(I-)、c(H+)、c(I2)。
运用与例1相同的思维模型,①对比A和B,KI溶液浓度为控制变量,H2SO4溶液加入与否为自变量,故a=0.4;同时能得出结论:c(I-)相同时,H+能加快ⅰ的反应速率。
②对比实验B和C,H2SO4溶液加入与否为控制变量,KI溶液为自变量。能得出结论:H+不能催化反应ⅰ进行。综合实验A、B和C的现象,可得出的结论是:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率。
③对比D和A,结合变量控制思想和前面已知结论,容易得出答案为:反应ⅱ比ⅰ快;D中由反应ⅱ产生的H+使反应ⅰ加快。
2.2 证据推理——素养落地
【变式练习1】为了研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化情况如图3,下列说法错误的是
( )

图3
A.25℃时,10~30 min内,R的分解平均速率为0.030 mol·L-1·min-1
B.对比30℃和10℃曲线,在50 min时,R的分解程度相同
C.对比30℃和25℃曲线,在0~50 min内,能说明R的分解平均速率随温度升高而增大
D.对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
【答案】D

【变式练习2】室温下利用H2C2O4溶液和酸性KMnO4溶液的反应探究外界条件对反应速率的影响,设计方案如下:
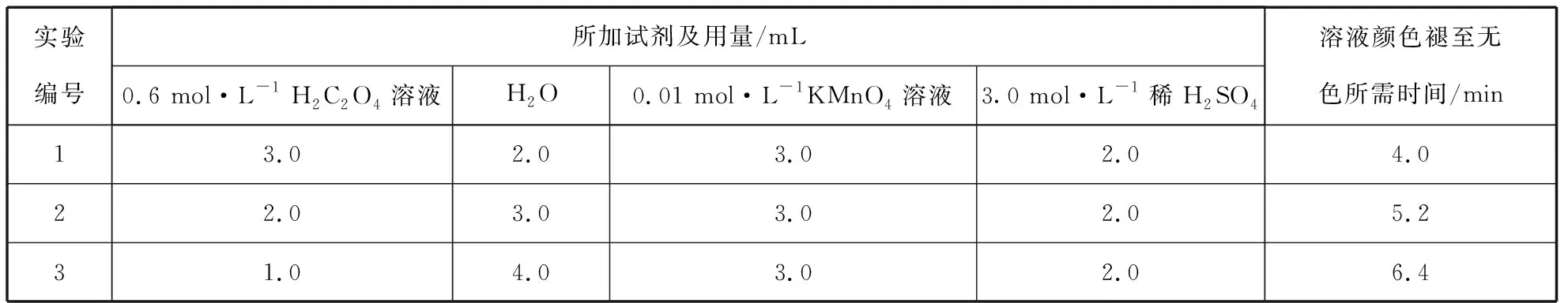
表8

甲
(1)上述反应的离子方程式为
;
(2)分析数据可得到的结论是
;
(3)该实验中n(Mn2+)随时间变化趋势如图4甲所示,请于图4乙画出t2后生成CO2的速率图像(从a点开始作图)并说明理由。

(2)反应物浓度越大,化学反应速率越快
(3)见分析部分

(2)再次回顾思维模型

该反应变量有:c(H2C2O4)、c(KMnO4)、c(H2SO4)和溶液褪色时间,c(KMnO4)和c(H2SO4)为控制变量,c(H2C2O4)为自变量,溶液褪色时间为因变量。对比实验1、2和3,能得出结论:反应物浓度越大,化学反应速率越快。
(3)Mn2+对H2C2O4与KMnO4的反应有催化作用,此反应还有一个隐含自变量c(Mn2+)。在不同的阶段两个自变量中的其中一个起主要作用,所以利用图4甲c(Mn2+)的浓度变化能得出结论:t2时c(Mn2+)增大,催化剂为主要影响因素,反应速率突然加快;末尾阶段,反应物浓度减小成为主要影响因素,反应速率减慢。
t2后的变化趋势如图5所示。
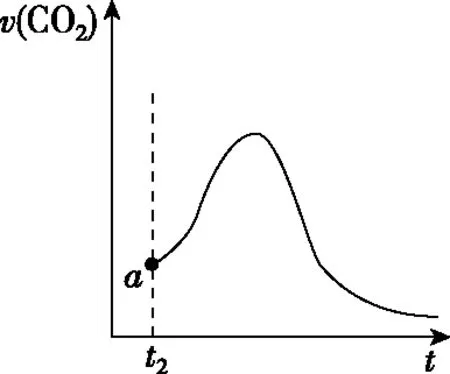
图5

