储氢材料在高考化学中的考查
2021-04-09江西
江西
能源和资源是人类赖以生存和发展的源泉,随着社会的快速发展,全球能源和资源加速消耗,人类将面对能源和资源枯竭的严重挑战,因此,新能源开发利用受到越来越多的关注。新能源一方面可补充传统能源,另一方面可有效降低环境污染。在新的能源领域中,洁净无污染的氢能利用技术正在以飞快的速度发展,已引起工业界的热切关注。氢气的储存是氢能利用技术的主要难题,近年来储氢材料的研究取得了巨大的进展,本文总结归纳了常见的储氢材料以及此类物质在高考化学中的考查,以期对复习备考有一定的帮助。
一、储氢材料综述
1.储氢材料分类
储氢材料可分为金属合金储氢材料、配位氢化物储氢材料、有机液体储氢材料以及碳质储氢材料。
1.1 金属合金储氢材料
储氢合金按合金组成不同可以划分为AB5型、AB2型和AB3.0~3.5型等。其中A是一种吸氢元素或与氢有很强亲和力的元素,B是一种吸氢量很小或不吸氢的元素,但氢在其中可移动。A控制储氢量,B控制吸放氢的可逆性,起调节生成热与分解压力的作用。
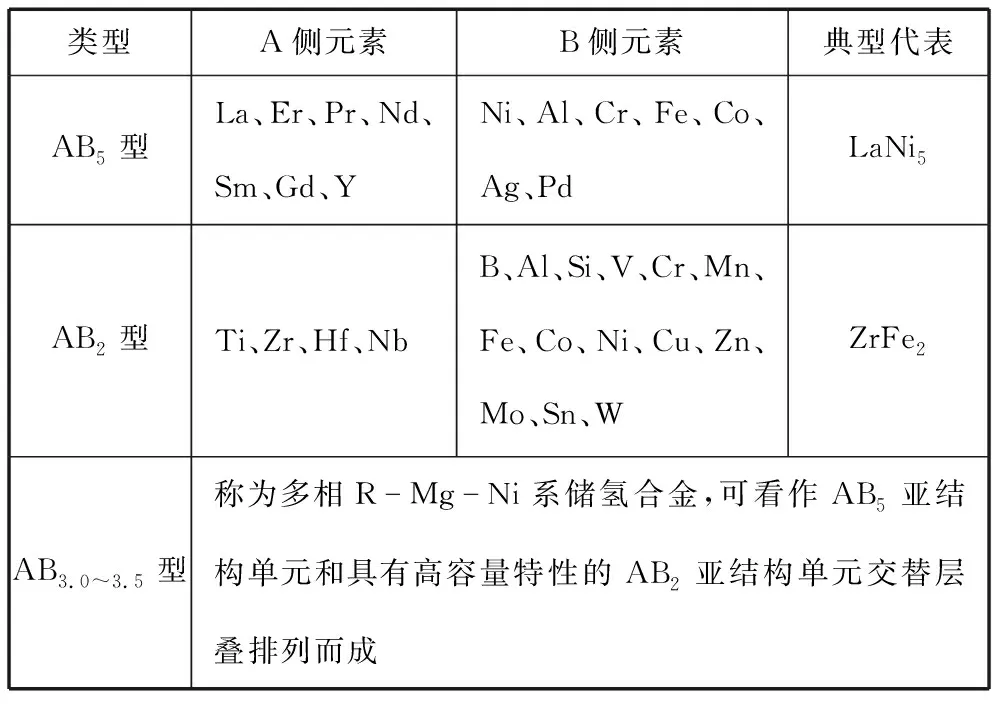
表1 金属合金储氢材料
1.2 配位氢化物储氢材料
配位氢化物主要是由[AlH4]-、[BH4]-、[NH2]-等配位阴离子和Li、Na、Mg等金属阳离子形成,如铝氢化物、硼氢化物、氮氢化物、氨硼烷化合物等。
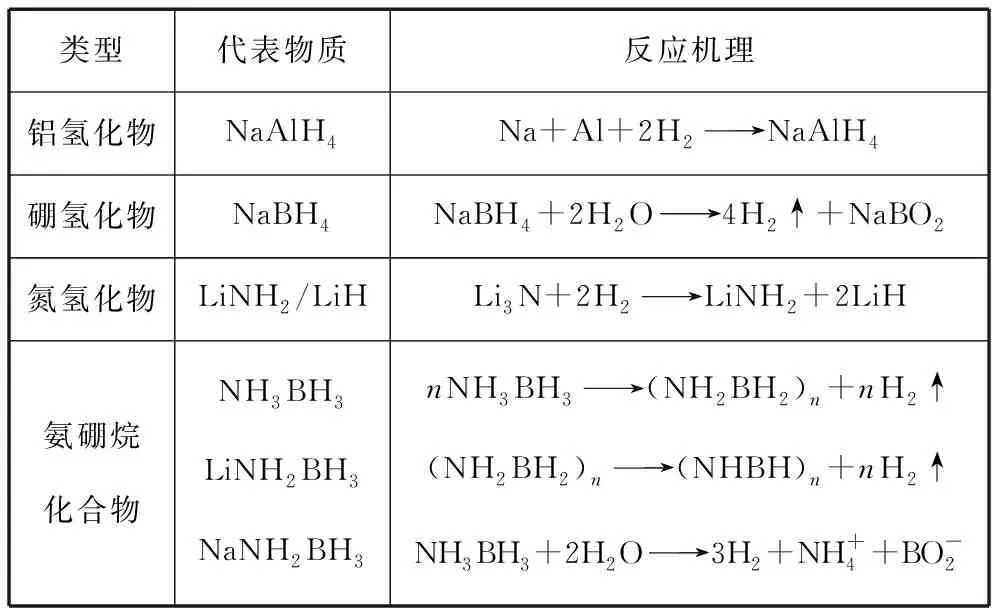
表2 配位氢化物储氢材料
1.3 有机液体储氢材料
有机液体储氢技术主要借助有机物与氢气的可逆反应来实现加氢与脱氢。通常使用的脱氢催化剂为负载型金属催化剂,活性组分为Pt、Pd、Rh、Ni、Co等,载体为Al2O3、SiO2、活性炭等。

表3 有机液体储氢材料物理性质及储氢性能
1.4 碳质储氢材料
碳质储氢材料是指碳材、玻璃微球等以物理吸附的原理吸附储氢的材料,如碳纳米纤维、碳纳米管、石墨纳米纤维、活性炭等,它们具有优良的吸、放氢性能。
2.储氢材料的应用
2.1 制备高纯度氢气
含有少量杂质的氢气与储氢材料接触,氢气被吸收形成氢化物,杂质气体不被吸收,再使储氢材料释氢,则得到高纯度的氢气。
2.2 制备金属氢化物镍电池
金属氢化物镍电池是一种新型碱性蓄电池,其组成以KOH作电解质,用储氢合金和氢氧化镍等作电极材料,M代表储氢合金,MH为金属氢化物:
二、2020年高考中储氢材料的考查
1.元素推断选择题中的考查
【2020·全国卷Ⅱ·13】一种由短周期主族元素组成的化合物(如图1所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
( )
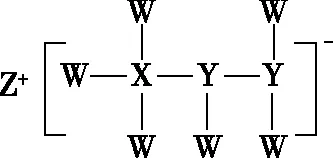
图1
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
【答案】D
【解析】由该化合物的结构简式可得知,Z最外层有1个电子,且易失去电子,由题干可知,Z的原子序数最大,得出Z为Na元素。阴离子结构中,W、X、Y可形成共用电子对数目分别为1对、4对、3对,且W、X、Y原子序数之和为24-11=13,推出W为H元素,X为B元素,Y为N元素。该化合物的化学式为NaBH3NHNH。该化合物中,W、X、Y之间均为共价键,A项正确;单质Na能与水、甲醇发生反应,生成氢气,B项正确;N的最高价氧化物的水化物为HNO3,是一元强酸,C项正确;BF3中B原子不满足8电子稳定结构,D项错误。
【点评】试题以一种高性能碱金属氨硼烷储氢材料为载体考查元素推断及元素周期律的相关知识,涉及真实的学术探索情境,体现了高考命题的综合性和创新性。
2.化学反应原理题中的考查
【2020·江苏卷·20】CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。

图2
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图3所示,两电极区间用允许K+、H+通过的半透膜隔开。
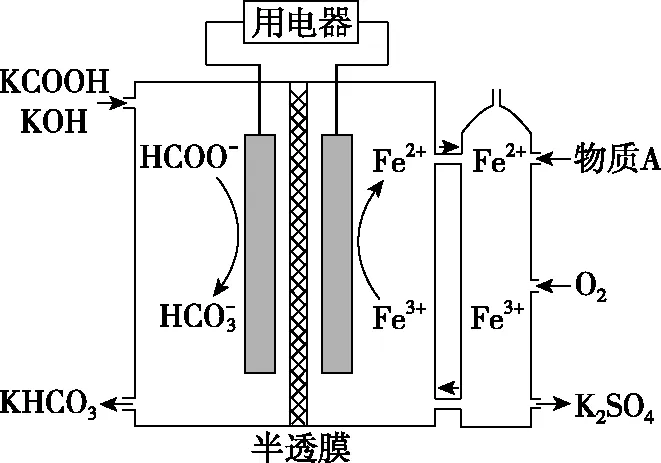
图3
①电池负极电极反应式为
;
放电过程中需补充的物质A为________(填化学式)。
②图3所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图4所示。
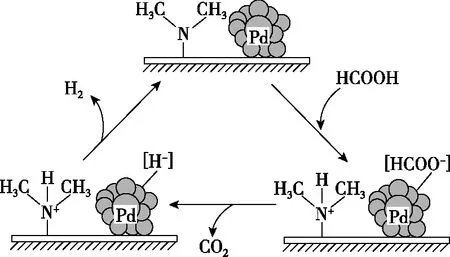
图4
①HCOOD催化释氢反应除生成CO2外,还生成________(填化学式)。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是。


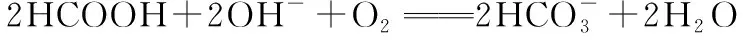
(3)①HD ②提高释放氢气的速率,提高释放出氢气的纯度


(3)从反应机理图可知,HCOOD催化释氢反应除生成CO2外,还生成HD;由反应机理图可知,HCOOH催化释氢的第一步是将HCOOH转化为HCOO-,若用HCOOK溶液代替HCOOH,可提供更多HCOO-,从而提高释放氢气的速率,HCOOK释氢时,H元素来源单一,可提高释放出氢气的纯度。
【点评】试题以CO2/HCOOH循环为载体考查化学反应原理中离子方程式的书写、原电池原理等知识以及反应机理图的识别与运用的能力,反应机理图的识别与获取有效信息为本题的难点,考生应正确理解图中各步骤的意义,找到反应物和生成物,提升识图、析图能力,结合化学原理,解决此类试题难度不大。
3.物质结构与性质选考题中的考查
【2020·全国卷Ⅲ·35】氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是________。根据对角线规则,B的一些化学性质与元素________的相似。
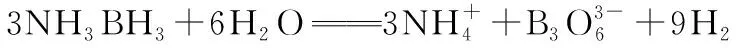
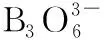
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是________________。与NH3BH3原子总数相等的等电子体是________(写分子式),其熔点比NH3BH3________(填“高”或“低”),原因是在NH3BH3分子之间,存在________________,也称“双氢键”。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为apm、bpm、cpm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图5所示。

图5
氨硼烷晶体的密度ρ=________g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
【答案】(1)B Si
(2)配位 N sp3sp2
(3)N>H>B 低 Hδ+与Hδ-的静电引力
【解析】(1)同周期从左到右主族元素原子半径逐渐减小,所以H、B、N中原子半径最大的是B;根据“对角线”规则,元素周期表中B与Si位于对角线上,二者化学性质相似;

(3)根据题意,与N原子相连的H原子呈正电性(Hδ+),N原子的电负性大于H原子的电负性,与B原子相连的H原子呈负电性(Hδ-),B原子的电负性小于H原子的电负性,所以电负性顺序为N>H>B;NH3BH3的等电子体是CH3CH3,其熔点比NH3BH3低,原因为NH3BH3分子间存在Hδ+与Hδ-的静电引力,CH3CH3分子中不存在这种“双氢键”的作用力,从而使NH3BH3的熔沸点高于CH3CH3;

【点评】试题以氨硼烷储氢材料为载体考查物质结构与性质的相关知识,试题亮点有电负性的比较,要求考生深刻理解电负性的含义,并学会灵活运用。氨硼烷的2×2×2超晶胞结构与常规晶胞结构相比,试题难度增大,要求考生熟悉高中知识,并能从题干中获得关键信息,这也恰恰符合高考化学试题对考生更高的要求。
三、原创模拟试题

( )
A.Y的最高价氧化物的水化物能溶于强酸与强碱
B.Z(YX4)2中含有离子键、共价键、配位键
C.Z(YX4)2与ZX2中所有原子均满足8电子稳定结构
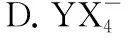


图6
下列叙述错误的是
( )

B.4种物质中Ru的成键数目未发生变化
C.使用合适催化剂在一定条件下也可使CH3COOH释氢
【答案】1.C 2.B

