超声造影表现与肝硬化背景下肝细胞癌组织病理、分化程度及预后的关系分析
2021-04-09冉琪胡亚飞游玉峰
冉琪,胡亚飞,游玉峰
作者单位:恩施自治州中心医院,a超声科,b放射科,湖北 恩施445000
原发性肝癌是全球最常见的恶性肿瘤之一,其中肝细胞癌(Hepatocellular carcinoma,HCC)约占70%~85%。目前,手术切除、局部射频消融治疗、放疗及化疗等治疗手段为治愈或延长病人的生存时间提供了机会。但原发性肝癌手术后的5年复发率高达45%~60%,严重影响了肝癌病人的预后。因此,寻找评价肝癌预后不良的指标,如细胞增殖活性和早期复发等,对肿瘤的分期、治疗方案的选择及预后具有重要意义。增殖细胞核抗原(Ki-67)是一种核蛋白,是判断肿瘤细胞增殖情况的可靠指标。肝脏超声造影(Contrast-enhancement ultrasound,CEUS)具有应用方便、有效、适应证广、无放射线等特点,且可以显示出肿瘤和肝实质对比增强的全过程。但目前关于肝癌超声造影与Ki-67及其他预后因素之间关系的研究报道较少。因此,本研究通过收集在本院行根治性切除术的肝硬化背景下HCC 病人,旨在探究HCC 病人CEUS 特征与微血管密度(Microvessel density,MVD)、微血管浸润(Microvessel invasion,MVI)、Ki-67等组织病理、肿瘤组织分化程度及预后的关系。
1 资料与方法
1.1 一般资料
收集2014年1月至2017年1月在恩施州中心医院行根治性切除术的174例肝细胞癌病人的临床资料。其中男性158 例(90.8%)、女性16 例(9.2%),年龄(67.73±5.84)岁。纳入标准:(1)具有肝硬化背景的肝细胞癌病人;(2)行肝细胞癌根治性切除术,并取得手术病理者;(3)手术时间与超声造影检查时间不超过14 d 者;排除标准:(1)术前行射频消融或化疗者;(2)合并其他恶性肿瘤等恶病质者;(3)临床资料或超声检查资料不全者。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。1.2 研究方法
收集病人的年龄、性别、肿瘤分化程度、乙型肝炎血清标志物、肝功能Child-Pugh 分级等一般临床资料以及MVI、MVD 及Ki-67 等病理资料。MVI阳性指在镜下内皮细胞衬覆的脉管管腔内见到癌细胞巢团,以门静脉分支为主。通过抗原-抗体反应对肿瘤组织中的血管进行染色后,先在低倍镜在找到血管密度最高的区域,然后在高倍镜(×400)下计数视野内的染色血管,计算出病人的平均MVD,然后将病人分为高MVD 组(大于平均值MVD)和低MVD 组(小于平均值MVD)。在高倍镜(×400)下随机选择10 个视野进行观察,每100 个细胞中细胞核染成棕色的百分比为Ki-67 的百分比,>10%为Ki-67阳性组,≤10%为Ki-67阴性组。1.3 超声检查及图像分析
采用GE Vivid E9 彩色多普勒超声仪,先行常规腹部超声扫描,观察肝脏病灶部位和大小、内部回声以及多普勒血流信号。选择病灶最清晰的切面行CEUS 检查,造影剂采用意大利BRACCO 公司Sonovue(六氟化硫微泡),每次经肘部预置的浅静脉留置针快速注入(3~5 s 内)造影剂悬浮液1.5 mL,并迅速以5 mL 生理盐水冲管,注射造影剂时同时启动计时装置并存储动态图,持续观察病灶与周边肝组织间的增强情况。注射造影剂后10~30 s时间内的图像为动脉期,如果病变部位的增强水平低或有不同大小的增强区域,则为不均匀增强。注射造影剂后31~120 s内的图像为门脉期,注射造影剂后120 s 到造影剂消失(约4~6 min)时间内的图像为延迟期。以病灶同一深度周围肝实质增强水平为参照,将增强水平高于、等于、低于周围肝实质及内部无造影剂进入分别定义为高增强、等增强、低增强及无增强。1.4 术后随访及预后
术后通过门诊及电话进行随访,随访过程中经影像学检查发现局灶性肝病灶表现出典型HCC 表现或明显的肝外转移为复发,则随访结束。本研究随访的截止时间为2020年1月1日,根据随访情况,将病人的预后分为早期复发(≤1年)、晚期复发(>1年)及无复发(随访截止时间内)。
2 结果
2.1 HCC 病人基本临床特征及组织病理学
根据组织病理及免疫组化结果,HCC 病人可分为MVI 阳性组(图1A)和MVI 阴性组(图1D);或分为高MVD组(图1B)和低MVD组(图1E);或分为Ki-67阳性组(图1C)和Ki-67 阴性组(图1F)。Ki-67 阳性组HCC病人年龄较Ki-67 阴性组降低,差异有统计学意义(P
<0.05)。Ki-67阳性组HCC 病人肿瘤组织低/中分化的发生率较Ki-67 阴性组升高,差异有统计学意义(P
<0.05)。两组病人性别、乙型肝炎血清标志物、肝功能Child-Pugh 分级等差异无统计学意义(P
>0.05)。见表1。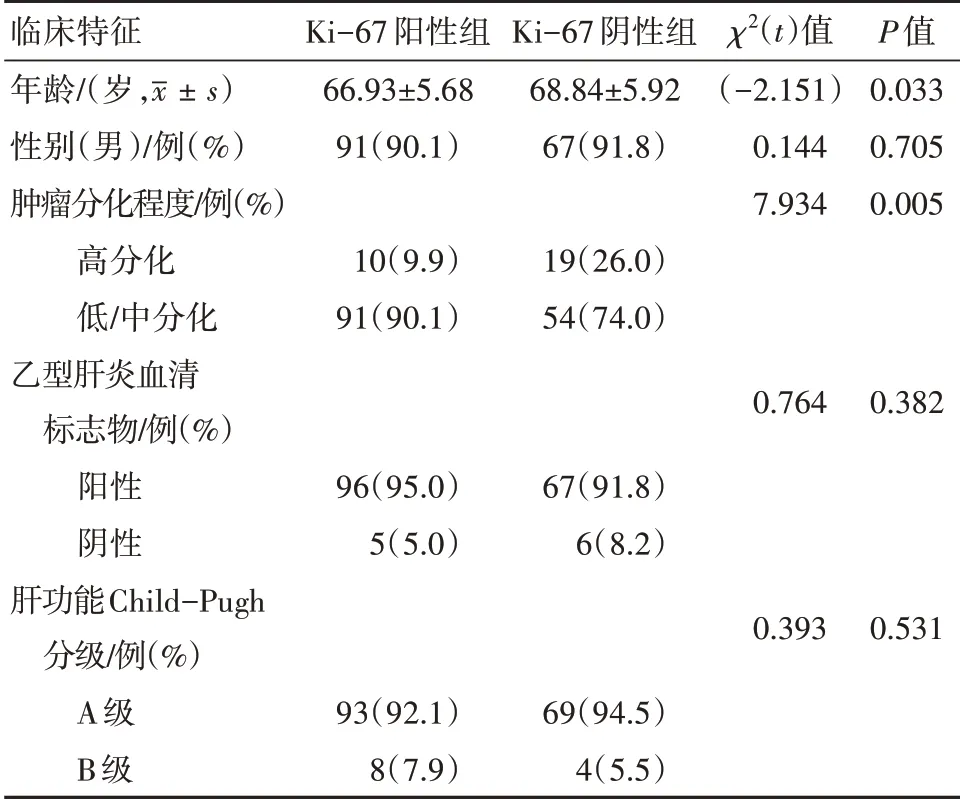
表1 原发性肝癌174例基本临床特征
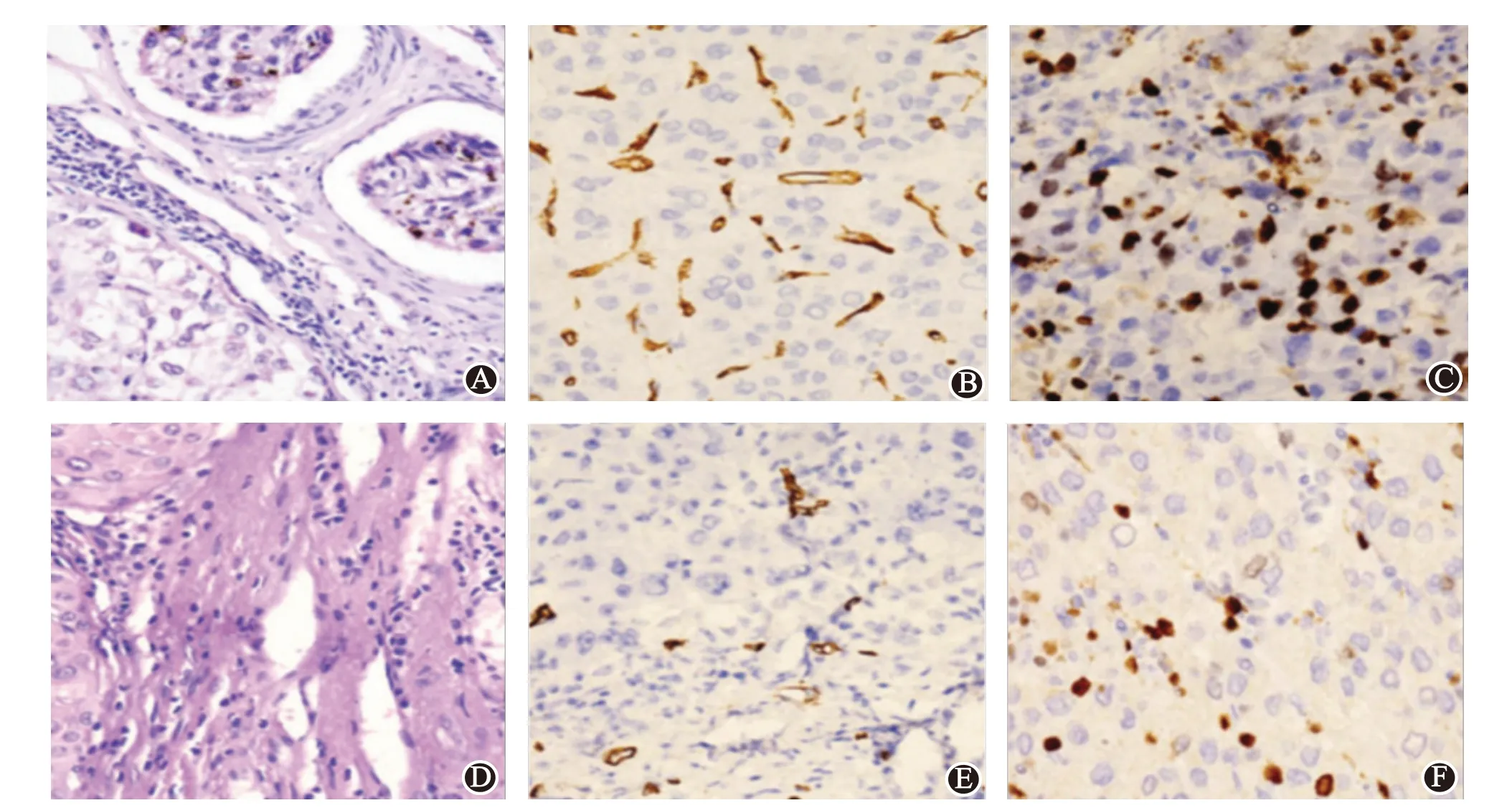
图1 原发性肝癌手术标本的微血管密度(MVD)、微血管浸润(MVI)、Ki-67组织病理及免疫组化图:A、D为MVI组织病理图(HE×400);B、E为MVD免疫组化图(ELPS×400);C、F为Ki-67免疫组化图(ELPS×400)
2.2 HCC 病人CEUS 特征与组织病理学的关系
HCC 病人CEUS 特征如图2 所示。动脉期不均匀增强、门脉期低增强、延迟期低增强的HCC 病人Ki-67阳性发生率升高,差异有统计学意义(P
<0.05)。延迟期低增强的HCC 病人MVI阳性发生率升高,差异有统计学意义(P
<0.05)。不同MVD 的HCC 病人间CEUS特征差异无统计学意义(P
>0.05)。见表2。
表2 原发性肝癌174例肝脏超声造影(CEUS)特征与组织病理学的关系/例(%)
2.3 HCC 病人CEUS 特征与肿瘤分化程度及预后的关系
动脉期不均匀增强、门脉期低增强、延迟期低增强的HCC 病人肿瘤低/中分化的发生率升高,差异有统计学意义(P
<0.05)。动脉期不均匀增强的HCC 病人早期复发的发生率升高,差异有统计学意义(P
<0.05)。见表3。
表3 原发性肝癌174例肝脏超声造影(CEUS)特征与肝癌分化程度及预后的关系/例(%)
3 讨论
全球每年约有74万人死于原发性肝癌,而我国的病人占全球总数的50%以上。肝癌术后高复发率是影响肝癌病人生存率的主要因素。因此,研究肝癌术后复发的相关危险因素具有重要的临床意义。尽早发现术后复发的影响因素并及时采取干预措施可以有效改善肝癌病人的预后。
肝癌病人的预后取决于多种影响因素。Ki-67核蛋白免疫组化检测是一种快速、简单且灵敏的肝癌细胞增殖活性检测技术,其过表达(>10%)可以预测手术治疗后肝癌的复发,与HCC 病人的死亡率有关。本研究发现,Ki-67 阳性组HCC 病人肿瘤组织低/中分化的发生率较Ki-67 阴性组显著升高,CEUS 动脉期不均匀增强、门脉期低增强、延迟期低增强等特征均与HCC 病人Ki-67 阳性发生有关。肝癌的MVI 意味着癌细胞具有肝内转移的潜力并扩散到循环系统。本研究发现,CEUS 延迟期低增强与HCC 病人MVI 的发生显著相关。肿瘤的生长和转移取决于肿瘤血管生成的增长,而MVD作为肿瘤血管生成程度的标志,表明它与肿瘤的发生、发展及转移密切相关。研究表明,与低MVD的肝癌病人相比,高MVD 的病人倾向于术后早期复发。Peng 等研究发现,CEUS 定量灌注参数峰值强度、增强强度及曲线下面积与MVD 计数呈正相关。但本研究结果尚未发现CEUS 特征与MVD 计数之间的关系。

图2 原发性肝癌肝脏超声造影图:A为动脉期呈不均匀高增强;B为门脉期造影剂快速消退,呈低增强;C为延迟期呈低增强
肝细胞癌CEUS 的典型特征是病灶在动脉期呈快速高增强,门脉期消退呈低增强,延迟期呈低增强,呈“快进快出”的增强模式。但是,高分化肝癌可能会表现出非典型的增强模式,如“快进慢出”或“慢进快出”等。本研究发现,动脉期不均匀增强、门脉期低增强、延迟期低增强与HCC 病人肿瘤低/中分化有关。与动脉期不均匀增强相比,门脉期低增强更危险。研究表明,高分化肝癌组门脉期高或等增强的比例显著高于低/中分化肝癌组,其可能原因是:(1)分化程度越低,恶性程度增加,并且由于动脉供血异常而形成了异常动脉,导致肝动脉和门静脉的正常血液供应减少,门脉期增强的持续时间减少,增强强度降低;(2)在肿瘤中心或周围有许多异常的新血管,以及动静脉瘘孔丰富,从而缩短了强化时间。
4 结论
综上所述,本研究从超声检查和病理学角度评估了肝细胞癌的预后因素和临床复发之间的关系。CEUS 特征与肝硬化背景下HCC 病人组织病理、分化程度等显著相关,并可能有助于预测病人术后的复发情况。
