藏药二十五味驴血丸的指纹图谱建立、含量测定及化学模式识别分析
2021-04-08钟镥刘川何青秀张静张艺
钟镥 刘川 何青秀 张静 张艺
摘 要 目的:建立藏药二十五味驴血丸的指纹图谱,测定其中5种成分的含量,并进行化学模式识别分析。方法:采用高效液相色谱法(HPLC)。以秦皮乙素为参照,绘制10批藏药二十五味驴血丸的HPLC指纹图谱,采用《中药色谱指纹图谱相似度评价系统(2012版)》进行相似度评价,确定共有峰;同时采用相同的HPLC法测定藏药二十五味驴血丸中5种成分的含量;采用SPSS 19.0软件进行聚类分析和主成分分析。结果:10批藏药二十五味驴血丸共有11个共有峰,相似度均大于0.98;共指认了秦皮乙素、荭草苷、异牡荆素、异金雀花素和鞣花酸等5个共有峰。秦皮乙素、荭草苷、异牡荆素、异金雀花素、鞣花酸检测质量浓度的线性范围分别为1.232~11.092 μg/mL(r=0.999 6)、2.766~24.893 μg/mL(r=0.999 5)、1.400~12.600 μg/mL(r=0.999 8)、0.600~5.400 μg/mL(r=0.999 5)、49.447~445.025 μg/mL(r=0.999 4);精密度、稳定性(24 h)、重复性试验的RSD均小于2%;平均加样回收率分别为101.29%(RSD=2.33%,n=3)、91.39%(RSD=1.22%,n=3)、90.28%(RSD=1.88%,n=3),98.76%(RSD=2.53%,n=3)、101.45%(RSD=2.84%,n=3)、100.44%(RSD=1.38%,n=3),100.91%(RSD=1.73%,n=3)、97.78%(RSD=2.07%,n=3)、99.15%(RSD=1.28%,n=3),100.27%(RSD=1.81%,n=3)、98.38%(RSD=1.89%,n=3)、101.92%(RSD=1.17%,n=3),95.50%(RSD=0.67%,n=3)、99.89%(RSD=0.38%,n=3)、100.10%(RSD=0.65%,n=3)。含量分别为0.175~0.310、0.351~0.632、0.274~0.395、0.186~0.278、6.956~8.636 mg/g。聚类分析结果显示,10批藏药二十五味驴血丸样品可聚为两类,其中S1~S4为一类、S5~S10为一类。主成分分析结果显示,两个主成分的累积方差贡献率为89.178%。結论:所建指纹图谱稳定、可行,含量测定方法简便、准确、重复性好,结合化学模式识别分析可用于藏药二十五味驴血丸的质量控制。
关键词 藏药二十五味驴血丸;高效液相色谱法;指纹图谱;主成分分析;聚类分析;含量测定
ABSTRACT OBJECTIVE: To establish fingerprint of Tibetan medicine Ershiwuwei luxue pills, and determine the contents of 5 components, and to conduct chemical pattern recognition. METHODS: HPLC method was adopted. Using aesculetin as reference, HPLC fingerprint of 10 batches of Tibetan medicine Ershiwuwei luxue pills were drawn. The similarity evaluation was conducted by using Evaluation System of TCM Chromatogram Fingerprint Similarity (2012 edition), and the common peaks were determined. Same HPLC method was adopted to determine the contents of 5 components in Tibetan medicine Ershiwuwei luxue pills. The cluster analysis and principle component analysis were performed by using SPSS 19.0 software. RESULTS: Totally 11 common peaks were calibrated, and the similarity was higher than 0.98. Five common peaks were identified, as aesculetin, orientin, isovitexin, isoscoparin and ellagic acid. The linear range of aesculetin, orientin, isovitexin, isoscoparin and ellagic acid were 1.232-11.092 μg/mL(r=0.999 6), 2.766-24.893 μg/mL(r=0.999 5), 1.400-12.600 μg/mL(r=0.999 8), 0.600-5.400 μg/mL(r=0.999 5), 49.447-445.025 μg/mL(r=0.999 4), respectively. RSDs of precision, stability (24 h) and reproducibility tests were all lower than 2%. The average recoveries were 101.29% (RSD=2.33%,n=3), 91.39% (RSD=1.22%,n=3), 90.28% (RSD=1.88%,n=3),98.76% (RSD=2.53%,n=3), 101.45% (RSD=2.84%,n=3), 100.44% (RSD=1.38%,n=3) ,100.91% (RSD=1.73%,n=3), 97.78% (RSD=2.07%,n=3), 99.15% (RSD=1.28%,n=3) ,100.27% (RSD=1.81%,n=3), 98.38% (RSD=1.89%,n=3), 101.92% (RSD=1.17%,n=3) ,95.50% (RSD=0.67%,n=3), 99.89% (RSD=0.38%,n=3), 100.10% (RSD=0.65%,n=3), respectively. Their contents were 0.175-0.310, 0.351-0.632, 0.274-0.395, 0.186-0.278, 6.956-8.636 mg/g, respectively. Cluster analysis showed that 10 batches of Tibetan medicine Ershiwuwei luxue pills were clustered into two category, with S1-S4 as one category and S5-S10 as one category. Principal component analysis showed that accumulative contribution rate of two principle components was 89.178%. CONCLUSIONS: Established fingerprint is stable and feasible, and the method of content determination is simple, accurate and reproducible. They combined with chemical pattern recognition can be used for the quality control of the Tibetan medicine Ershiwuwei luxue pills.
KEYWORDS Tibetan medicine Ershiwuwei luxue pills; HPLC; Fingerprint; Principle component analysis; Cluster analysis;Content determination
藏药二十五味驴血丸(藏药名
藏药二十五味驴血丸由驴血、生等膏、降香、檀香、毛诃子、诃子、余甘子等25味药材组成,主要含有黄酮类、酚酸类、苯丙素类、生物碱类、多糖类等有效成分[2]。其中,秦皮乙素为苯丙素类成分,具有抗炎、抗菌、抗氧化、抗肿瘤等活性[4-5];荭草苷、异牡荆素和异金雀花素为黄酮类成分,具有抗炎、保肝、抗氧化、抗肿瘤、保护心脏、保护神经等活性[6-9];鞣花酸为酚酸类成分,具有抗炎、抗氧化、抗肿瘤等作用[10]。目前,《卫生部药品标准:藏药(第1册)》关于该药的质量标准中仅收载了以秦皮甲素为对照的薄层鉴别,未见含量测定和指纹图谱测定项[2]。武嘉庚等[11]对二十五味驴血丸中的西红花、人工牛黄进行了薄层鉴别,并以大黄酚为指标成分进行了含量测定,虽然为该药的质量控制提供了参考,但指标单一。此外,有研究对二十五味驴血丸中的没食子酸进行报道[12-13],但未见其他指標成分的定性定量分析。
指纹图谱是基于对物质群整体作用的认识,借助于波谱或色谱等技术获得的中药化学成分的波谱或色谱图,是实现鉴别产品真实性、评价质量一致性和产品稳定性的可靠手段[14-15]。化学模式识别技术可对高效液相色谱(HPLC)等数据进行客观分析,既可对多个指标进行统计分析,又可将整个图谱信息数量化,进而使其可以被计算机识别与处理,从而更加客观地反映中药的质量信息,达到全面控制中药质量的目的[16]。鉴于此,本研究建立了藏药二十五味驴血丸的HPLC指纹图谱,测定了秦皮乙素、荭草苷、异牡荆素、异金雀花素和鞣花酸等5个成分的含量,同时结合化学模式识别技术对该药进行了分析,旨在为全面控制藏药二十五味驴血丸的质量提供参考。
1 材料
1.1 主要仪器
实验所用主要仪器有:1260型 HPLC仪(包括四元泵、自动进样器、柱温箱、二极管阵列检测器、Chemistation 04.03色谱工作站,美国Agilent公司)、FA1004型万分之一分析电子天平(上海良平仪器仪表有限公司)、BSA124S型十万分之一分析电子天平[赛多利斯科学仪器(北京)有限公司]、SB-8200DTS型双频超声仪(宁波新艺超声设备有限公司,功率400 W,频率40 kHz)、UPH-I型超纯水机(四川优普超纯科技有限公司)。
1.2 主要药品与试剂
秦皮乙素对照品(批号110741-201708,纯度≥98%)购自中国食品药品检定研究院,荭草苷对照品(批号H-044-181216,纯度≥98%)、异牡荆素对照品(批号Y-116-180803,纯度≥98%)、异金雀花素对照品(批号Y-077-190517,纯度≥98%)、鞣花酸对照品(批号R-004-190812,纯度≥98%)均购自成都瑞芬思生物科技有限公司;甲醇为色谱纯,其余试剂均为分析纯,水为超纯水。
10批藏药二十五味驴血丸(编号S1~S10,规格均为每丸重0.25 g)样品来源信息见表1。
2 方法与结果
2.1 藏药二十五味驴血丸HPLC指纹图谱的建立
2.1.1 供试品溶液的制备 取藏药二十五味驴血丸适量,研碎,精密称取粉末(过二号筛),约0.5 g,置于具塞锥形瓶中,加入80%甲醇30 mL,称定质量,超声处理30 min,取出,放冷,再次称定质量,用80%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.1.2 混合对照品溶液的制备 分别取秦皮乙素、荭草苷、异牡荆素、异金雀花素、鞣花酸对照品适量,精密称定,加80%甲醇制成上述成分质量浓度分别为0.105、0.118、0.101、0.106、0.302 mg/mL的混合对照品溶液。
2.1.3 色谱条件 以Chromsil C18(250 mm×4.6 mm,5 μm)为色谱柱,以甲醇(A)-0.1%磷酸水溶液(B)为流动相进行梯度洗脱(0~30 min,25%A→35%A;30~60 min,35%A),检测波长为350 nm,流速为1 mL/min,柱温为30 ℃,进样量为10 μL。
2.1.4 精密度试验 取“2.1.1”项下供试品溶液(编号S1)适量,按“2.1.3”项下色谱条件连续进样测定6次,以秦皮乙素为参照,记录各共有峰的相对保留时间和相对峰面积。结果,11个共有峰相对保留时间的RSD均小于1.0%(n=6),相对峰面积的RSD均小于2.0%(n=6),表明方法精密度良好。
2.1.5 重复性试验 取藏药二十五味驴血丸(编号S1)0.5 g,共6份,按“2.1.1”项下方法制备供试品溶液,再按“2.1.3”项下色谱条件进样测定,以秦皮乙素为参照,记录各共有峰的相对保留时间和相对峰面积。结果,11个共有峰相对保留时间的RSD均小于1.0%(n=6),相对峰面积的RSD均小于2.0%(n=6),表明方法重复性良好。
2.1.6 稳定性试验 取“2.1.1”项下供试品溶液(编号S1)适量,分别于室温下放置 0、2、4、6、8、10、12、24 h时,按“2.1.3”项下色谱条件进样测定,以秦皮乙素为参照,记录各共有峰的相对保留时间和相对峰面积。结果,11个共有峰相对保留时间的RSD均小于1.0%(n=8),相对峰面积的RSD均小于2.0%(n=8),表明供试品溶液于室温下放置24 h内稳定性良好。
2.1.7 指纹图谱的建立 取10批藏药二十五味驴血丸,按“2.1.1”项下方法制备供试品溶液,再按“2.1.3”项下色谱条件进样测定,记录色谱图。将所得色谱数据导入《中药色谱指纹图谱相似度评价系统(2012版)》,生成指纹图谱的共有模式,并以此作为对照指纹图谱(R),同时生成叠加指纹图谱,详见图1、图2。
2.1.8 相似度评价 将10批藏药二十五味驴血丸样品的色谱图导入《中药色谱指纹图谱相似度评价系统(2012版)》进行相似度评价。结果,10批藏药二十五味驴血丸样品的相似度分别为0.999、0.995、0.994、0.998、0.999、0.997、0.994、0.984、0.988、0.983,均大于0.98。这提示,10批藏药二十五味驴血丸样品的图谱与对照指纹图谱具有较高的相似度,即各批样品的化学成分一致性较好。
2.1.9 共有峰的指认 10批藏药二十五味驴血丸样品共有11个共有峰,通过与混合对照品溶液的保留时间(按相同色谱条件分析所得,见图3A)进行对比,共指认出其中5个共有峰,分别为秦皮乙素(5号峰)、荭草苷(8号峰)、异牡荆素(9号峰)、异金雀花素(10号峰)、鞣花酸(11号峰)。由于秦皮乙素含量相对较高、分离度较好,且出峰稳定,故以其为参照计算其他共有峰的相对保留时间和相对峰面积。结果,10批藏药二十五味驴血丸样品相对保留时间的RSD为0~0.84%,相对峰面积的RSD为0~67.19%,详见表2、表3。
2.2 5种有效成分的含量测定
2.2.1 溶液的制备 供试品溶液的制备同“2.1.1”项,混合对照品溶液的制备同“2.1.2”项。
2.2.2 色谱条件 色谱条件同“2.1.3”项。
2.2.3 系统适用性试验 取上述混合对照品溶液、供试品溶液(编号S1)和空白溶液(甲醇)适量,按“2.2.2”项下色谱条件进样测定,记录色谱图。结果,各待测成分的色谱峰分离度均大于1.5,理论板数均大于5 000,拖尾因子为0.9~1.1,空白溶液对5种成分的测定无干扰,详见图3。
2.2.4 线性关系考察 分别精密吸取“2.2.1”项下混合对照品溶液适量,加80%甲醇制成秦皮乙素质量浓度分别为1.232、2.464、3.697、6.162、8.627、11.092 μg/mL,荭草苷分别为2.766、5.532、8.298、13.829、19.361、24.893 μg/mL,异牡荆素分别为1.400、2.800、4.200、7.000、9.800、12.600 μg/mL,异金雀花素分别为0.600、1.200、1.800、3.000、4.200、5.400 μg/mL,鞣花酸分别为49.447、98.894、148.342、247.236、346.131、445.025 μg/mL的混合系列线性工作溶液,按“2.2.2”项下色谱条件进样测定,记录色谱图。以各待测成分质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,结果见表4。
2.2.5 精密度试验 取“2.2.4”项下混合系列线性工作溶液(秦皮乙素、荭草苷、异牡荆素、异金雀花素和鞣花酸的质量浓度分别为2.464、5.532、2.800、1.200、98.894 μg/mL)适量,按“2.2.2”项下色谱条件连续进样测定6次,记录峰面积。结果,秦皮乙素、荭草苷、异牡荆素、异金雀花素、鞣花酸峰面积的RSD分别为0.58%、1.67%、1.86%、1.06%、1.28%(n=6),表明仪器精密度良好。
2.2.6 重复性试验 取藏药二十五味驴血丸样品(编号S1)0.5 g,共6份,按“2.2.1”项下方法制备供试品溶液,再按“2.2.2”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。结果,秦皮乙素、荭草苷、异牡荆素、异金雀花素、鞣花酸含量的RSD分别为1.91%、1.93%、1.76%、1.16%、0.84%(n=6),表明方法重复性良好。
2.2.7 稳定性试验 取“2.2.1”项下供试品溶液(编号S1)适量,分别于室温下放置 0、2、4、6、8、10、12、24 h时,按“2.2.2”项下色谱条件进样测定,记录峰面积。结果,秦皮乙素、荭草苷、异牡荆素、异金雀花素、鞣花酸峰面积的RSD分别为1.83%、1.61%、1.73%、1.52%、1.38%(n=8),表明供试品溶液于室温下放置24 h内稳定性良好。
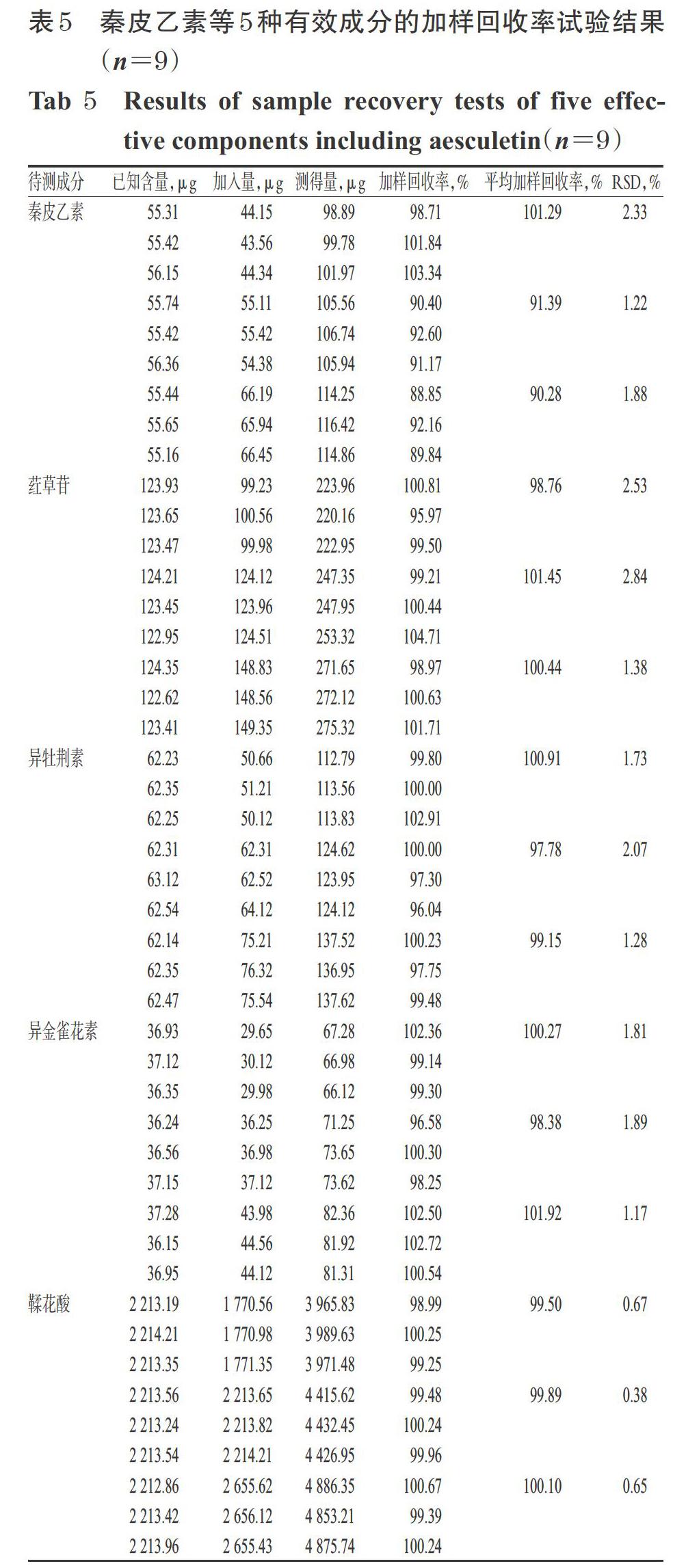
2.2.8 加样回收率试验 取已知含量的藏药二十五味驴血丸样品(编号S1)约0.25 g,共9份,分别按已知含量的80%、100%、120%加入“2.2.1”项下混合对照品溶液,按“2.2.1”项下方法制备供试品溶液,再按“2.2.2”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表5。
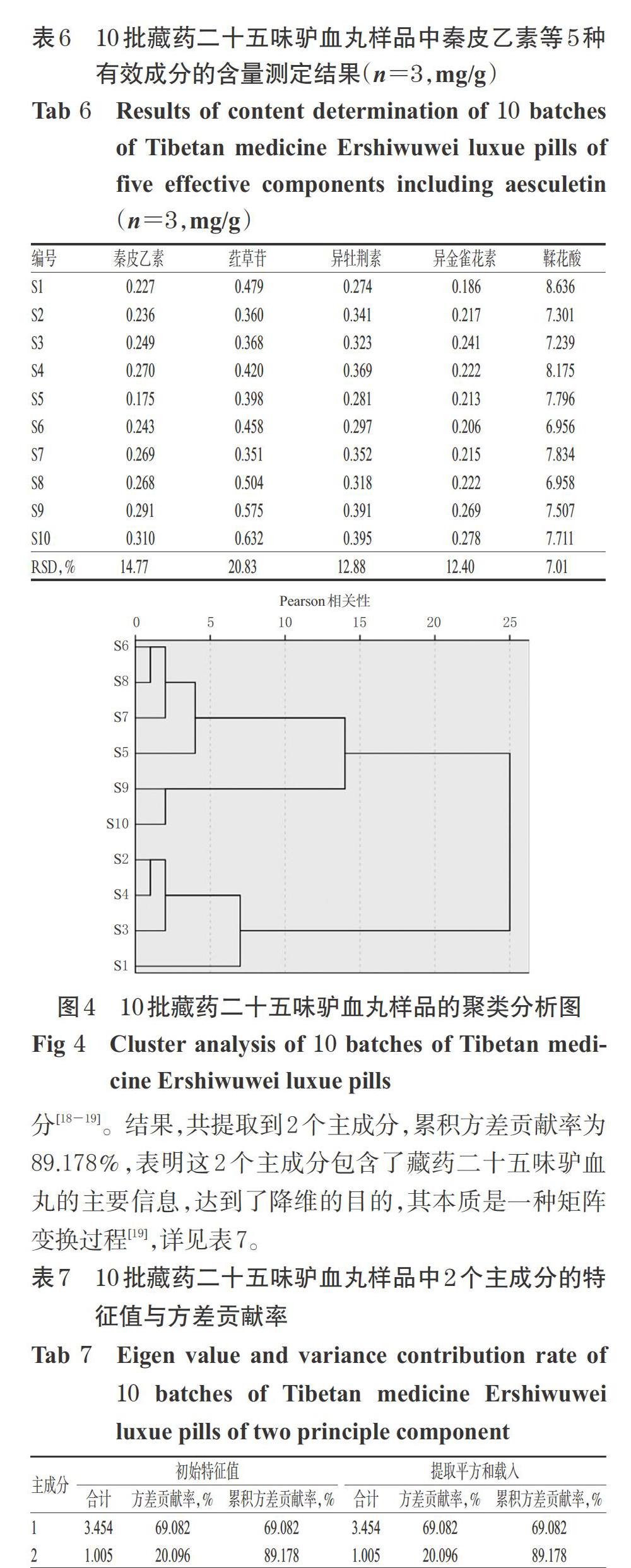
2.2.9 样品含量测定 取10批藏药二十五味驴血丸样品粉末,每份约0.5 g,按“2.2.1”项下方法制备供试品溶液,再按“2.2.2”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。每样品平行操作3次,取平均值,结果见表6。
2.3 聚类分析
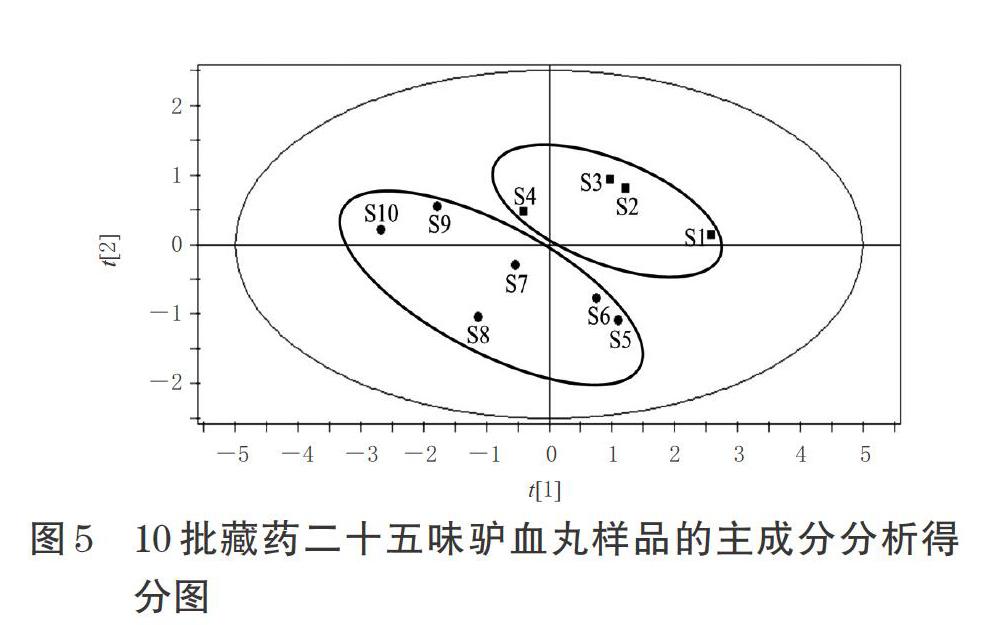
以10批藏药二十五味驴血丸指纹图谱中测定的5个已指认的共有峰(下同)的峰面积为变量,采用SPSS 19.0软件进行分析,以Pearson相关性为测度,采用组间联接法绘制聚类分析图,结果见图4。由图4可知,10批藏药二十五味驴血丸样品可聚为2类,其中S1~S4为一类、S5~S10为一类。
2.4 主成分分析
主成分分析能够将原有多个指标数据转化成一组若干个新的互不相關的综合变量,可用于全面反映多个原始数据的信息[17]。以10批藏药二十五味驴血丸指纹图谱中的5个共有峰的峰面积为变量,采用SPSS 19.0软件进行主成分分析,以特征值>1的成分为主成分[18-19]。结果,共提取到2个主成分,累积方差贡献率为89.178%,表明这2个主成分包含了藏药二十五味驴血丸的主要信息,达到了降维的目的,其本质是一种矩阵变换过程[19],详见表7。
以10批藏药二十五味驴血丸指纹图谱中的5个共有峰的峰面积为变量,采用SIMCA-P 11.5软件绘制主成分得分图。结果,10批藏药二十五味驴血丸样品可以被分为 2 类,其中S1~S4为一类、S5~S10为一类,与“2.3”项下聚类分析结果一致,详见图5。
3 讨论
本课题组前期分别对不同提取溶剂(甲醇、乙醇、80%甲醇、80%乙醇、60%甲醇和60%乙醇)、提取时间(20、30、40、50 min)、提取方式(超声、回流)、提取溶剂用量(20、30、40、50 mL)的提取效果进行了考察。结果,以80%乙醇30 mL超声30 min所得提取物的色谱峰数量较多且分離效果较好,故选择这种方式制备供试品溶液。同时,本课题组还考察了不同流动相(甲醇-0.1%磷酸水溶液、甲醇-0.2%磷酸水溶液、乙腈-0.1%磷酸水溶液、甲醇-水)、检测波长(330、350、370 nm)、色谱柱(Chromsil C18、Kromasil 100-5-C18、Zorbax Eclipse XDB-C18)、柱温(25、30、35 ℃)、流速(0.8、1.0、1.2 mL/min)、分析时间(45、60、75 min)等的分离效果。结果,以“2.1.3”项下色谱条件的分离效果较好,且色谱峰数量较多。
10批藏药二十五味驴血丸的HPLC 图谱与对照指纹图谱的相似度均大于0.98,表明不同厂家生产的藏药二十五味驴血丸的化学成分相似,一致性较好。含量测定结果显示,秦皮乙素、荭草苷、异牡荆素、异金雀花素和鞣花酸等5种成分含量的RSD分别为14.77%、20.83%、12.88%、12.40%、7.01%,表明不同厂家的藏药二十五味驴血丸质量存在一定差异,这可能与原药材基原的多样性和复杂性有关,包括土壤、气候等自然条件[20-21]。
藏药二十五味驴血丸的HPLC指纹图谱共有11个共有峰,经与混合对照品比对,指认了其中5个成分,分别为秦皮乙素、荭草苷、异牡荆素、异金雀花素和鞣花酸。聚类分析分析结果显示,10批藏药二十五味驴血丸样品可聚为2类,其中西藏厂家产样品聚为一类(S1~S4)、青海厂家产样品聚为另一类(S5~S10)。主成分分析结果显示,2个主成分的累积方差贡献率为89.178%,同样聚为两类,与聚类分析结果一致。这提示,不同厂家产藏药二十五味驴血丸含量差异较大,同一地区厂家的藏药二十五味驴血丸成分含量相似,这可能与不同厂家所用原药材的质量和储存方式、时间等有关[20-21]。除异金雀花素外,秦皮乙素、荭草苷、异牡荆素、鞣花酸均具有抗炎的生物活性,而藏药二十五味驴血丸具有抗风湿性关节炎的功效,提示这4个成分可能是该药抗炎作用的有效成分之一,可为下一步的药理机制研究提供参考。鉴于此,本研究后期将借用DNA条形码鉴定技术及核磁共振、红外光谱等现代化学鉴定技术进一步探讨。
综上所述,所建指纹图谱稳定、可行,含量测定方法简便、准确、重复性好,结合化学模式识别分析可用于藏药二十五味驴血丸的质量控制。
参考文献
[ 1 ] 宇妥·云丹贡布.四部医典[M].马世林,罗达尚,译.10版.上海:上海科学技术出版社,1987:164.
[ 2 ] 卫生部药典委员会.中华人民共和国卫生部药品标准:藏药:第1册[M].北京:化学工业出版社,1998:151.
[ 3 ] 晋仁云.藏药二十五味驴血丸治疗类风湿关节炎100例临床观察[J].心理月刊,2020,15(7):176.
[ 4 ] LIANG CY,JU WH,PEI SM,et al. Pharmacological activities and synthesis of esculetin and its derivatives:a mini-review[J]. Molecules,2017. DOI:10.3390/molecules22030387.
[ 5 ] RZODKIEWICZ P,G?SI?SKA E,GAJEWSKI M,et al. Esculetin reduces leukotriene B4 level in plasma of rats with adjuvant-induced arthritis[J]. Reumatologia,2016,54(4):161-164.
[ 6 ] LI CM,CAI CC,ZHENG XJ,et al. Orientin suppresses oxidized low-density lipoproteins induced inflammation and oxidative stress of macrophages in atherosclerosis[J]. Biosci Biotechnol Biochem,2020,84(4):774-779.
[ 7 ] 张良,张玉奎,戴荣继,等.射干叶中黄酮碳苷类化合物的药理作用研究进展[J].天然产物研究与开发,2010,22(4):728-730.
[ 8 ] HE M,MIN JW,KONG WL,et al. A review on the pharmacological effects of vitexin and isovitexin[J]. Fitoterapia,2016. DOI:10.1016/j.fitote.2016.09.011.
[ 9 ] 孙静.藏药线叶龙胆化学成分及生物活性的研究[D].兰州:兰州理工大学,2012.
[10] R?OS JL,GINER RM,MAR?N M,et al. A pharmacological update of ellagic acid[J]. Planta Med,2018,84(15):1068-1093.
[11] 武嘉庚,杨凤梅.二十五味驴血丸质量标准研究[J].中医药导报,2020,26(15):79-82、86.
[12] 金小朵. HPLC法测定二十五味驴血丸中没食子酸的含量[J].中国中医药科技,2013,20(2):168-169.
[13] 夏宇江,杨蒲,王曙.二十五味驴血丸的鉴别及没食子酸的含量测定[J].华西药学杂志,2003,18(1):53-54.
[14] 李强,杜思邈,张忠亮,等.中药指纹图谱技术进展及未来发展方向展望[J].中草药,2013,44(22):3095.
[15] 谷瑞敏.指纹图谱等同系数的理论、方法及应用[D].天津:天津大学,2008.
[16] 孙立丽,王萌,任晓亮. 化学模式识别方法在中药质量控制研究中的应用进展[J].中草药,2017,48(20):4339- 4345.
[17] 邱俊娜,张榆,张双,等.基于HPLC指纹图谱结合化学模式识别及定量测定的夏枯草质量控制研究[J].中草药,2020,51(10):2842-2850.
[18] 阿基业,何骏,孙润彬.代谢组学数据处理:主成分分析10个要点问题[J].药学学报,2018,53(6):929-937.
[19] 张文彤. SPSS统计分析高级教程[M].2版.北京:高等教育出版社,2013:214.
[20] 范刚,贾敏如,刘悦,等.藏药鉴定及质量控制研究现状[J].中国中药杂志,2016,41(4):559-561.
[21] 曹炯.浅谈影响藏药制剂质量因素有关问题分析[J].甘肃医药,2012,31(9):702-703.
(收稿日期:2020-09-18 修回日期:2020-12-29)
(编辑:陈 宏)
