白术乙醇提取物对秀丽隐杆线虫寿命的影响及其机制研究
2021-04-08赵建平吴丽敏鲁晓娜王辉王潘张振强徐江雁谢治深
赵建平 吴丽敏 鲁晓娜 王辉 王潘 张振强 徐江雁 谢治深

摘 要 目的:研究白術乙醇提取物(AM)对秀丽隐杆线虫(简称“N2线虫”)寿命的影响,并基于转录因子SKN-1/核因子E2相关因子2(Nrf2)信号通路探讨其作用机制。方法:将N2线虫分为空白对照组、阳性对照组(100 μmol/L姜黄素,下同)和AM低、中、高剂量组(100、200、300 μg/mL,下同),考察正常、氧化应激(40 mmol/L H2O2)条件下AM对N2线虫寿命的影响(以平均存活时间计)以及正常条件下AM对N2线虫繁殖能力的影响(以子代数量计)。用700 μmol/L H2O2建立小鼠神经瘤母细胞N2a氧化应激模型,采用MTT法考察阳性对照和AM低、中、高剂量对模型细胞存活率的影响。人胚胎肾上皮细胞293T转染Nrf2-抗氧化反应元件(ARE)质粒后,采用荧光素酶报告基因法考察阳性对照和AM低、中、高剂量作用24 h以及AM中剂量作用12、18、24 h对Nrf2-ARE荧光素酶活性的影响。采用实时定量聚合酶链式反应法考察阳性对照和AM低、中、高剂量对N2a细胞中Nrf2下游抗氧化基因NQO-1、HO-1 mRNA表达以及对N2线虫中SKN-1下游抗氧化基因GCS-1、GST-7、GST-10、HSP-60、HSP-16.2、SOD-3 mRNA表达的影响。结果:与空白对照组比较,阳性对照组和AM各剂量组N2线虫在正常、氧化应激下的平均存活时间均显著延长,第1天子代数量(除AM高剂量组外)、第2天子代数量(除AM低剂量组外)和总子代数量(除AM低剂量组外)均显著增加(P<0.05或P<0.01)。阳性对照组和AM中、高剂量组N2a细胞存活率显著高于模型组(P<0.05或P<0.01)。与空白对照组比较,阳性对照组和AM各剂量组293T细胞中Nrf2-ARE荧光素酶相对活性以及AM中剂量组293T细胞培养不同时间的Nrf2-ARE荧光素酶相对活性均显著增强(P<0.01),并有剂量依赖性和时间依赖性趋势。与空白对照组比较,阳性对照组和AM各剂量组N2a细胞/线虫中HO-1、NQO-1(除阳性对照组外)、GCS-1(除AM低剂量组外)、GST-7(除阳性对照组和AM低剂量组外)、GST-10、HSP-60(除AM低剂量组外)、HSP-16.2(除阳性对照组和AM低剂量组外)、SOD-3(除阳性对照组和AM低剂量组外)mRNA的相对表达量均显著升高(P<0.05或P<0.01)。结论:AM可延长N2线虫在正常和氧化应激状态下的寿命,并可提高线虫的繁殖能力,其作用机制可能与激活SKN-1/Nrf2信号通路有关。
关键词 白术;乙醇提取物;秀丽隐杆线虫;寿命;氧化应激;核因子E2相关因子2;SKN-1
ABSTRACT OBJECTIVE: To study the effects of Atractylodes macrocephala ethanol extract (AM) on life span of Caenorhabditis elegans (called N2 nematode for short), and to investigate its mechanism based on transcription factor SKN-1/nuclear factor E2 related factor 2 (Nrf2). METHODS: N2 nematode were divided into blank control group, positive control group (100 μmol/L curcumin, similarly hereinafter), AM low-dose, medium-dose and high-dose groups (100, 200, 300 μg/mL, similarly hereinafter). The effects of AM on the life span (by average survival time) of N2 nematode under normal condition and oxidant stress condition (40 mmol/L H2O2) as well as its effects on reproductive capability (by the number of filial generation) of N2 nematode under normal condition were investigated. 700 μmol/L H2O2 was used to establish neuroblastoma cells N2a oxidant stress model. Effects of positive control, low-dose, medium-dose and high-dose of AM on the survival rate of model cells were detected by MTT method. After human embryonic renal epithelial cells 293T were transfected with Nrf2-ARE plasmid, the effects of positive control and AM on luciferase activity of Nrf2-ARE were detected by luciferase reporter gene method at low, medium and high dose for 24 h and at medium dose for 12, 18 and 24 h. RT-PCR was used to detect the effects of positive control, low-dose, medium-dose and high-dose of AM on the mRNA expression of downstream genes NQO-1 and HO-1 of Nrf2 in N2a cells as well as mRNA expression of downstream genes GCS-1, GST-7, GST-10, HSP-60, HSP- 16.2 and SOD-3 of SKN-1 in N2 nematode. RESULTS: Compared with blank control group, average survival time of N2 nematode under normal and oxidant stress condition was significantly prolonged in positive control group and AM groups; the number of filial generation on the first day (except for AM high-dose group), the number of filial generation on the second day (except for AM low-dose group) and the total number of filial generation (except for AM low-dose group) were increased significantly (P<0.05 or P<0.01). The survival rate of N2a cells in positive control group, AM medium-dose and high-dose groups were significantly higher than that of model group (P<0.05 or P<0.01). Compared with blank control group, Nrf2-ARE luciferase relative activity of 293T cells in positive control group and AM groups as well as Nrf2-ARE luciferase relative activity of 293T cells in AM medium-dose group after different time of treatment were increased significantly (P<0.01), in dose-dependent and time-dependent trend. Compared with blank control group, mRNA relative expression of HO-1 and NQO-1 (except for positive control group), GCS-1(except for AM low-dose group), GST-7 (except for positive control group and AM low-dose group), GST-10 and HSP-60 (except for AM low-dose group), HSP-16.2 (except for positive control group and AM low-dose group) and SOD-3 (except for positive control group and AM low-dose group) were increased significantly (P<0.05 or P<0.01). CONCLUSIONS: AM can prolong the life span of N2 nematode under normal and oxidant stress condition and improve the its reproductive capacity, the mechanism of which may be associated with the activation of SKN-1/Nrf2 signaling pathway.
KEYWORDS Atractylodes macrocephala; Ethanol extract; Caenorhabditis elegans; Life span; Oxidant stress; Nrf2; SKN-1
中药白术为菊科植物白术Atractylodes macrocephala Koidz.的干燥根茎,始载于《神农本草经》。该药味苦、甘,性温,归脾、胃经,具有补气健脾、利水燥湿、安胎的功效,被誉为“脾脏补气健脾第一要药”[1-2]。唐《新修本草》载“白术作煎饵,久服轻身延年,不饥”,可见自古以来就有关于白术延长寿命的记载[3],但其作用机制尚不明确。
常用的模型动物如小鼠、大鼠等因寿命长、研究成本高、个体差异大等因素的限制,不适用于中药延寿作用的研究。秀丽隐杆线虫Caenorhabditis elegans具有寿命短、繁殖周期快、子代数目多、饮食单一可控、基因组序列完整且与哺乳动物同源基因多的特点,是研究衰老和寿命的良好模型,可用于延寿药物的高通量筛选[4-7]。H2O2是常见的氧化剂,常用来诱导氧化自由基的产生,其作用于小鼠神经瘤母细胞N2a造成的氧化损伤是一种常用的体外氧化应激模型[8]。人胚肾细胞293T是一种工具细胞,常用于检测外源基因的表达水平。SKN-1是一种非常重要的转录因子,既影响氧压力抗性又调控衰老[9];核因子E2相关因子2(Nrf2)-抗氧化反应元件(ARE)通路是机体抵御氧化应激的内在机制[10]。基于此,本文参考文献[11]方法用95%乙醇对白术进行提取,研究了白术乙醇提取物(AM)在正常和氧化应激条件下对秀丽隐杆线虫寿命的影响,并选用N2a细胞和293T细胞在分子水平上基于SKN-1/Nrf2通路探讨AM延长寿命的作用机制,旨在为深入研究白术提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:Series Ⅱ Water Jackxet 型CO2细胞培养箱和Multiskan GO型全波长酶标仪(美国Thermo Fisher Scientific公司)、FLUO star OPTIMA型多功能酶标仪(德国BMG Labtech公司)、SW-CJ-ZF型超净工作台(苏州苏洁净化设备有限公司)、Eclipset S100型倒置显微镜(日本Nikon公司)、SMZ-168型体式显微镜(中国麦克奥迪实业集团有限公司)、Microfuge 20R型冷冻离心机(美国Beckman Coulter公司)、7500 Fast型实时荧光定量聚合酶链反应(PCR)仪(美国ABI公司)。
1.2 主要药品与试剂
白术饮片购自河南省焦作市,经河南中医药大学付钰副教授鉴定为菊科植物白术A. macrocephala Koidz.的干燥根茎,凭证样本(编号BZ1810)已保存于河南中医药大学中医科学院。
姜黄素对照品(批号C10372682,纯度≥99.7%)和MgSO4(批号C10238019)均购自上海麦克林生化科技有限公司,琼脂粉、酵母粉、胆固醇、胰蛋白胨、青-链霉素混合液、MTT试剂、胰酶、NaCl(批号分别为310C023、106L054、LK40Q28、325D051、20191126、725C056、20191128、726F0315)均购自北京索莱宝科技有限公司,CaCl2(批号SLBK1794V)购自美国Sigma-Aldrich公司,Na2HPO4·12H2O、KH2PO4(批号分别为20160219、20160226)均购自国药集团化学试剂有限公司,DMEM高糖培养基(批号10013031)购自美国Corning公司,胎牛血清(批号42Q0682K)购自美国Gibco公司,H2O2(批号I1422134)购自上海阿拉丁生化科技股份有限公司,PolyJet体外转染试剂(批号61758)购自深圳恩科生物科技有限公司,荧光素酶报告基因试剂盒(批号0000312919)购自美国Promega公司,BeyoRTTM Ⅲ First Strand cDNA Synthesis Kit逆转录试剂盒(批号103118190503)购自上海碧云天生物技术有限公司,Power UpTM SYBRTM Green Master Mix试剂盒(批号00837276)和Trizol Reagent(批号229009)均购自美国Thermo Fisher Scientific公司;二甲基亚砜(DMSO)、氯仿、异丙醇、乙醇等其余试剂均为分析纯,水为超纯水。
1.3 线虫与菌株
普通野生型秀丽隐杆线虫(株系N2,以下简称“N2线虫”)和尿嘧啶缺陷型大肠埃希菌OP50(Escherichia Coli OP50)均购自美国秀丽隐杆线虫遗传中心(Caenorhabditis Genetics Center)。
1.4 细胞与质粒
小鼠神经瘤母细胞N2a和人胚肾细胞293T均购自美国ATCC细胞库,Nrf2-ARE质粒购自美国Promega公司。
2 方法
2.1 溶液的制备
2.1.1 M9溶液 准确称取Na2HPO4·12H2O 15.0 g、KH2PO4 3.0 g、NaCl 5.0 g、MgSO4 0.12 g,用水800 mL溶解后再定容至1 000 mL,混匀,121 ℃高压蒸汽灭菌30 min,即得。
2.1.2 AM溶液 采取冷浸法制備AM[11]。称取白术饮片2 kg,用2倍量(L/kg)的95%乙醇浸渍,浸渍3次,每次1周;浸提液滤过后合并,减压浓缩得到AM浸膏359 g(得率为18%)。将上述浸膏置于4 ℃冷藏,备用。使用前,将白术浸膏溶于DMSO 1 mL中,制成质量浓度为300 mg/mL(以提取物量计)的AM贮备液,经0.22 μm滤膜滤过除菌,于-20 ℃保存;后续试验时以M9溶液(用于线虫实验,下同)或含10%胎牛血清、1%青-链霉素混合液的DMEM高糖培养基(后文简称为“完全培养基”,用于细胞试验,下同)将其稀释至所需浓度即可(体系中DMSO终浓度<1‰)。
2.1.3 阳性对照溶液 精密称取姜黄素对照品36.84 mg,溶于DMSO 1 mL中,制成浓度为100 mmol/L的贮备液,经0.22 μm滤膜滤过除菌,于-20 ℃保存;后续试验时以M9溶液或完全培养基将其稀释至所需浓度即可(体系中DMSO终浓度<1‰)。
2.1.4 NGM固体培养基 称取NaCl 0.6 g、琼脂粉3.4 g、胰蛋白胨0.5 g,加水195 mL,摇匀,121 ℃高压灭菌30 min;冷却至约55 ℃时,再依次加入1 mol/L的MgSO4 溶液0.2 mL、5 mg/mL的胆固醇溶液0.2 mL、1 mol/L的CaCl2 溶液0.2 mL、用0.22 μm滤膜滤过除菌的1 mol/L的磷酸盐缓冲液(pH 6.0)5 mL,混匀后倒入无菌的培养皿中,每板10 mL,晾干,密封置于4 ℃冰箱中,备用。
2.2 N2线虫培养与同期化处理
将N2线虫接种于已涂布E.coli OP50的NGM固体培养基中,20 ℃恒温培养,及时观察其生长状态并传代。转移生殖期的N2线虫到新的NGM固体培养基上产卵2 h进行同期化处理,并将同期化后的L4期N2线虫用于实验。
2.3 细胞培养
将N2a细胞和293T细胞均接种于完全培养基中,于37 ℃、5%CO2培养箱中培养,隔日换液,待细胞处于对数生长期时接种于不同培养板中,用于试验。
2.4 AM对N2线虫寿命的影响
实验设置空白对照组、阳性对照组(100 μmol/L 姜黄素,剂量参考文献[12]和预实验结果设置)和AM低、中、高剂量组(100、200、300 μg/mL,以提取物计,剂量设置参考预实验结果设置,下同)。用M9溶液将姜黄素和AM贮备液稀释至实验所需终浓度,于每个NGM固体培养基中加入相应药液500 μL,待药液完全渗透后,再加入E.coli OP50菌液(以LB液体培养基为溶剂)100 μL,空白对照组加入等体积M9溶液和E.coli OP50菌液,37 ℃培养过夜,即实验NGM平板制备完成。将同期化的L4期N2线虫转移至各组实验NGM平板上,每组100条,于20 ℃恒温培养箱中培养。从N2线虫进入产卵期起,每24 h转至1个新的实验NGM平板上(简称为“转板”),至不再产卵时改为隔日转板1次。每日定时用体式显微镜观察,统计每组N2线虫的个体死亡数量,直至N2线虫全部死亡(以线虫个体对机械性刺激无反应视为死亡),计算各组线虫的平均存活时间。剔除标准:(1)爬至平板壁或盖上而干死;(2)线虫死亡后虫卵在体内孵化;(3)钻入琼脂中。实验重复3次。
2.5 AM对氧化应激下N2线虫寿命的影响
参考文献[13]方法并稍作修改进行实验。按“2.4”项下方法分组、制备实验NGM平板并加入N2线虫,于20 ℃恒温培养箱中培养3 d后,转移各组N2线虫至含40 mmol/L H2O2的24孔板中模拟氧化应激状态,每孔15条,每组60条,使用体式显微镜观察,计数每小时N2线虫的个体死亡数量,直至N2线虫全部死亡,计算各组线虫的平均存活时间。死亡标准和剔除标准同“2.4”项。实验重复3次。
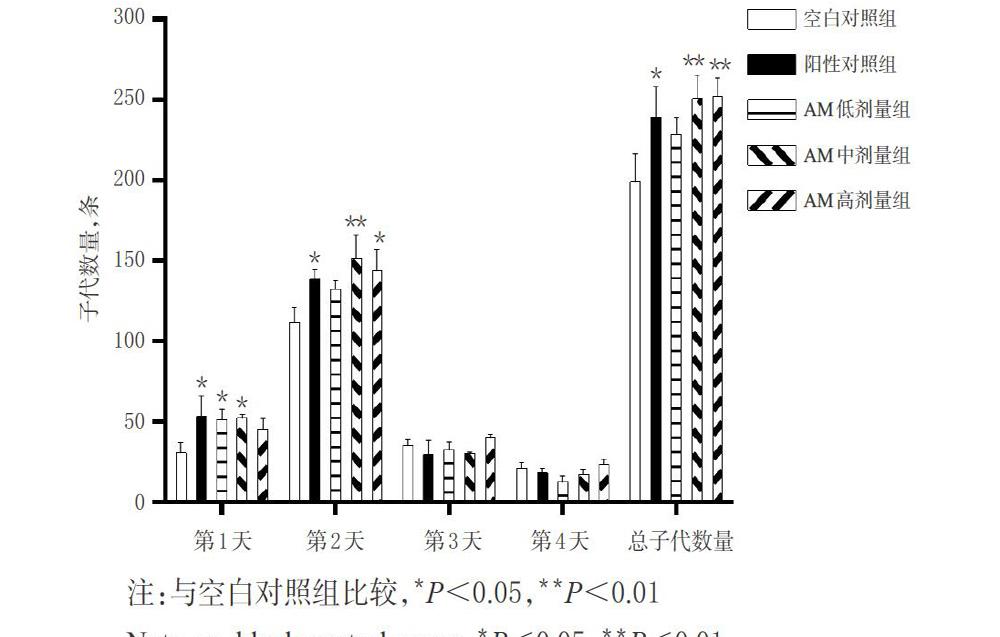
2.6 AM对N2线虫繁殖能力的影响
参考文献[14]方法进行实验。按“2.4”项下方法分组、制备实验NGM平板并加入N2线虫,于20 ℃恒温培养箱中培养,此时记为生殖实验第1天;每日转板1次,直至N2线虫丧失生殖能力(以N2线虫转移至新的实验NGM平板中,24 h内未见新卵视为其丧失生殖能力)。20 ℃下孵育产卵板,孵化后,使用体式显微镜观察并記录子代数量,以子代数量反映繁殖能力。实验重复3次。
2.7 AM对氧化应激下N2a细胞存活率的影响
采用MTT法进行检测。将N2a细胞以2×104个/孔的密度接种于96孔板中,于37 ℃、5%CO2培养箱中培养24 h后,将其随机分为空白对照组、模型组、阳性对照组(100 ?mol/L 姜黄素)和AM低、中、高剂量组(100、200、300 μg/mL),每组设6个复孔。用完全培养基将姜黄素和AM贮备液稀释至所需终浓度,各给药组加入含相应药物的完全培养基100 μL,空白对照组加入等体积完全培养基。培养2 h后,除空白对照组外的其余各组均加入H2O2(终浓度为700 ?mol/L)复制氧化应激模型,继续培养22 h;加入5 mg/mL MTT溶液20 ?L,培养4 h,弃去培养基;每孔加DMSO 150 μL,摇床振摇10 min,使用全波长酶标仪于490 nm波长处测定光密度(OD)值并计算细胞存活率:细胞存活率(%)=检测组OD值/空白对照组OD值×100%。试验重复3次。
2.8 AM对293T细胞中Nrf2-ARE荧光素酶活性的影响
将293T细胞以4×104个/孔的密度接种于96孔板中,按“2.7”项下方法分组(不设模型组),每组设6个复孔。待细胞融合至80%时,每孔均瞬时转染Nrf2-ARE质粒100 ng,并于转染6 h后更换完全培养基;继续培养18 h,弃去培养基,加入与“2.7”项下相同的含药完全培养基100 μL,培养24 h;另外AM中剂量组分别培养12、18、24 h,采用荧光素酶报告基因法测定Nrf2-ARE荧光素酶活性。具体操作如下:弃培养基,加入报告基因裂解液100 μL,室温振摇30 min,每孔转移裂解物30 μL到96孔全白微孔板中,随后加入荧光素酶检测试剂50 μL,立即使用多功能酶标仪检测各孔的化学发光值并计算Nrf2-ARE荧光素酶相对活性:相对活性=检测组化学发光值/空白对照组化学发光值。试验重复3次。
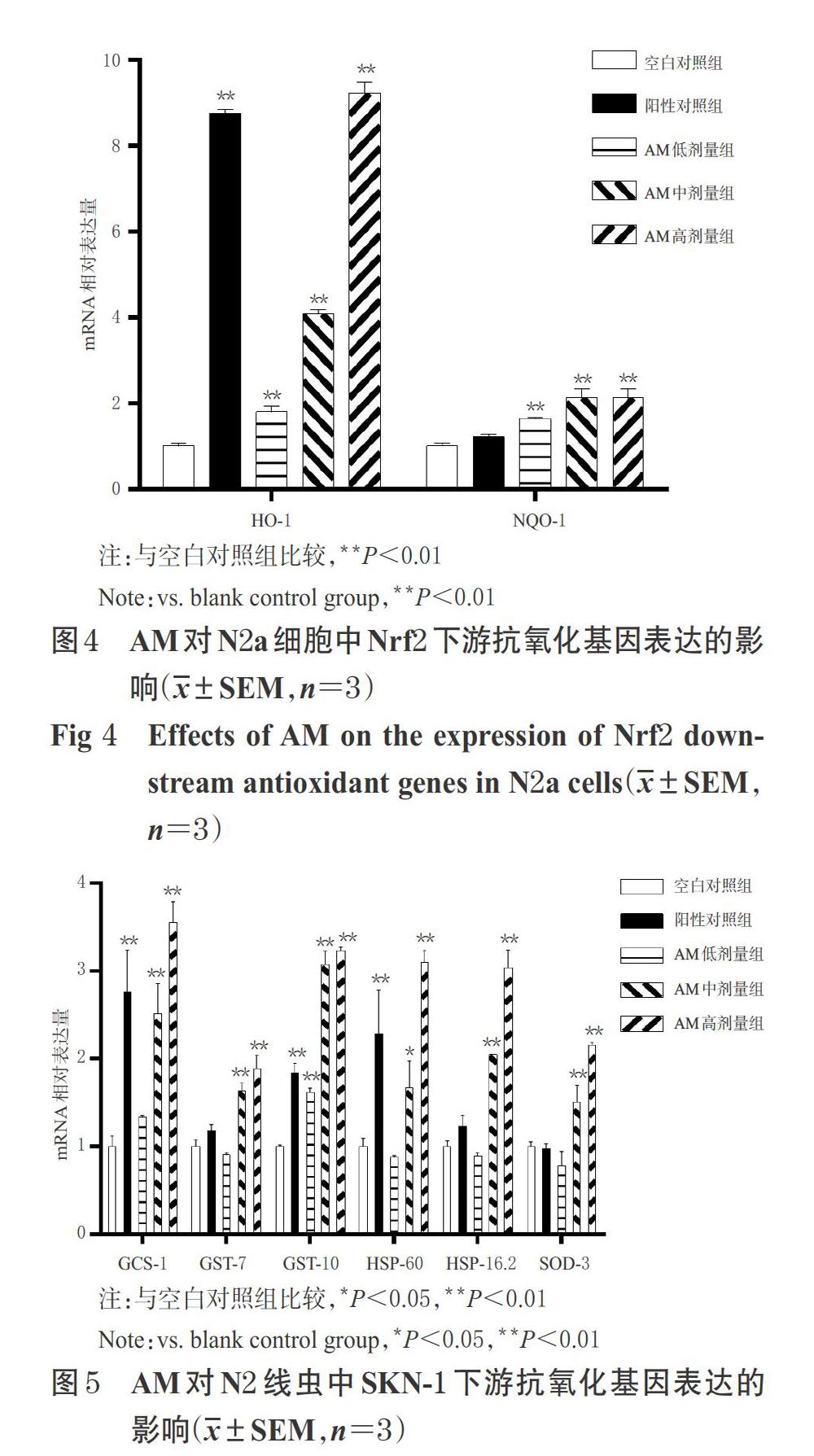
2.9 AM对N2a细胞中Nrf2下游抗氧化基因表达的影响
将N2a细胞以4×105个/孔的密度接种于6孔板中,按“2.8”项下方法进行细胞分组、给药,每组设6个复孔。培养24 h后,采用Trizol法提取细胞总RNA,按照BeyoRTTM Ⅲ First Strand cDNA Synthesis Kit逆转录试剂盒说明书逆转录得cDNA,使用Power UpTM SYBRTM Green Master Mix试剂盒以实时荧光定量PCR仪进行扩增。反应体系(共10 μL):cDNA模板4 μL,SYBRTM Green Mix试剂5 μL,上、下游引物各0.5 μL。反应条件:50 ℃加热2 min,95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸30 s,共40个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,采用2-ΔΔCt法分析目标基因HO-1、NQO-1 mRNA的表达水平,以空白对照组为标准计算相对表达量。试验重复3次。N2a细胞中Nrf2下游抗氧化基因的引物序列及产物片段长度见表1。
2.10 AM对N2线虫中SKN-1下游抗氧化基因表达的影响
按“2.4”项下方法分组、制备实验NGM平板,挑取L4期N2线虫到实验NGM平板上,每组800条,于20 ℃恒温培养箱中培养3 d后,分别收集各组线虫,加入Trizol试剂匀浆后提取线虫总RNA,逆转录及荧光定量PCR操作同“2.9”项。以PMP-3作为内参,按“2.9”项下方法分析目标基因GCS-1、GST-7、GST-10、HSP-60、HSP-16.2、SOD-3 mRNA的相对表达量。试验重复3次。N2线虫中SKN-1下游靶基因的引物序列及产物片段长度见表2。
2.11 统计学方法
采用GraphPad Prism 6.0软件对数据进行统计分析。数据以x±SEM表示,组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 AM对N2线虫寿命的影响
空白对照组、阳性对照组和AM低、中、高剂量组N2线虫的平均存活时间分别为(10.781±2.077)、(11.883±3.211)、(11.819±3.033)、(12.634±3.341)、(14.453±3.163) d(n=3)。与空白对照组比较,阳性对照组和AM各剂量组N2线虫的平均存活时间均显著延长(P<0.05或P<0.01)。
3.2 AM对氧化应激下N2线虫寿命的影响
空白对照组、阳性对照组和AM低、中、高剂量组N2线虫在氧化应激下的平均存活时间分别为(6.238±2.161)、(7.061±2.359)、(7.429±2.284)、(7.764±2.659)、(7.709±2.572) h(n=3)。与空白对照组比较,除阳性对照组外,AM各剂量组N2线虫在氧化应激下的平均存活时间均显著延长(P<0.05或P<0.01)。
3.3 AM对N2线虫繁殖能力的影响
与空白对照组比较,阳性对照组和AM低、中剂量组N2线虫第1天的子代数量,阳性对照组和AM中、高剂量组N2线虫第2天的子代数量以及总子代数量均显著增加(P<0.05或P<0.01)。AM对N2线虫繁殖能力的影响见图1。
3.4 AM对氧化应激下N2a细胞存活率的影响
与空白对照组比较,模型组N2a细胞的存活率显著降低(P<0.01)。与模型组比较,阳性对照组和AM中、高剂量组N2a细胞的存活率均显著升高(P<0.05或P<0.01)。AM对氧化应激下N2a细胞存活率的影响见图2。
3.5 AM对293T细胞中Nrf2-ARE荧光素酶活性的影响
与空白对照组比较,阳性对照组和AM各剂量组293T细胞中Nrf2-ARE荧光素酶相对活性以及AM中剂量组293T细胞培养不同时间的Nrf2-ARE荧光素酶相对活性均显著增强(P<0.01),且有剂量依赖性和时间依赖性趋势。AM对293T细胞中Nrf2-ARE荧光素酶活性的影响见图3。
3.6 AM对N2a细胞中Nrf2下游抗氧化基因表达的影响
与空白对照组比较,AM各剂量组N2a细胞中HO-1、NQO-1 mRNA的相对表达量以及阳性对照组N2a细胞中HO-1 mRNA的相对表达量均显著升高(P<0.01)。AM对N2a细胞中Nrf2下游抗氧化基因表達的影响见图4。
3.7 AM对N2线虫中SKN-1下游抗氧化基因表达的影响
与空白对照组比较,阳性对照组和AM各剂量组线虫中GST-10 mRNA的相对表达量,阳性对照组和AM中、高剂量组线虫中GCS-1、HSP-60 mRNA的相对表达量以及AM中、高剂量组线虫中GST-7、HSP-16.2、SOD-3 mRNA的相对表达量均显著升高(P<0.05或P<0.01)。AM对N2线虫中SKN-1下游抗氧化基因表达的影响见图5。
4 讨论
本研究以N2线虫为研究对象,对白术延寿作用进行了评估。在寿命相关研究中,部分学者认为繁殖能力与寿命之间可能存在“权衡利弊”的关系,即通过抑制繁殖能力来发挥延长寿命作用[15-16]。本研究结果表明,AM在正常和氧化应激条件下均可显著延长N2线虫的寿命,还可在培养早期(第1、2天)提高N2线虫的繁殖能力,提示白术具有延寿作用,且不以抑制繁殖能力为代价,这与白术的安胎作用相符。
已有研究表明,白术可通过清除自由基发挥抗衰老作用[17]。自由基是寿命的主要决定因子[18-20],其不仅在需氧生物体正常新陈代谢过程中产生,而且亦可在受各种刺激因子(如环境温度、药物等)短时间作用下大量产生,从而导致机体发生氧化应激[21]。姜黄素是一种常用的抗氧化剂,可通过调控Nrf2-ARE信号通路来减少细胞氧化应激损伤,从而起到预防和治疗相关疾病的作用[22]。已有研究表明,姜黄素可以延长N2线虫的寿命[12],故本研究将其作为阳性对照药物。
Nrf2是一种转录因子,可诱导大量抗氧化和解毒基因的表达:正常条件下,Kelch样环氧氯丙烷相关蛋白1(Keap1)在细胞质中整合Nrf2,而氧化应激使Nrf2从Keap1解离并导致Nrf2易位到细胞核中,与ARE结合,激活编码抗氧化相关酶的基因HO-1和NQO-1,从而发挥抗氧化损伤作用[23-25]。激活Nrf2可减少氧化应激,从而产生抗衰老和保护机体的作用[26-28]。本研究结果表明,AM可以提高氧化应激下N2a细胞的存活率,提高Nrf2下游抗氧化基因HO-1、NQO-1 mRNA的相对表达量,提示白术可能通过激活Nrf2来发挥抗衰老和保护作用。
在秀丽隐杆线虫中,SKN-1是哺乳动物Nrf2的同源基因[29-30]。在一定条件刺激下,肠道内的SKN-1蛋白在细胞核内积累,并激活其下游抗氧化基因GCS-1、GST-7、GST-10、HSP-60、HSP-16.2、SOD-3的表达,从而提高秀丽隐杆线虫抗氧化应激及抗衰老的能力[31-33]。同时,SKN-1在延长秀丽隐杆线虫寿命方面也具有重要作用,提示Nrf2蛋白可能在整个衰老过程中起重要作用[34]。本研究结果表明,AM可上调GCS-1、GST-7、GST-10、HSP-60、HSP-16.2、SOD-3 mRNA的表达,提示白术可激活SKN-1通路。
综上所述,白术可以延长N2线虫在正常和氧化应激状态下的寿命,并且可以提高其繁殖能力;作用机制可能是通过激活SKN-1/Nrf2信号通路、促进其下游靶基因的表达从而发挥抗氧化和保护机体的作用。本研究为白术的延寿作用提供了新的思路和方法,但还需要进行更深入的机制研究。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:107.
[ 2 ] 张晓娟,左冬冬.白术化学成分及药理作用研究新进展[J].中医药信息,2018,35(6):101-106.
[ 3 ] 葛珊珊,宋贵发,王震,等.白术药用浅谈[J].现代中医药,2015,35(2):57-59.
[ 4 ] DENZEL MS,LAPIERRE LR,MACK HID. Emerging topics in C. elegans aging research:transcriptional regulation,stress response and epigenetics[J]. Mech Ageing Dev,2019,177:4-21.
[ 5 ] MAGLIONI S,ARSALAN N,VENTURA N. C. elegans screening strategies to identify pro-longevity interventions[J]. Mech Ageing Dev,2016,157:60-69.
[ 6 ] PARK HEH,JUNG Y,LEE SJV. Survival assays using Caenorhabditis elegans[J]. Mol Cells,2017,40(2):90-99.
[ 7 ] MARKAKI M,TAVERNARAKIS N. Caenorhabditis elegans as a model system for human diseases[J]. Curr Opin Biotechnol,2020,63:118-125.
[ 8 ] SUN Y,CHENG M,LIANG X,et al. JAK2/STAT3 involves oxidative stress-induced cell injury in N2a cells and a rat MCAO model[J]. Int J Neurosci,2020,130(11):1142-1150.
[ 9 ] DUANGJAN C,RANGSINTH P,GU X,et al. Glochidion zeylanicum leaf extracts exhibit lifespan extending and oxidative stress resistance properties in Caenorhabditis elegans via DAF-16/FoxO and SKN-1/Nrf-2 signaling pathways[J]. Phytomedicine,2019,64:153061.
[10] JIANG T,SUN Q,CHEN S. Oxidative stress:a major pathogenesis and potential therapeutic target of antioxidative agents in parkinsons disease and alzheimers disease[J]. Prog Neurobiol,2016,147:1-19.
[11] 方学敏,曹岗,蔡银燕.白术化学成分的制备研究[J].中华中医药学刊,2013,31(5):993-995.
[12] BIELAK-ZMIJEWSKA A,GRABOWSKA W,CIOLKO A,et al. The role of curcumin in the modulation of ageing[J]. Int J Mol Sci,2019,20(5):1239.
[13] 金司儀.三七粉延缓秀丽隐杆线虫衰老的作用机制及其稳定性研究[D].武汉:湖北中医药大学,2019.
[14] 周玲,王平,蔡铭,等.补肾化痰复方对秀丽线虫神经保护的影响[J].时珍国医国药,2018,29(10):2348-2351.
[15] 唐进法,张帆,李宇辉,等.何首乌乙酸乙酯提取物对秀丽线虫的抗衰老作用研究[J].中国药房,2017,28(4):493-496.
[16] MACEDO F,ROMANATTO T,ASSIS CGD,et al. Life- span-extending interventions enhance lipid-supported mitochondrial respiration in Caenorhabditis elegans[J]. FASEB J,2020,34(8):9972-9981.
[17] 李佳瑛,景永帅,张丹参.白术在老年痴呆与认知障碍相关疾病的药理作用[J].中国药理学与毒理学杂志,2019,33(6):468-469.
[18] CHANDRASEKARAN A,IDELCHIK MDPS,MELENDEZ JA. Redox control of senescence and age-related disease[J]. Redox Biol,2017,11:91-102.
[19] 周玲,黄敏,王长江,等.基于秀丽线虫SKN-1/Nrf2调控的中药抗氧化和缓解Aβ毒性作用的研究进展[J].时珍国医国药,2018,29(1):176-178.
[20] WEI Y,KENYON C. Roles for ROS and hydrogen sulfide in the longevity response to germline loss in Caenorhabditis elegans[J]. P Natl Acad Sci U S A,2016,113(20):E2832-E2841.
[21] BHAT AH,DAR KB,ANEES S,et al. Oxidative stress,mitochondrial dysfunction and neurodegenerative disea- ses;a mechanistic insight[J]. Biomed Pharmacother,2015,74:101-110.
[22] 李军,熊琨,龚元,等.基于信号转导通路的姜黄素抗氧化机制研究进展[J].中草药,2016,47(13):2373-2380.
[23] 胡流芳,王迎,任汝静,等. Keap1-Nrf2/ARE信号通路的抗氧化应激作用及其调控机制[J].国际药学研究杂志,2016,43(1):146-152、166.
[24] 庞敏,单宇,王菲菲,等.诸葛菜种子水提物对硫代乙酰胺诱导小鼠急性肝损伤的保护作用研究[J].中国中药杂志,2020,45(6):1399-1405.
[25] 郭丰,黄山,李斌.基于Nrf2/HO-1信号通路的夜关门提取物对谷氨酸诱导小鼠海马细胞HT22损伤的保护作用及机制研究[J].中国药房,2020,31(11):1303-1308.
[26] 汪刚,刘莹,侯雪峰,等.川芎提取物通过激活Nrf2通路对抗心肌缺血大鼠氧化应激损伤[J].中国中药杂志,2017,42(24):4834-4840.
[27] 高琛,支应鹏.淫羊藿次苷Ⅱ调节miR-141-3p/Notch/Nrf2轴对局灶性脑缺血模型大鼠神经功能的改善作用研究[J].中国药房,2020,31(19):2386-2391.
[28] BUENDIA I,MICHALSKA P,NAVARRO E,et al. Nrf2- ARE pathway:an emerging target against oxidative stress and neuroinflammation in neurodegenerative diseases[J].Pharmacol Ther,2016,157:84-104.
[29] COLONNELLO A,AGUILERA-PORTILLO G,RUBIO- L?PEZ LC,et al. Comparing the neuroprotective effects of caffeic acid in rat cortical slices and Caenorhabditis elegans:involvement of Nrf2 and SKN-1 signaling pathways[J]. Neurotox Res,2020,37(2):326-337.
[30] XU Z,HU Y,DENG Y,et al. WDR-23 and SKN-1/Nrf2 coordinate with the BLI-3 dual oxidase in response to iodide-triggered oxidative stress[J]. G3(Bethesda),2018,8(11):3515-3527.
[31] GANNER A,GERBER J,ZIEGLER AK,et al. CBP-1/p300 acetyltransferase regulates SKN-1/Nrf cellular le- vels,nuclear localization,and activity in C.elegans[J]. Exp Gerontol,2019,126:110690.
[32] BLACKWELL TK,STEINBAUGH MJ,HOURIHAN JM,et al. SKN-1/Nrf,stress responses,and aging in Caenorhabditis elegans[J]. Free Radical Bio Med,2015,88:290-301.
[33] GOVINDAN S,AMIRTHALINGAM M,DURAISAMY K,et al. Phytochemicals-induced hormesis protects Caenorhabditis elegans against α-synuclein protein aggregation and stress through modulating HSF-1 and SKN-1/Nrf2 signaling pathways[J]. Biomed Pharmacother,2018,102:812-822.
[34] TULLET JMA,GREEN JW,AU C,et al. The SKN-1/Nrf2 transcription factor can protect against oxidative stress and increase lifespan in C.elegans by distinct mechanisms[J]. Aging Cell,2017,16(5):1191-1194.
(收稿日期:2020-10-05 修回日期:2021-01-24)
(編辑:邹丽娟)
