黄瓜子多糖的分离、纯化和体外抗氧化活性研究
2021-04-08张志宏邢娜彭东辉王秋红匡海学
张志宏 邢娜 彭东辉 王秋红 匡海学
摘 要 目的:對黄瓜子多糖进行分离、纯化,并考察其体外抗氧化活性。方法:采用水提醇沉法提取黄瓜子粗多糖(CCL),然后以Amberlite FPA90Cl阴离子和Amberlite FPC3500H阳离子串联交换树脂柱和离子交换纤维素DEAE Cellulose 52柱对CCL进行分离、纯化得到CCL-M2、CCL-M3、CCL-M6 等3种多糖。结合高效液相色谱-蒸发光散射法、超高效液相色谱-四极杆飞行时间质谱法和紫外、红外光谱等多种技术对3种均一多糖的纯度、分子量、结构和单糖组成等进行分析。以维生素C(VC)为阳性对照,考察CCL-M2、CCL-M3、CCL-M6(质量浓度均为0.4、0.8、1.2、1.6、2.0 mg/mL)对1,1-二苯基-2-三硝基苯肼自由基(DPPH·)、羟基自由基(·OH)、超氧阴离子自由基(O2-·)的清除能力,并计算其半数清除浓度(IC50)。结果:CCL-M2、CCL-M3、CCL-M6均为吡喃糖形式的均一多糖,分子量分别为9.614×106、2.024×107、3.343×107 Da。CCL-M2的单糖组成为鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖,其摩尔比为5.1 ∶ 2.6 ∶ 1.7 ∶ 1.4 ∶ 31.6;CCL-M3和CCL-M6的单糖组成均为甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖,其摩尔比分别为1.7 ∶ 3.8 ∶ 6.4 ∶ 3.3 ∶ 1.3和1.3 ∶ 3.0 ∶ 3.2 ∶ 4.4 ∶ 8.9。体外抗氧化活性结果显示,3种均一多糖对DPPH·、·OH、O2-·均具有一定的清除活性,其对DPPH·的清除活性强弱顺序为VC>CCL-M2>CCL-M3>CCL-M6(IC50依次为0.309、1.240、1.489、1.713 mg/mL),对·OH的清除活性强弱顺序为VC>CCL-M2>CCL-M6>CCL-M3(IC50依次为0.968、1.032、1.233、1.356 mg/mL),对O2-·的清除活性强弱顺序为VC>CCL-M2>CCL-M3>CCL-M6(IC50依次为0.335、0.379、0.812、1.662 mg/mL)。结论:从黄瓜子中分离得到3种吡喃糖形式的均一多糖均具有一定的体外抗氧化活性,其中以CCL-M2的活性最强。
关键词 黄瓜子;均一多糖;分离;纯化;抗氧化活性
ABSTRACT OBJECTIVE: To isolate and purify the polysaccharides from Cucumis satiuus, and to investigate its in vitro antioxidant activity. METHODS: The crude polysaccharides (CCL) were extracted from C. satiuus by water extraction and alcohol precipitation. CCL was separated and purified on Amberlite FPA90Cl anion and Amberlite FPC3500H cation exchange resin column and DEAE cellulose 52 column, so as to obtain 3 kinds of polysaccharides as CCL-M2, CCL-M3, CCL-M6. The purity, molecular weight, structure and monosaccharide composition of 3 kinds of polysaccharides were analyzed by HPLC-ELSD, UPLC-QTOF/MS, UV and IR. Using vitamin C (VC) as positive control, the scavenging activity of CCL-M2, CCL-M3 and CCL-M6 (0.4, 0.8, 1.2, 1.6, 2.0 mg/mL) to 1,1-dibenzene-2-trinitrobenzene free radicals (DPPH·), hydroxyl free radicals (·OH) and superoxycyclic anion free radicals (O2-·) were investigated, and IC50 was calculated. RESULTS: CCL-M2, CCL-M3 and CCL-M6 were homogeneous polysaccharides in the form of pyranose, with molecular weights of 9.614×106, 2.024×107 and 3.343×107 Da, respectively. CCL-M2 monosaccharides were composed of rhamnose, semi-lactose aldehyde acid, glucose, semi-lactose and arabic sugar, with a molar ratio of 5.1 ∶ 2.6 ∶ 1.7 ∶ 1.4 ∶ 31.6. CCL-M3 and CCL-M6 monosaccharides were composed of mannose, rhamnose, glucose, semi-lactose, arabic sugar, with a molar ratio of 1.7 ∶ 3.8 ∶ 6.4 ∶ 3.3 ∶ 1.3 and 1.3 ∶ 3.0 ∶ 3.2 ∶ 4.4 ∶ 8.9. The results of antioxidant activity in vitro showed that 3 kinds of homogeneous polysaccharides had certain scavenging activity on DPPH·, ·OH and O2-·; the order of scavenging activity to DPPH· was VC>CCL-M2>CCL-M3>CCL-M6 (IC50 was 0.309, 1.240, 1.489 and 1.713 mg/mL); the order of scavenging activity to ·OH was VC>CCL-M2>CCL-M6>CCL-M3 (IC50 was 0.968, 1.032, 1.233, 1.356 mg/mL); the order of scavenging activity to O2-· was VC>CCL-M2>CCL-M3>CCL-M6 (IC50 was 0.335, 0.379, 0.812, 1.662 mg/mL). CONCLUSIONS: 3 kinds of monosaccharides in the form of pyranose are isolated from C. satiuus, and all of them have antioxidant activity in vitro, and CCL-M2 is the best.
KEYWORDS Cucumis satiuus; Homogeneous polysaccharides; Separation; Purification; Antioxidant activity
黄瓜子为葫芦科药食同源植物黄瓜Cucumis satiuus L.的干燥成熟种子。夏、秋二季取种子成熟的老黄瓜,剖开,取出种子,晒干,即得[1]。黄瓜子主要含有糖和苷类、三萜类、植物甾醇类、脂肪酸类、氨基酸类等成分[2],具有舒筋接骨、祛风消疾的功效,可用于骨折筋伤、风湿痹痛、劳伤咳嗽等[3]。多糖是继蛋白质、核酸和脂类之后的维持人类生命的第四大重要物质,与机体免疫功能的调节、细胞与细胞之间的识别、细胞间物质的运输、癌症的诊断与治疗等密切相关[4-6]。随着多糖研究的大量开展,中药多糖的抗病毒、降血糖、抗肿瘤、降血脂、抗氧化、抗神经炎和调节免疫等药理活性被逐渐证实[7]。但目前针对黄瓜子的研究多集中在小分子物质上,而对于黄瓜子多糖的研究鲜有报道。有研究指出,黄瓜子具有抑制自由基产生并加速自由基清除的作用,具有较强的抗氧化能力[3],但该作用是否与黄瓜子多糖有关尚未可知。因此,本研究以黄瓜子多糖为研究对象,对其进行进一步分离、纯化后收集均一多糖,并通过光谱技术对其组成和结构进行鉴定,然后通过体外自由基清除试验考察黄瓜子多糖的体外抗氧化活性,为其进一步开发利用提供试验参考。
1 材料
1.1 主要仪器
ME104型电子分析天平购自梅特勒-托利多仪器(中国)有限公司;JY92-IIN型高速离心机购自湖南湘仪集团有限公司;BS100N型自动部分收集器、HL-2N型恒流泵均购自上海青浦沪西仪器厂;Milli-Q Advantage A10型超纯水机购自德国Merck Millipore公司;iMark型酶标仪购自美国Bio-Rad公司;FDU-2110型冷冻干燥机购自日本EYELA公司;UV-1800型紫外-可见分光光度计购自日本Shimadzu公司;TENSOR37型傅里叶红外光谱仪购自德国Bruker公司;Alliance 2695型高效液相色谱(HPLC)仪、X500R型超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF/MS)仪、2998型蒸发光散射检测器(ELSD)均购自美国Waters公司。
1.2 主要药品与试剂
黄瓜子药材(批号20191215)于2020年购自河北安国中药材市场,经广东药科大学中药学院刘基柱教授鉴定为葫芦科植物黄瓜C.satiuus L.的干燥成熟种子;离子交换纤维素DEAE Cellulose 52(粒径50 μm)购自美国Whatman公司;分子量分别为40 000、2 000、500、70、40、10 kDa的葡聚糖标准品(批号分别为D91501054、D91502032、D91502032、D91502032、D91502032、D91502032,纯度为99.7%)和阴离子交换树脂Amberlite FPA90Cl(粒径580~840 μm)、阳离子交换树脂Amberlite FPC3500H(粒径580~840 μm)、三氟乙酸(TFA)、1-苯基-3-甲基-5-吡唑啉酮(PMP)、1,1-二苯基-2-三硝基苯肼(DPPH)均购自上海麦克林生化科技有限公司;葡萄糖(批号CHB180929)、葡萄糖醛酸(批号CHB180902)、半乳糖醛酸(批号CHB180227)、阿拉伯糖(批号CHB180206)、半乳糖(批号CHB180227)、鼠李糖(批号CHB190217)、木糖(批号CHB180301)、甘露糖(批号CHB180615)等单糖标准品均购自成都克洛玛生物科技有限公司,纯度均不低于98%;维生素C原料药(VC,批号28288902,纯度>99.7%)购自天津市天新精细化工开发中心;过氧化氢购自广东恒健制药有限公司;浓硫酸、苯酚、乙醇、硫酸亚铁、水杨酸、邻苯三酚、铁氰化钾等试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 黄瓜子粗多糖(CCL)的提取
将干燥黄瓜子药材打成粗粉。称取粗粉5 kg,以10倍量(mL/g,下同)的80%乙醇加热回流提取3次、每次3 h,提取液经8层纱布滤过后,合并3次滤液。药渣自然晾干,然后以10倍量水加热回流提取3次、每次2 h,水提液经8层纱布滤过后,合并3次滤液。将2次合并液混合并减压浓缩至一定体积(约1 L),然后加入85%乙醇进行醇沉(边加醇边进行搅拌),使药液中乙醇体积分数约为70%后,静置24 h,抽滤,得到沉淀物,反复按上述方法醇沉3次。将醇沉后的沉淀物用无水乙醇和丙酮交替洗涤3次,真空干燥除去残留的洗涤溶剂,即得CCL,得率为5.06%。
2.2 CCL的分离、纯化
用水将CCL制成0.03 g/mL的多糖溶液,以4 750 r/min离心15 min,取上清液,以Amberlite FPA90Cl阴离子和Amberlite FPC3500H阳离子串联交换树脂柱进行分离:先用水洗脱(流速为10 mL/min,按5 mL/管分管收集),经苯酚-硫酸法[8]检测至无糖组分流出时,改用1 mol/L氯化钠溶液洗脱(流速为10 mL/min,按5 mL/管分管收集),直至洗脫到无糖组分流出为止。将以上得到的两个组分洗脱液浓缩后分别装至截留分子量为3 500 Da的透析袋中,先用流动水透析48 h,再用水浸泡24 h,每隔6 h换水1次(下同);然后,将袋内溶液分别减压浓缩,冷冻干燥,即得到水、1 mol/L氯化钠溶液洗脱组分,分别命名为CCL-S、CCL-M,得率分别为8.00%、13.33%,密封干燥保存。
将CCL-M溶解于水中制成质量浓度为0.03 g/mL的多糖样品溶液,以4 750 r/min离心15 min,收集上清液,以离子交换纤维素DEAE Cellulose 52柱进行纯化:依次用水和0.1、0.2、0.3、0.4、0.5 mol/L氯化钠溶液进行梯度洗脱(流速均为2 mL/min,按5 mL/管分管收集),每隔5管采用苯酚-硫酸法显色[8],并以洗脱管数-紫外光谱吸光度值绘制洗脱曲线,合并出峰位置相同的组分,用截留分子量为3 500 Da的透析袋透析;然后,将透析袋内液减压浓缩,冷冻干燥,分别得到3个多糖组分,分别命名为CCL-M2(水洗脱部位)、CCL-M3(0.4 mol/L 氯化钠溶液洗脱部位)、CCL-M6(0.4 mol/L氯化钠溶液洗脱部位),得率分别为0.40%、0.44%、4.50%,密封干燥保存。黄瓜子多糖组分CCL-M2、CCL-M3、CCL-M6在DEAE-52纤维素柱中的洗脱曲线见图1。
2.3 黄瓜子3种多糖的纯度检测
将CCL-M2、CCL-M3、CCL-M6分别以水溶解,均制成2 mg/mL的供试溶液,采用HPLC-ELSD法分别检测其多糖纯度[9-10]。色谱柱为Shodex sugar KS-805糖柱+KS-G高效凝胶过滤色谱柱,流动相为超纯水,柱温为40 ℃,流速为0.7 mL/min,载气流速1 mL/min,气体压力40 psi,进样量为10 μL。结果发现,CCL-M2、CCL-M3、CCL-M6谱图中均显示为单一对称峰,表明以上3个黄瓜子多糖均为均一多糖。黄瓜子多糖组分CCL-M2、CCL-M3、CCL-M6的HPLC-ELSD色谱图见图2。
2.4 黄瓜子3种均一多糖的分子量测定
采用HPLC-ELSD法进行测定,条件同“2.3”项。取分子量分别为40 000、2 000、500、70、40、10 kDa的葡聚糖标准品适量,分别用水制成质量浓度均为2 mg/mL的溶液,按上述色谱条件进样分析并记录色谱图。以各标准品分子量的lg值(x)为横坐标、保留时间(y)为横坐标绘制标准曲线[11],得到回归方程为y=-0.734 1x+9.625 7(R 2=0.999 0)。分别取黄瓜子3种均一多糖样品适量,用水溶解制成质量浓度均为2 mg/mL的样品溶液,按上述色谱条件进样测定,记录色谱图。将各样品的保留时间分别代入上述回归方程中,计算得CCL-M2、CCL-M3、CCL-M6的分子量分别为9.614×106、2.024×107、3.343×107 Da。
2.5 黄瓜子3种均一多糖的结构分析
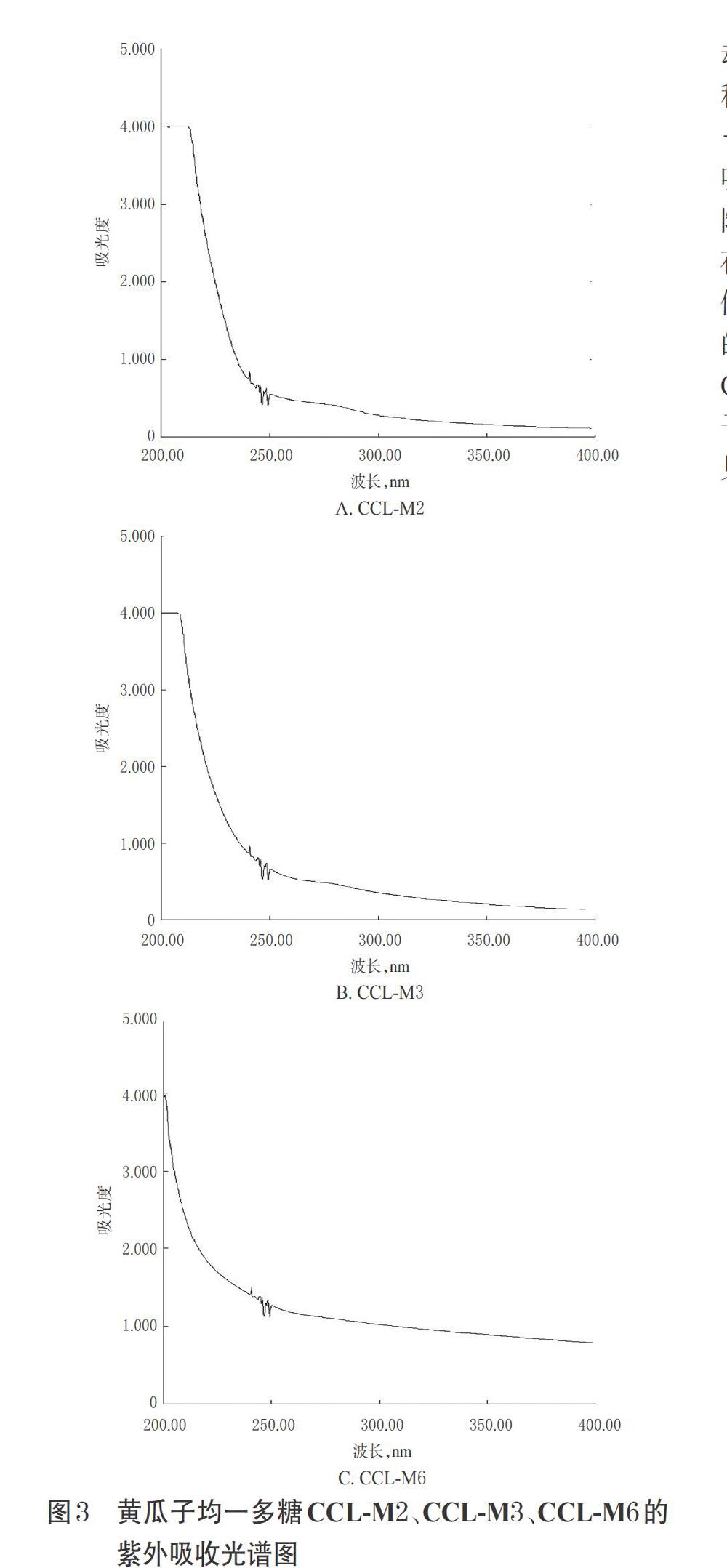
2.5.1 紫外吸收特性分析 称取CCL-M2、CCL-M3、CCL-M6各4 mg,用水制成质量浓度均为2 mg/mL的溶液,使用紫外-可见分光光度计在200~400 nm波长范围内进行扫描,检测其在260、280 nm波长处是否含有核酸和蛋白质缀合物吸收峰[12]。结果显示,CCL-M2、CCL-M3、CCL-M6在260、280 nm波长处均无明显吸收峰,表明经过分离、纯化得到的是3种精制的均一多糖,均不含有核酸和蛋白质。黄瓜子均一多糖CCL-M2、CCL-M3、CCL-M6的紫外吸收光谱图见图3。
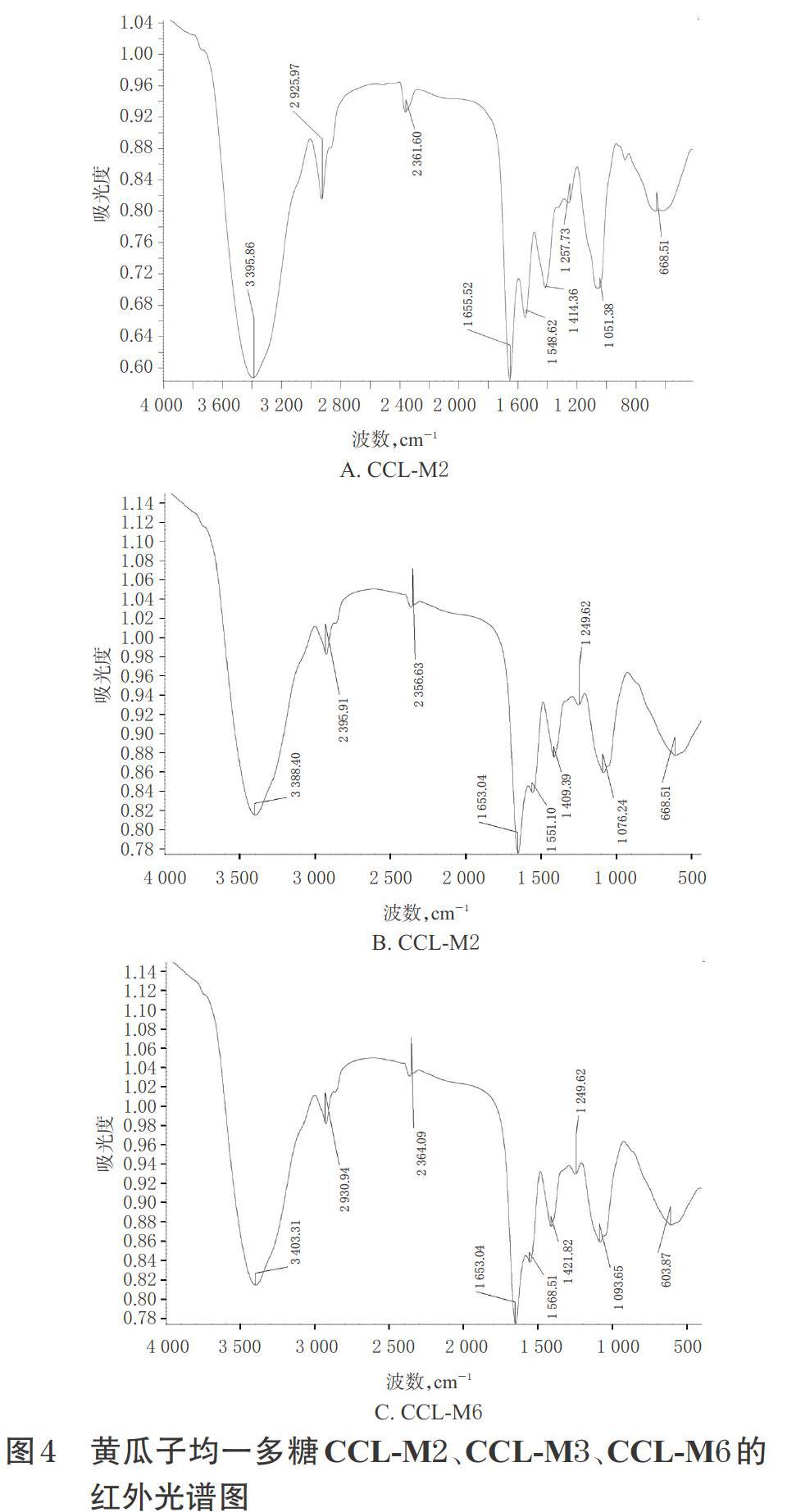
2.5.2 红外吸收特性分析 分别取CCL-M2、CCL-M3、CCL-M6各适量(1~2 mg)和干燥的溴化钾粉末50 mg,在玛瑙研钵中研磨混匀,在压片机上制成透明薄片,然后使用傅里叶红外光谱仪测定4 000~400 cm-1波数范围内的红外光谱图[13]。结果显示,CCL-M2、CCL-M3、CCL-M6有相似的吸收峰。其中,在3 402 cm-1附近寬而强的吸收峰代表有O-H伸缩振动和氢键的存在;在2 925 cm-1附近的弱吸收峰代表有-CH和C-H伸缩振动的存在;在2 364 cm-1附近的吸收峰代表有三键或累积双键的存在;在1 659 cm-1附近的吸收峰代表有 -COOH的非对称伸缩振动的存在;在1 551cm-1处的吸收峰代表有-C-O-伸缩振动的存在;在1 412 cm-1附近的吸收峰代表有-COOH中C-O键的伸缩振动的存在;在1 000~1 200 cm-1附近的吸收峰代表有C-OH侧基和C-O-C糖苷键伸缩振动的存在;610 cm-1附近的吸收峰为吡喃糖的特征吸收峰。以上结果表明,CCL-M2、CCL-M3、CLL-M6均是吡喃糖形式[14]。黄瓜子均一多糖CCL-M2、CCL-M3、CCL-M6的红外光谱图见图4。
2.6 黄瓜子3种均一多糖的单糖组成分析
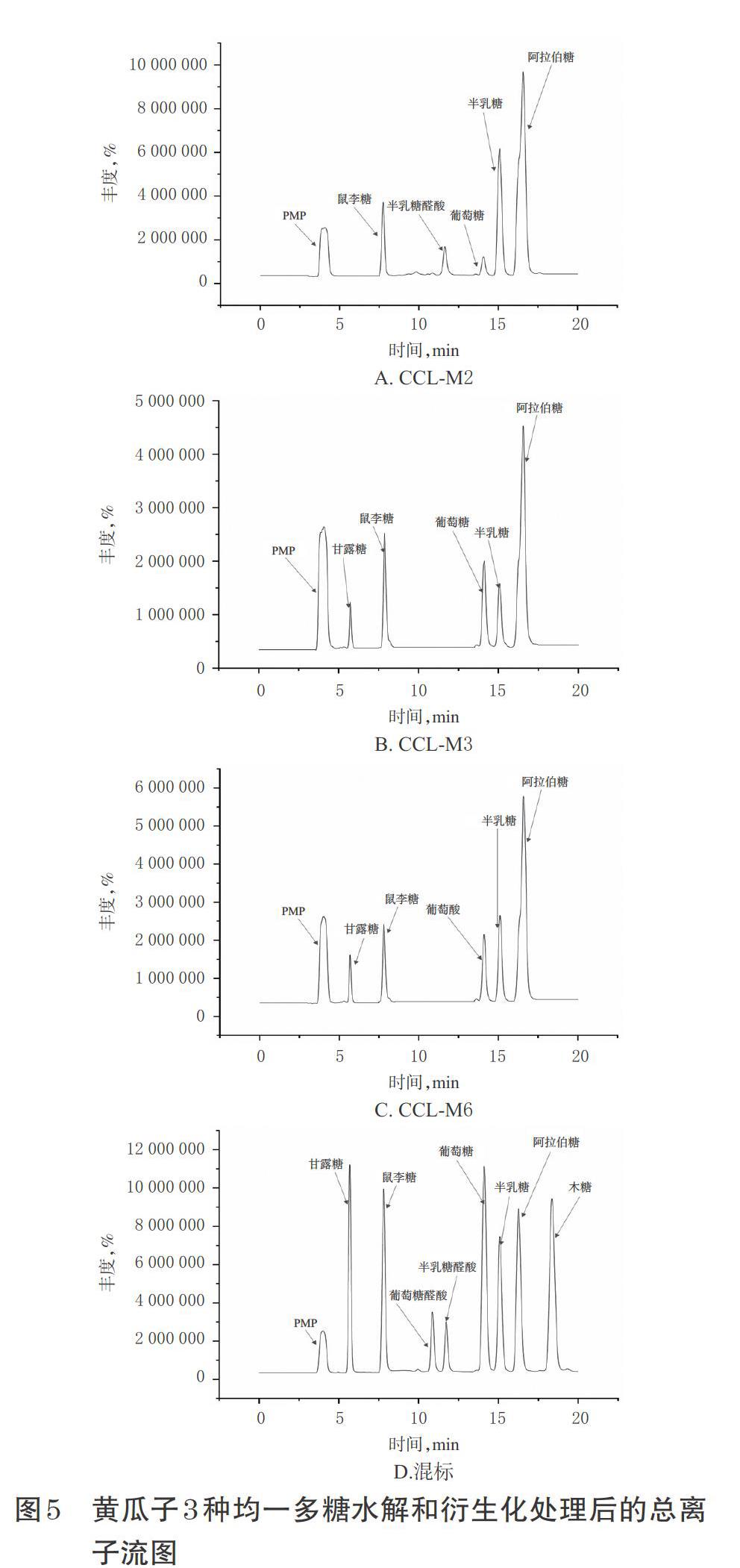
2.6.1 均一多糖的完全酸水解及衍生化处理 分别称取CCL-M2、CCL-M3、CCL-M6各1 mg,置于不同具塞试管中,加入 4 mol/L三氟乙酸溶液0.5 mL溶解,密封,120 ℃油浴2 h后,用氮吹仪吹干。沉淀物加甲醇200 μL进行溶解,再以氮吹仪吹干,反复以上操作2次。最后将沉淀物再次以甲醇200 μL复溶,即得完全酸水解液。在完全酸水解溶液中加入氨水0.5 mL,然后再加入 0.5 mol/mL的PMP甲醇溶液0.5 mL进行衍生化反应,封口,70 ℃水浴30 min。在上述提取液中加入甲醇100 μL,用氮吹仪吹干,重复操作3次。沉淀物再次以甲醇100 μL复溶,即得酸水解和衍生化处理后的样品溶液[15]。
2.6.2 单糖标准品的衍生化处理及混标溶液的制备称取8种单糖(葡萄糖、葡萄糖醛酸、半乳糖醛酸、阿拉伯糖、半乳糖、鼠李糖、木糖、甘露糖)标准品各1 mg,分别置于8支具塞试管中,每管加入0.5 mol/L的PMP甲醇溶液0.5 mL进行衍生化反应,封口,70 ℃水浴30 min。在上述提取液中加入甲醇100 μL,用氮吹仪吹干溶剂,反复以上操作3次,即得PMP衍生化单糖标准品。取上述各衍生化单糖标准品1 mg,分别用甲醇1 mL溶解,作为各单糖标准品母液;分别吸取上述单糖标准品母液各100 μL,置于同一具塞试管中,涡旋混匀,即得各单糖标准品的混标溶液[16]。
2.6.3 UPLC-QTOF/MS分析条件 色谱条件参考文献[17]设置:以CORTECS C18 PFP为色谱柱,以20 mmol/L乙酸铵为流动相A(462 mg乙酸铵溶解于300 mL 0.05%乙酸中配制而成)、乙腈为流动相B进行梯度洗脱(0~16 min,80%A;16~20 min,80%A→50%A;20~25 min,50%A→5%A;25~26 min,5%A→80%A;26~28 min,80%A),柱温为30 ℃,流速为0.4 mL/min,进样量为5 μL。质谱分析的离子源为电喷雾电离源(ESI),在正离子模式下采集m/z 400~600范围内的数据;雾化气(N2)和脱溶气体(N2)的流速分别为50、500 L/h,电离源温度为100 ℃,溶剂温度为300 ℃,毛细管电泳电压为3.0 kV,锥孔电压为30 V;以亮氨酸脑啡肽(m/z 556.277 1,500 ng/mL)进行实时质量校正;Lock Spray频率设定为10 s,使用MassLynx 4.1软件进行所有数据采集和处理。
2.6.4 单糖组成分析 分别取“2.6.1”项下经酸水解和衍生化处理后的3种均一多糖样品溶液以及“2.6.2”项下的混标溶液,按“2.6.3”项下条件进样分析,记录总离子流图(见图5)。通过与混标样品总离子图进行对比分析可知,CCL-M2由鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖组成,其摩尔比为5.1 ∶ 2.6 ∶ 1.7 ∶ 1.4 ∶ 31.6,其中以鼠李糖和阿拉伯糖摩尔含量最高;CCL-M3由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖组成,其摩尔比为1.7 ∶ 3.8 ∶ 6.4 ∶ 3.3 ∶ 1.3,其中以葡萄糖摩尔含量最高;CCL-M6由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖组成,其摩尔比为1.3 ∶ 3.0 ∶ 3.2 ∶ 4.4 ∶ 8.9,其中以半乳糖摩尔含量最高。
2.7 黄瓜子3种均一多糖的体外抗氧化活性研究
2.7.1 清除DPPH·能力的测定 分别称取不同质量的CCL-M2、CCL-M3、CCL-M6和VC(阳性对照)溶于水中,制成质量浓度均为0.4、0.8、1.2、1.6、2.0 mg/mL的系列样品溶液。吸取上述不同质量浓度的样品溶液各50 μL,加入 DPPH溶液50 μL,充分混匀后,在25 ℃下避光反应30 min后,采用酶标仪于517 nm波长处测定其吸光度(A)[18],每个样品平行测定3次,取平均值。按以下公式计算DPPH·清除率[19]:DPPH·清除率(%)=[(1-(Ai-Aj)/A0)]×100%;式中,Ai为样品溶液与DPPH溶液混合后的A值,Aj为样品溶液的A值,A0为DPPH溶液的A值。通过软件Graphphad Prism 7.0计算各样品的半数清除浓度(IC50)。结果显示,在所测质量浓度范围内,各样品对DPPH·均有一定的清除活性,其强弱顺序依次为VC>CCL-M2>CCL-M3>CCL-M6,IC50依次为0.309、1.240、1.489、1.713 mg/mL。
2.7.2 清除羟基自由基(·OH)能力的测定 分别按“2.7.1”项下方法制备CCL-M2、CCL-M3、CCL-M6和VC(阳性对照)不同质量浓度的系列样品溶液。分别吸取各质量浓度的样品溶液5 mL,加入9 mmol/L硫酸亚铁溶液、9 mmol/L水杨酸-乙醇溶液、6 mmol/L过氧化氢溶液各0.5 mL,于37 ℃反应45 min后,采用酶标仪于510 nm波长处测定其A值。每个样品测定3次,取平均值。按公式计算·OH清除率:·OH清除率(%)=(1-(Ai-Aj)/A0)×100%[20]。式中,Ai为加入样品溶液和硫酸亚铁、水杨酸-乙醇、过氧化氢溶液的A值,Aj为不加过氧化氢溶液的A值,A0为不加样品溶液的A值。按照“2.7.1”项下方法计算各样品对·OH的IC50。结果显示,各样品对·OH均有一定的清除活性,其强弱顺序依次为VC>CCL-M2>CCL-M6>CCL-M3,IC50依次为0.968、1.032、1.233、1.356 mg/mL。
2.7.3 清除超氧阴离子自由基(O2-·)能力的测定 分别“2.7.1”项下方法制备CCL-M2、CCL-M3、CCL-M6和VC(阳性对照)不同质量浓度的系列样品溶液。分别吸取各质量浓度的样品溶液5 mL,置于10 mL具塞试管中,均加入 50 mmol/L的Tris-HCl缓冲液(pH 8.2)4.7 mL,在25 ℃下恒温振荡反应20 min后,立即加入事先预热好的邻苯三酚溶液0.3 mL,混匀。采用酶标仪于320 nm波長处测定其A值,每隔30 s测定1次,共测定5 min,算出每分钟A值的增量,然后通过计算每分钟A值的增量与时间的比值得到自氧化速率[21]。每个样品测定3次,取平均值。按公式计算O2-·清除率:O2-·清除率(%)=(1-ΔAi/ΔA0)×100%[21]。式中,ΔAi为加入样品溶液后邻苯三酚的自氧化速率;ΔA0为邻苯三酚的自氧化速率。按照“2.7.1”项下方法计算各样品对O2-·的IC50。结果显示,各样品对O2-·均有一定的清除活性,其强弱顺序依次为VC>CCL-M2>CCL-M3>CCL-M6,IC50依次为0.335、0.379、0.812、1.662 mg/mL。
3 讨论
在本研究中,笔者首次对CCL进行提取,并进一步进行分离、纯化后得到CCL-M2、CCL-M3、CCL-M6等3种均一多糖。结合紫外、红外等多种光谱技术对其结构进行鉴定后,发现3种均一多糖具有相似的化学键和官能团,并呈现出糖类物质的典型吸收峰,且均是吡喃糖。其中,CCL-M2由鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖组成,其摩尔比为5.1 ∶ 2.6 ∶ 1.7 ∶ 1.4 ∶ 31.6,分子量为9.614×106 Da;CCL-M3由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖组成,其摩尔比为1.7 ∶ 3.8 ∶ 6.4 ∶ 3.3 ∶ 1.3,分子量为2.024×107 Da;CCL-M6亦由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖组成,其摩尔比为1.3 ∶ 3.0 ∶ 3.2 ∶ 4.4 ∶ 8.9,分子量为3.343×107 Da。该结果表明,CCL-M3和CCL-M6具有相同的单糖组成,但摩尔比不同;CCL-M2与另外2种多糖的单糖组成不同,这可能是因为CCL-M2是从水洗脱部位中分离出来的多糖,而CCL-C3和CCL-C6是从盐洗脱部位中分离出来的多糖,故组成存在差异。
DPPH·、·OH、O2-·是生物体内主要的活性氧自由基,其引起的脂质过氧化是导致衰老、心血管疾病和肿瘤发生的重要原因之一[22]。本研究通过体外抗氧化试验发现,3种均一多糖对DPPH·、·OH、O2-·均有一定的清除作用,且在相同的质量浓度下,CCL-M2的抗氧化活性要强于其余2个均一多糖,笔者推测这可能是由于该多糖的单糖组成不同于其他两个多糖所造成的。此外,笔者推测这种差异还可能与多糖的糖苷键类型、三螺旋结构等因素有关,故其抗氧化活性的具体机制尚待进一步研究。
综上所述,本研究从黄瓜子中分离得到3种吡喃糖形式的均一多糖均具有一定的体外抗氧化活性,其中以CCL-M2的活性最强。
参考文献
[ 1 ] 祝洪宇,隋莹,宋宁,等.黄瓜子不同炮制品中化学成分的对比[J].中国医药导报,2014,11(20):106-109.
[ 2 ] 裴启洋,佟鑫,贾天柱.黄瓜子不同提取部位对体外培养大鼠成骨细胞的影响[J].中成药,2014,36(4):680-684.
[ 3 ] 吴晓毅.黄瓜子化学成分和瓜蒌含水量、酸值测定研究[D].北京:中国中医科学院,2012.
[ 4 ] 孙英,杨艳平,刘娜,等.米糠多糖的提取方法和生物活性功能的研究进展[J].饲料研究,2020,43(12):147-150.
[ 5 ] 段丽萍,苗丽坤,孙炜炜,等.油茶多糖的提取及生物活性研究进展[J].粮食与油脂,2020,33(11):26-28.
[ 6 ] 周博宇,杨岳峰,张晶莹,等.香菇多糖生物活性及应用研究进展[J].中国卫生工程学,2020,19(5):792-795.
[ 7 ] 肖玉焕,韩丽,李浩然,等.灵芝多糖防治中枢神经系统疾病的研究进展[J].中草药,2020,51(24):6391-6395.
[ 8 ] 温文娟,刘珊,黄远丽.苯酚硫酸法与蒽酮硫酸法测定香菇多糖含量比较[J].现代食品,2020,7(21):177-179.
[ 9 ] 林晓婷,王秋红,匡海学.柱前衍生化HPLC法测定麻黄粗多糖中4种单糖的含量[J].化学工程师,2020,34(11):22-25.
[10] 黄超,万鸣,陈树和,等. HPLC-ELSD法同时测定茯苓水溶性多糖中多种单糖[J].中国药师,2020,23(1):148- 150.
[11] 邓昂,冯凯,滕希峰,等.鬼针草提取物中多糖含量及分子量的测定[J].海峡药学,2019,31(12):60-62.
[12] 周伟娥,周学锋,王宇阳,等.中药多糖成分前处理及检测方法研究进展[J].分析测试学报,2020,39(9):1168- 1175.
[13] 游宇,罗林,陈哲杰,等.生脉饮多糖提取工艺优化及对脾虚模型大鼠肠道功能调节作用的研究[J].中国药房,2019,30(4):493-498.
[14] 曹宇欣,李科,秦雪梅,等.基于部分酸水解寡糖特征圖谱及免疫活性评价的不同产地黄芪的品质比较[J].中草药,2020,51(21):5598-5606.
[15] 杨雯,王嘉,王栋,等.多糖中单糖测定方法的研究进展[J].北方药学,2020,17(8):181-183.
[16] 袁琪,文红梅,张前程,等.苓桂术甘汤中多糖结构组成及其抗氧化活性考察[J].中国实验方剂学杂志,2020,26(16):63-70.
[17] 李子江,刘慰,吴磊,等.偃松松塔多糖的单糖组成分析及活性研究[J].林产化学与工业,2020,40(1):37-44.
[18] 叶明珠,吴嘉彩,游思远,等.蜜炙对黄芪分级醇沉多糖及其抗氧化活性的影响[J].军事医学,2019,43(8):602- 607.
[19] 吴彩霞,刘瑜新,常星,等.头状蓼提取物体外抗氧化活性研究[J].中国药房,2009,20(24):1845-1847.
[20] 刘晓燕,蒋益萍,张嘉宝,等.啤酒花的HPLC指纹图谱建立及其抗氧化作用谱效关系研究[J].中国药房,2020,31(2):138-143.
[21] 谢学明,李熙灿,钟远声,等.龟板体外抗氧化活性的研究[J].中国药房,2006,17(18):1368-1370.
[22] 戴玥,郑佳,郑黎强.抗氧化物质和自由基产物与脑卒中关系的研究进展[J].实用医学杂志,2019,35(3):489- 491.
(收稿日期:2020-11-19 修回日期:2021-01-08)
(编辑:林 静)
