苹果树腐烂病菌小G蛋白VmRab7基因的功能分析
2021-04-08张小龙田润泽徐亮胜黄丽丽
张小龙,吴 淇,田润泽,徐亮胜,黄丽丽
(西北农林科技大学 植物保护学院,旱区作物逆境生物学国家重点实验室,陕西 杨陵 712100)
苹果在我国种植面积广泛,带来了很高的经济效益。据统计,2018年我国苹果产量高达3 920万t。在生产总量如此高的情况下,我国苹果单位面积产量却远低于世界平均水平[1]。果树病害是不容忽视的主要原因之一。苹果树腐烂病是苹果生产中的一种破坏性病害,病原真菌(Valsamali)侵入枝干引起病斑,危害果实品质和产量,严重导致果树死亡[2],生物源杀菌剂是有效的防治办法[3]。研究表明,苹果树腐烂病菌的主要致病因子包括毒素、效应蛋白、细胞壁降解酶等[4-8],但仍有许多致病因素并未揭示。全面探究苹果树腐烂病菌的不同致病因子,有利于苹果生产中的病害预防和控制。
小G蛋白是只有单个结构域的G蛋白(GTP-binding proteins),其分子量约在20~30 ku,作为分子开关调节多个细胞生理过程,包括信号传导、囊泡转运、细胞的形状、运动性和极性等[9]。小G蛋白根据功能可分为8个亚家族:Arf、Ran、Rab、Rho、Ras、Sar1、线粒体Rho和线粒体Roc蛋白[10]。Rab蛋白作为小G蛋白成员调控着囊泡转运过程。囊泡出芽包裹货物分子,通过扩散或通过马达蛋白介导的方式沿着细胞骨架转运至靶细胞器,与其质膜相互识别,并锚定到受体膜上,最终完成膜融合过程[11]。Rab蛋白和系连因子一起决定了囊泡的靶向特异性。Rab蛋白被特定的鸟苷酸交换因子(GEF)激活,由与GDP结合的失活构象转变为与GTP结合的激活构象,只有激活构象才能与下游的效应因子相互作用。随后,激活态Rab蛋白在GAPs作用下水解GTP,释放1个Pi基团而失活。然后与GDP解离抑制因子(GDI)结合,维持失活态,游离于细胞质中,以循环利用[12]。激活构象的Rab7蛋白招募HOPS复合物,通过结合其2个亚基Vps39和Vps41,参与酵母液泡的同型融合以及囊泡与液泡融合过程。HOPS复合体能够识别每个SNARE,并组装三元反式复合物,以便与第4个Qa-SNARE快速融合,驱动膜融合过程[13]。最初提出其亚基Vps39是Rab7的鸟苷酸交换因子(GEF)[14]。后来得到更正,Mon1-Ccz1复合物对Rab7具有GEF活性[15]。Rab5、Mon1-Ccz1、Rab7形成的分子级联机制,使得以Rab5为标志的早期内涵体,以GEF Mon1-Ccz1复合物为媒介,成熟到以Rab7为标志的晚期内涵体,保证了囊泡转运及降解过程的正常周转。细胞自噬是一类降解途径,通过自噬体包裹受损细胞器和错误蛋白质等,转运至液泡或溶酶体中进行降解,释放氨基酸等组分用于应激条件下胞内正常稳态的维持[16]。细胞自噬过程与囊泡转运具有相似性,并且共用许多组分。Rab5和Rab7还控制着不同的自噬步骤,Rab5参与自噬体的闭合过程,Rab7作用于自噬体与液泡的融合过程[17]。在稻瘟病菌中,MoRab7主要定位于液泡膜,其缺失突变体表现出菌丝体生长速率和分生孢子量降低,分生孢子畸形并且附着胞发育缺陷[18]。FgRab7与FgAtg9互作来调控FgAtg9的动态运输,这对于细胞自噬过程和禾谷镰刀菌的致病性至关重要[19]。
本研究从苹果树腐烂病菌的全基因组中鉴定到一个与酿酒酵母(S.cerevisiae)ScYpt7同源的基因VmRAB7。VmRab7基因的功能在苹果树腐烂病菌中尚不清楚。为明确VmRab7在苹果树腐烂病菌的菌丝生长发育和致病过程中的作用,利用同源重组的方法进行基因敲除,观察敲除突变体的菌落形态、产孢情况及致病力的变化;为明确VmRab7在液泡融合和细胞自噬中的作用,利用透射电镜观察敲除突变体的液泡形态和自噬体的形成。研究结果为解析小G蛋白在苹果树腐烂病菌的致病过程及生长发育中的功能打下基础。
1 材料与方法
1.1 试验材料和试剂
1.1.1 试验材料V.mali强毒力菌株03-8,由西北农林科技大学果树病害病原生物学及综合防治科研团队鉴定保存。1年生枝条和叶片(苹果富士品种)采摘自陕西省杨凌区苹果园。PFL2和PDL2质粒载体由西北农林科技大学许金荣教授惠赠。
1.1.2 主要试剂 DNA片段回收试剂盒(OMEGA);真菌基因组DNA提取试剂盒(BioFlux);高保真酶、一步克隆酶(南京诺唯赞);裂解酶、崩溃酶(Sigma);氨苄青霉素、卡那霉素、遗传霉素、潮霉素(上海生工);试验所用引物由上海生工合成(表1)。
1.2 试验方法
1.2.1 基因敲除与回补 利用同源重组方法,将VmRAB7基因置换为G418抗性基因。设计引物1F/2R和3F/4R,用于扩增VmRAB7基因ORF的上游区域和下游区域约1.2 kb片段。引物G418-F/R从PFL2质粒上扩增G418抗性基因。利用Double-Joint的方法将上述3个片段融合[20],并用CF/CR大量扩增,浓缩PCR产物,得到VmRAB7基因敲除盒。在PEG/CaCl2作用下将10 μg的敲除盒转入03-8原生质体[21],遗传霉素筛选,得到的转化子利用4对引物进行PCR检测。利用回补引物C-F/R扩增靶标基因及包含起始密码子前约1.5 kb片段,克隆至PDL2载体,测序正确得到回补载体。将敲除突变体菌株制备成原生质体,将回补载体导入突变体的原生质体中,潮霉素筛选转化子。提取DNA,5F/6R检测靶标基因的回补。

表1 试验所用引物Table 1 Primers in the study
1.2.2 生长速率测定 将03-8菌株、ΔVmrab7及回补菌株在PDA平板上活化培养2 d,用直径5 mm打孔器从菌落边缘即活性最高区域处获得菌丝块,转接到厚度均为12.5 mm的PDA平板,25℃培养2 d后,分别测量菌落横向和纵向直径,计算菌丝培养两天的生长速率。
1.2.3 致病力测定 取当天采摘苹果富士品种的1年生枝条及叶片为试验材料,将枝条处理成粗细均匀的小段,反复冲洗,浸泡在0.6%次氯酸钠溶液中消毒,灭菌蒸馏水洗去残留,枝条两端用蜡封口。叶片采用同种方法消毒,叶柄处包裹浸润的无菌棉球。相同条件下活化03-8菌株、ΔVmrab7及回补菌株,从菌落边缘打孔获得菌饼,接种到处理好的枝条和叶片上,菌丝面紧贴植物组织面。喷洒无菌蒸馏水并用保鲜膜覆盖,25℃恒温培养3 d后,测量病斑的直径,每个处理3次重复。
1.2.4 透射电镜样品制备 活化03-8菌株和ΔVmrab7菌株,在无菌操作台中用接种针轻轻刮取菌落边缘菌丝,转接入液体YEPD中25℃培养18~24 h,待菌丝球呈绿豆大小时,转移到含有2 mmol·L-1PMSF的MM-N液体培养基中,氮饥饿8 h诱导自噬发生。8 h后过滤除去培养基,无菌ddH2O冲洗若干次,每个菌株挑取3个菌丝球,轻轻在牛血清中蘸取,晾干。制样切片,透射电镜观察。
2 结果与分析
2.1 VmRAB7的基因敲除与回补
将酿酒酵母的ScYpt7氨基酸序列在苹果树腐烂病全基因组数据库中进行同源比对,鉴定到1个同源蛋白,蛋白一致性约66%,命名为VmRab7(VM1G_11105)。为明确其基因功能,对VmRAB7进行基因敲除。转化子利用四对引物进行PCR检测。5F/6R不能扩增靶标基因条带,其余3对引物G850/G852、7F/G855R和G856F/8R能扩增出正确条带,证明VmRAB7基因敲除成功。并利用引物5F/6R检测VmRAB7的回补(图1)。
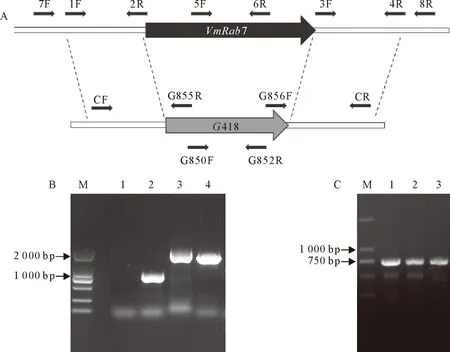
注:A.VmRAB7基因敲除示意图;B.基因敲除的PCR检测,M.DNA marker,1.靶标基因,2.G418抗性基因,3.上游区域,4.下游区域;C.回补菌株的PCR检测,M.DNA marker,1~3.3个回复菌株。
2.2 VmRab7调控苹果树腐烂病菌的营养生长和产孢过程
为了明确VmRab7在苹果树腐烂病菌丝的生长发育中的作用,对突变体进行生长速率的测定。结果显示,ΔVmrab7菌株相比野生型而言,菌丝生长速率显著降低。VmRAB7的敲除使菌丝生长速率降低了约40%。培养30 d后,野生型菌株和回补菌株已产生分生孢子,而ΔVmrab7菌株呈红褐色,并丧失了产孢能力(图2)。表明VmRab7参与了苹果树腐烂病菌的营养生长和产孢过程。

注:A.培养2 d和30 d后的菌落形态;B.生长速率测定;C.产孢量测定;WT:野生型菌株,ΔVmrab7:敲除突变体菌株,ΔVmrab7-C:回补菌株;***:P<0.001。
2.3 VmRab7影响苹果树腐烂病菌的致病力
为了明确VmRab7对苹果树腐烂病菌丝的致病力的影响,进行离体叶片枝条接种测量病斑长度。结果显示,与野生型相比,Vmrab7敲除突变体的致病力显著降低。VmRAB7基因的敲除使菌丝致病力在枝条上降低了约50%,在叶片上降低了约53%(图3)。表明VmRab7影响苹果树腐烂病菌的致病力。
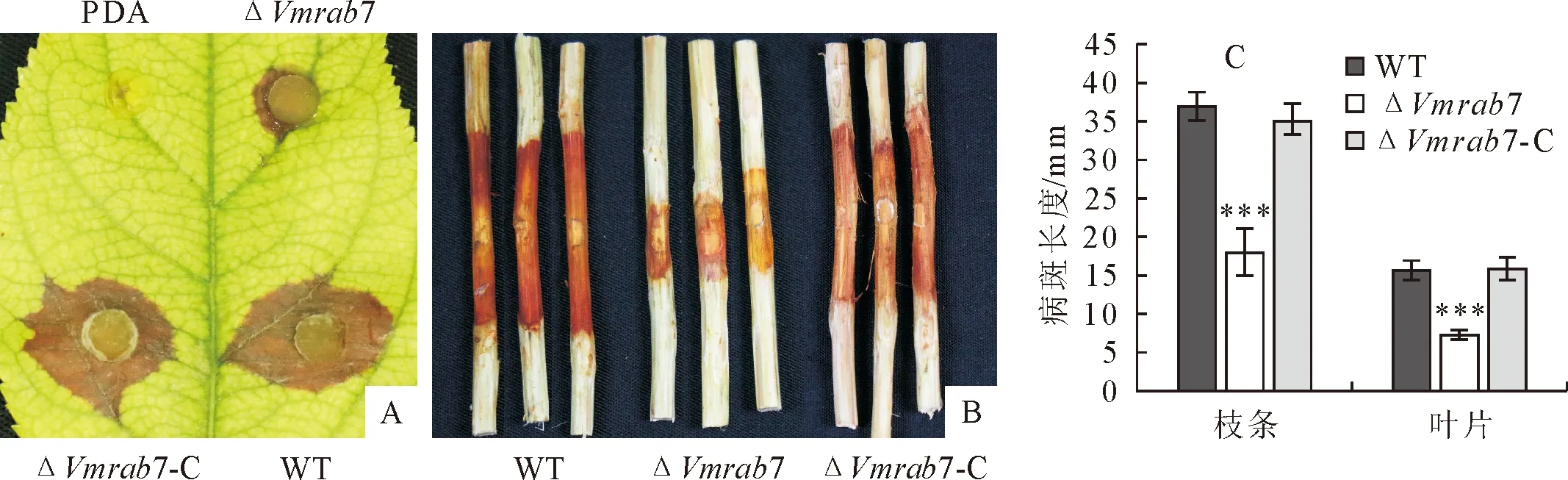
注:A.叶片接种的发病情况;B.枝条接种的发病情况;C.病斑长度的测定。***:P<0.001。
2.4 VmRab7影响液泡形态和细胞自噬
为了明确VmRab7在苹果树腐烂病菌的液泡融合和细胞自噬中的功能,将WT菌株、突变体ΔVmrab7接种在含有2 mM PMSF的MM-N液体培养基中,氮饥饿诱导自噬发生。样品处理后在透射电镜下观察。在液泡形态方面,WT菌株含有圆而饱满的大液泡,而ΔVmrab7菌株具有小且多的碎片化液泡;诱导自噬发生后,WT菌株的液泡中存在若干个球状的自噬体,而ΔVmrab7的液泡中未能观察到这种结构(图4)。结果表明,VmRab7参与苹果树腐烂病菌的液泡形态建成和细胞自噬过程。
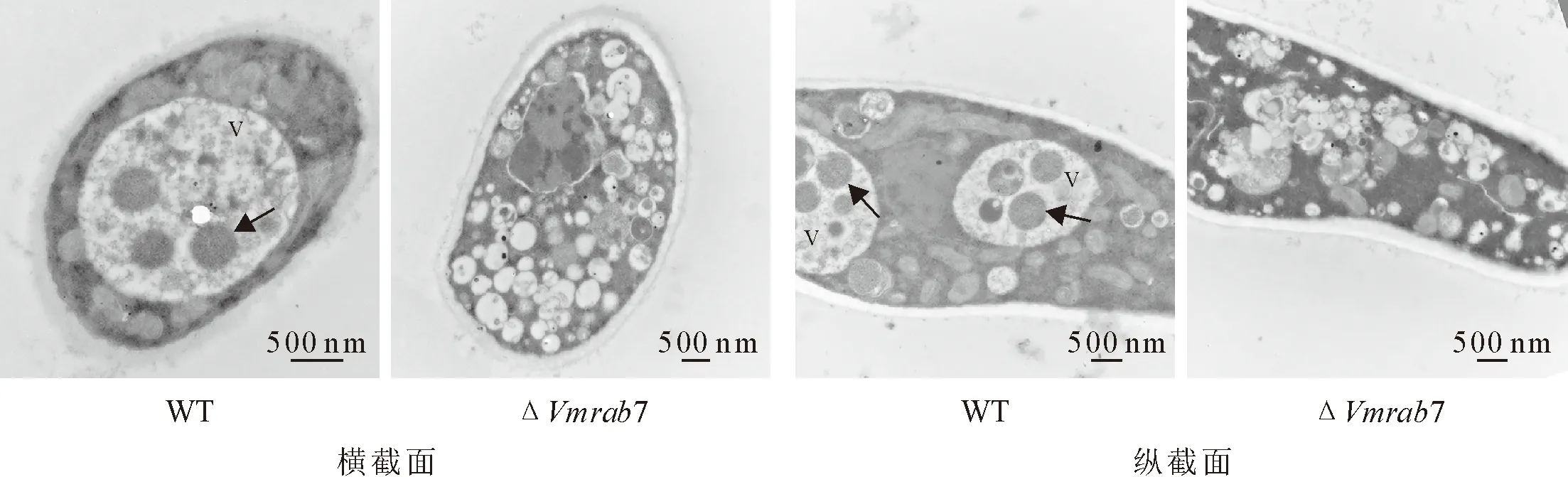
注:V指代大液泡;箭头指向自噬体。
3 结论与讨论
本研究对苹果树腐烂病菌中的小G蛋白VmRab7进行了功能研究,结果表明VmRab7调控着苹果树腐烂病菌的营养生长、产孢、致病力、液泡形态和细胞自噬过程。相比野生型,ΔVmrab7敲除突变体在PDA培养基上的生长速率降低了约40%。培养30 d后,突变体菌株呈现红褐色,并丧失了产孢能力。表明VmRab7影响苹果树腐烂病菌的营养生长和产孢。VmRAB7基因的敲除使菌丝致病力在枝条上降低了约50%,在叶片上降低了约53%。表明VmRab7影响苹果树腐烂病菌的致病力。
细胞自噬的标志是自噬体结构的产生,是判断自噬发生或受阻的明显特征。在透射电镜下,ΔVmrab7菌株的液泡中未能观察到球状的自噬体结构,表明VmRAB7的缺失中断了细胞自噬过程。此外,ΔVmrab7菌株不存在饱满的大液泡,其液泡呈现碎片化的形态。表明VmRab7作用于液泡的同型融合。自噬体与液泡的融合也属于生物膜的融合过程,与液泡的同型融合相似,它们之间共用许多组分,包括Rab7及其GEF Mon1-Ccz1、HOPS复合物、SNARE蛋白(Vam3、Vam7、Vti1和Ykt6)。这些基因的缺失都表现出在液泡形态和细胞自噬方面的双重缺陷[22]。
Mon1-Ccz1复合体是Rab7的鸟苷酸交换因子(GEF)[15]。在秀丽隐杆线虫(C.elegans)中,Mon1和Ccz1的共表达才与Rab7相互作用,单个Mon1或Ccz1都不能与Rab7互作[23]。但在禾谷镰刀菌(F.graminearum)中,没有FgCcz1的协助,单个FgMon1与激活态和失活态FgRab7均存在相互作用[24]。VmRab7是被Mon1激活还是被Mon1-Ccz1复合体激活是需要验证的问题。最近有研究发现,Rab7的鸟苷酸交换因子Ccz1蛋白的C末端存在2个LIR基序,Mon1-Ccz1复合体通过这2个基序与Atg8直接结合,从而促进Rab7的激活来调控自噬体与液泡的融合[25]。但目前植物病原真菌中的Ccz1蛋白还未见报道,鉴定苹果树腐烂病菌中的相关基因,将为全面解析Rab5、Mon1-Ccz1、Rab7分子级联机制在囊泡转运及细胞自噬两种途径中的作用提供基础。自噬过程调控稻瘟病菌的附着胞发育和膨压形成。自噬缺陷的病菌形成的侵染结构不能穿透植物表皮,造成了真菌致病力的减弱,这种机制是自噬影响该真菌致病性的主要原因之一[26]。细胞自噬影响苹果树腐烂病菌致病性的分子机理及其独特性是需要进一步研究的内容。
