基于网络药理学探究参附注射液治疗心肌顿抑的作用机制*
2021-04-08邓海霞吴瑞华
贾 思 邓海霞 吴瑞华 陀 鹏
(1.广西中医药大学,广西 南宁 530022;2.广西中医药大学第一附属医院,广西 南宁530022)
心肌顿抑是心肌经历短暂的缺血后心脏功能延迟恢复的一种可逆性损伤,表现为心肌收缩能力的减弱,心脏排血量降低、射血分数减少等[1],可发生在心脏骤停心肺复苏后、心脏移植、应激性心肌病、心脏介入术后、心绞痛等缺血性心肌疾病中[2]。虽然发生心肌顿抑的心肌细胞并未发生坏死,但是可能会引起缺血后左室功能障碍、血流动力学不稳定等现象,甚至会导致心力衰竭、肺水肿、猝死等严重并发症,从而增加病死率[3]。因此如何有效防治心肌顿抑,已经成为临床上亟待解决的问题。心肌顿抑属于中医“胸痹”“心悸”等范畴,基本治法为袪邪治标、活血化瘀、辛温通阳、泻浊豁痰、温阳补气、益气养阴、滋阴益肾等。中医药具有多成分、多途径、多靶点的特性,在防治心血管疾病中有独特优势。
参附注射液组分为人参和附子,具有回阳救逆、稳固营卫之功效,主要有效成分有人参皂苷和乌头类生物碱,可强心、利尿、扩张冠状动脉血管,同时还能减少心肌耗氧量并降低心脏负荷,主要用于休克、心律失常、心力衰竭等属阳气暴脱证者[4-5]。目前对于参附注射液的研究局限于单一的通路机制,对其系统的作用机制研究尚不全面。本研究采用网络药理学方法,从分子层面系统地分析参附注射液有效成分的作用靶点、生物过程、信号通路等在心肌顿抑中的作用机制。以期为深入研究参附注射液治疗心肌顿抑的基础实验研究及临床合理应用奠定基础并提供新思路。
1 材料与方法
1.1 参附注射液有效化合物的收集与筛选 参附注射液由人参和附子提取而成。利用中药系统药理学数据库和分析平台TCMSP(http://lsp.nwu.edu.cn/tcmsp.php),以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18为筛选条件,收集这两个药物的有效化合物。
1.2 参附注射液有效化合物的靶点预测 将收集到的参附注射液有效化合物以Mol2格式上传到Pharm⁃mapper服务器中,选择药效团模型,将返回靶点数设置为300,得到参附注射液化合物的有效靶点。并将预测出的靶点导入Uniprot数据库获得标准基因名。
1.3 化合物-靶点网络构建 选取人参和附子化合物成分前10个靶点,将化合物及相应靶点信息上传到Cytoscape软件中构建网络图并进行可视化分析,以“节点”代表成分和靶点,“边”代表成分与靶点之间的相互作用,获得化合物-靶点网络。
1.4 心肌顿抑相关靶点的预测 利用在线文本挖掘服务器 GeneCards(https://www.genecards.org/)、人类孟德尔遗传OMIM 数据库(http://www.omim.org/)和CTD(http://ctdbase.org/)数据库筛选出与心肌顿抑相关的靶点,以“stunned myocardium”为关键词进行检索,收集并整合与心肌顿抑相关的靶点。
1.5 参附注射液对心肌顿抑的作用靶点预测 将参附注射液化合物靶点和心肌顿抑相关靶点导入Venny在线分析软件中,得到参附注射液对心肌顿抑的26个潜在治疗靶点。将这26个靶点上传到SRTING(http://string-db.org)数据库中,选择物种为“Homo sa⁃piens”,设置靶点之间相互作用值为0.4,得到蛋白互作网络图,并保存为TSV格式。将所得的TSV格式的文件导入Cytoscape软件进行可视化分析获得蛋白互作网络图。
1.6 网络合并 通过Cytoscape软件中的Merge功能,对参附注射液化合物-靶点网络与参附注射液对心肌顿抑的作用靶点进行合并,构建药物-成分-靶点-疾病全局性网络。
1.7 参附注射液对心肌顿抑作用靶点的富集分析和KEGG通路注释分析 将“1.5”所得到的交集靶点导入DAVID(https://david.ncifcrf.gov/)数据库中,进行GO分析和KEGG分析,在分析结果中收集生物过程(BP)、分子功能(MF)、细胞成分(CC)和The Kyoto En-cyclope⁃dia of Genes and Genomes(KEGG)通路富集分析并保存。利用微生信在线网站(http://www.bioinformatics.com.cn/)将KEGG通路绘制成气泡图。
2 结果
2.1 参附注射液有效化合物的收集 在TCMSP数据库中以OB≥30%、DL≥0.18为条件,收集到符合条件的43个化合物,其中人参22个,附子21个。化合物包括豆甾醇(stigmasterol)、山柰酚(kaempferol)、β-谷固醇(beta-sitosterol)、人参皂苷Rh2(ginsenoside rh2)等,各化合物的具体信息见表1。
2.2 参附注射液化学成分靶点预测及相互作用 在PharmMapper服务器中预测表1筛选出的43个参附注射液有效化合物,取结果中每个化学成分的前10个蛋白,随后上传到Uiprot数据库,获得统一基因名。再将这些蛋白上传到SRTING在线软件中,对重复蛋白和非人源蛋白进行剔除,最后获得74个靶点。将结果中的靶点蛋白导入到Cytoscape软件中,构建“靶点蛋白相互作用”网络图(图1)和“化合物-成分靶点”网络图(图2)。
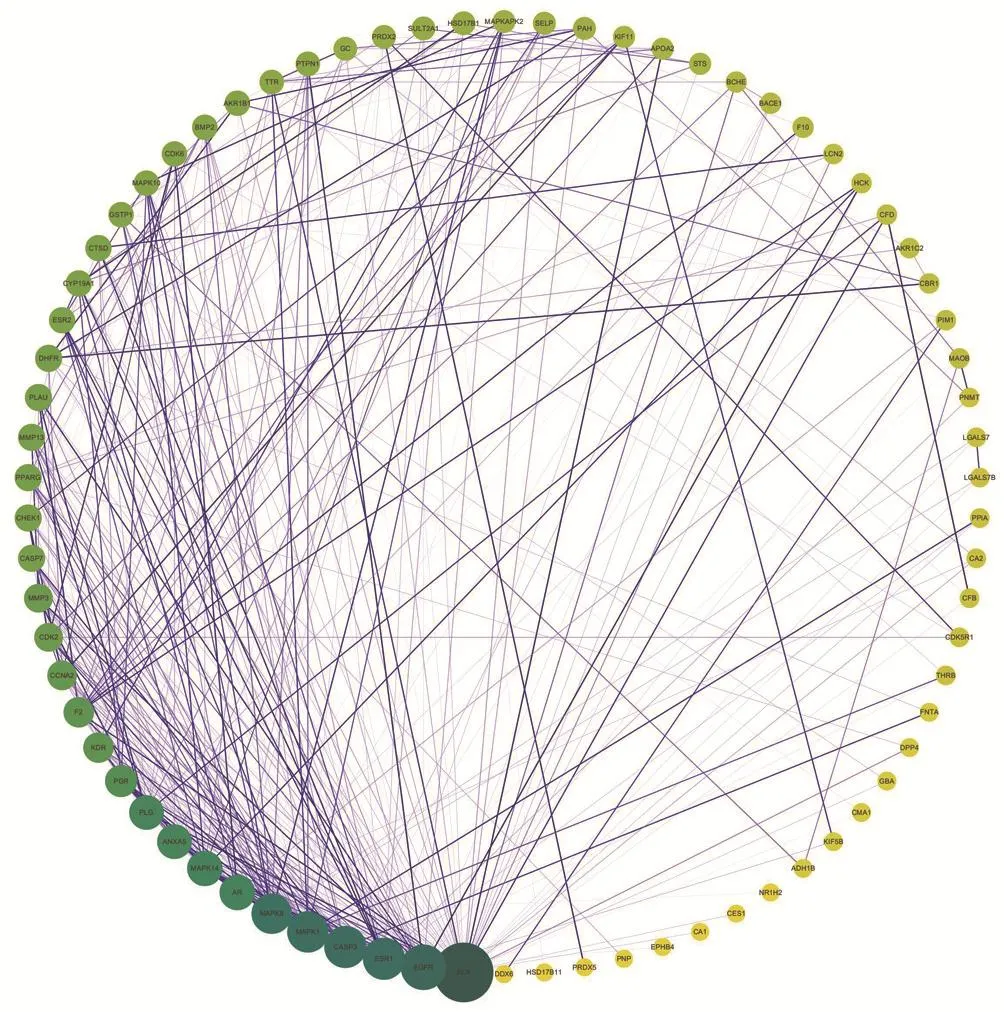
图1 参附注射液化学成分靶点蛋白相互作用网络图

图2 参附注射液化合物成分-作用靶点网络图

表1 参附注射液化合物成分
2.3 参附注射液对心肌顿抑作用靶点 通过Gene⁃Cards、OMIM和CTD数据库,以“stunned myocardium”为检索词,共整合到1 826个疾病靶点。将参附注射液化合物靶点和心肌顿抑作用机制相关靶点上传到Ven⁃ny在线分析软件中,分析得出26个交集靶点,见图3。

图3 参附注射液化学成分靶点与心肌顿抑相关疾病靶点Venny图
2.4 参附注射液对心肌顿抑作用靶点的蛋白互作网络构建 将“2.3”所获得的26个交集靶点上传到STRING在线软件中,获得PPI网络并保存TSV格式文件。在Cytoscape软件中导入TSV文件,获得蛋白互作网络,见图4。参附注射液对心肌顿抑作用的潜在靶点PPI网络有23个节点(去除3个无相互作用的靶点),包括半胱氨酸天冬氨酸蛋白酶3(CASP3)、表皮生长因子受体(EGFR)、丝裂原活化蛋白激酶1(MAPK1)、丝裂原活化蛋白激酶8(MAPK8)、雌激素受体1(ESR1)、丝裂原活化蛋白激酶14(MAPK14)、半胱氨酸天冬氨酸蛋白酶7(CASP7)、谷胱甘肽硫转移酶P1(GSTP1)等。

图4 参附注射液对心肌顿抑作用靶点的蛋白互作图
2.5 参附注射液对心肌顿抑靶点的全局性网络分析 利用Cytoscape软件中的Merge功能将参附注射液化合物-靶点网络和参附注射液对心肌顿抑作用靶点PPI网络合成全局性蛋白互作网络图。见图5。
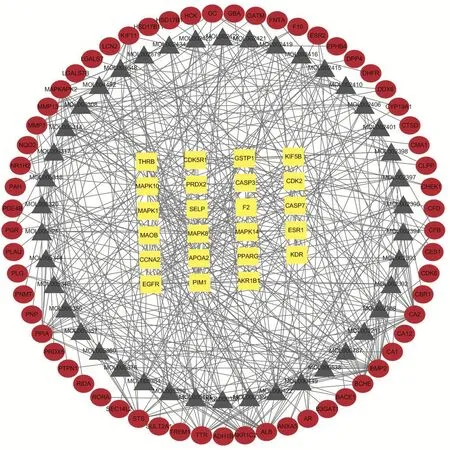
图5 参附注射液与心肌顿抑靶点全局性网络
2.6 参附注射液对心肌顿抑作用靶点的GO分析和KEGG富集分析 在DAVID数据库中进行GO分析,以P<0.05为条件进行筛选,获得55个生物学过程(BP),包括:序列特异性DNA结合转录因子活性的调控、凋亡过程负调控、应激反应、细胞对脂多糖的反应、成纤维细胞增殖的正调控等;15个细胞组成(CC),包括:核质、胞质、细胞核、线粒体、外泌体等;20个分子功能(MF),包括:丝裂原活化蛋白激酶活性、酶结合、蛋白结合、ATP结合、蛋白激酶活性等。GO分析见图6(图中BP和MF按P值选择前15个)。在KEGG通路富集分析结果中,筛选出P<0.05以及与心肌顿抑直接或间接相关的通路共12条,包括TNF信号通路(TNF sig⁃naling pathway)、Foxo信号通路(FoxO signaling path⁃way)、NOD样受体信号通路(NOD-like receptor signal⁃ing pathway)、MAPK 信号通路(MAPK signaling path⁃way)、Toll样受体信号通路(Toll-like receptor signaling pathway)等,具体KEGG通路富集分析气泡图见图7。

图6 参附注射液对心肌顿抑作用靶点的BP、CC、MF分析
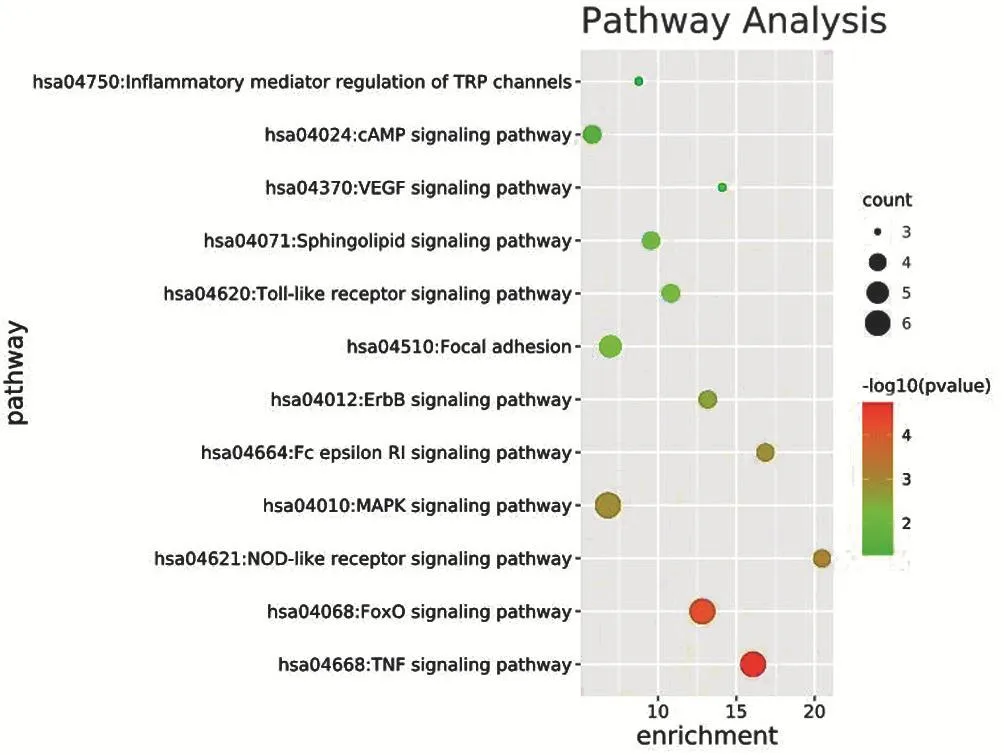
图7 参附注射液对心肌顿抑作用的KEGG气泡图
3 讨论
心肌顿抑是短暂、可逆的心肌缺血所引发的心肌功能障碍,常见于心肌梗死、心绞痛、心脏骤停心肺复苏后、心脏移植等缺血性损伤中[6]。心肌顿抑的发生可能会导致严重的并发症,如心力衰竭、恶性心律失常、猝死等,增加患者的死亡率。然而在临床上,尚未出现确切的心肌顿抑治疗指南,没有加速恢复心肌功能障碍的治疗方法[7]。大量研究证实中医药在防治心血管疾病方面具有独特的优势[8],它可以从多靶点、多成分、多通路系统地对心肌顿抑的发生发展进行干预。参附注射液是防治心血管疾病的常用中成药,在临床研究及实验研究中均证实其具有显著疗效[9]。
本研究通过TCMSP数据库筛选出43个有效化合物,包括山柰酚(kaempferol)、β-谷甾醇(beta-sitosterol)、人参皂苷Rh2(ginsenoside rh2)等。有研究表明[10-12],这些成分对损伤的心肌细胞具有修复作用。这些化合物都与心肌顿抑的机制相关,由此我们推测参附注射液可通过这些化合物共同作用于心肌顿抑,发挥保护性作用。
本研究中获得26个参附注射液对心肌顿抑的潜在治疗靶点,去除掉3个无交互作用的靶点,最终得到23个潜在靶点,故我们推测参附注射液可能通过这23个靶点对心肌顿抑发挥作用,分析发现这些靶点共同参与多种生物过程,如EGFR、CASP3、MAPK8和GSTP共同参与凋亡过程的负调控,EGFR、MAPK1、MAPK8共同参与应激反应,MAPK14、MAPK8和GSTP1共同参与细胞对脂多糖的反应。CASP3是参与细胞凋亡的重要组成部分,对机体的凋亡过程有着重要的调节作用;EGFR是上皮生长因子细胞增殖和信号转导的受体,与细胞的增殖、分化、血管生成、细胞凋亡的抑制等过程相关[13];丝裂原活化蛋白激酶MAPK1、MAPK8和MAPK14是信号从细胞表面传导到细胞核内的重要介质,调节细胞的生长、分化、炎症反应等多种重要的细胞病理生理过程[14]。这些生物学过程与心肌顿抑的发生机制都存在相互关系,因此我们推测参附注射液可能通过共同诱导这些基因的表达对心肌发挥保护性作用。
在KEGG分析中,筛选得到12条信号通路,其中与心肌顿抑密切相关的通路有Toll样受体信号通路(TLRs)、Foxo信号通路、NOD样受体信号通路(NOD-like receptor signaling pathway)。TLRs是介导人体内先天免疫和炎症反应的关键信号通路[15]。TLRs可通过激活丝裂原活化蛋白激酶和核因子κB(NF-κB)信号级联途径,促进下游炎性因子的表达,如白细胞介素-1(IL-1)、白细胞介素-6(IL-6)和肿瘤坏死因子(TNF)-α等,从而引起心肌细胞的损伤[16]。Han等[17]研究发现TLR4-NF-κB通路活化后可使心肌梗死大鼠心肌中的炎症标志物显著增加。而在使用药物对TLR4-NF-κB通路进行抑制后,发现大鼠体内心肌坏死标志物及炎症因子均明显降低,心功能得到改善[18]。
张弛等的实验研究证实,参附注射液可以通过抑制TLR4/NF-κB信号通路来抑制脂多糖介导的黏附分子表达,进而减轻机体的炎症反应[19]。Foxo蛋白参与多种生物学过程,包括抗氧化应激反应、抗凋亡等,可减少心肌诱导的氧化应激和细胞凋亡,通过增加抗氧化剂的产生和细胞存活对缺血的心肌发挥保护作用[20]。Fox家族包含17个亚族,其中Foxo1和Foxo3主要在心脏组织中表达[21]。Sengupta A等[22]在实验研究中指出,心肌细胞中Foxo1和Foxo3共同缺失会导致抗氧化剂和DNA修复酶减少,从而加重心肌的损伤。NOD样受体信号通路(NLRs)广泛存在于人体细胞质中,其在机体固有免疫和炎症反应中发挥关键作用[23]。NLPs通过激活NF-κB和丝裂原活化蛋白激酶信号转导途径抑制炎性因子的激活。Li H等[24]研究证实NRLs主要通过抑制心肌缺血引起的炎症反应和细胞凋亡,在心脏中起保护作用。因此我们推测,参附注射液有效活性成分可能是通过调控各大代谢通路,共同发挥保护心肌顿抑中心肌细胞的作用。
综上所述,本研究从网络药理学层面初步预测了参附注射液治疗心肌顿抑的有效活性成分、潜在作用靶点、关键信号通路等复杂的机制,为参附注射液的药理作用提供了理论基础和新的思路。然而,本研究仍存在一定的局限性,单从网络药理学层面预测了参附注射液对心肌顿抑的作用机制,还需通过临床及实验方面的研究进一步证实。因此本研究后期还需要大量的实验研究加以佐证。
