湿法磷酸选择性除杂制工业级磷酸二氢铵
2021-04-08王智娟
王智娟
(曲靖师范学院化学与环境科学学院,云南曲靖655000)
磷酸二氢铵按其纯度高低可分为农用级(NH4H2PO4质量分数≥82.7%)、工业级和食品级等,根据HG/T 4133—2010《工业磷酸二氢铵》标准规定,工业级磷酸二氢铵Ⅰ、Ⅱ、Ⅲ类产品的NH4H2PO4质量分数分别≥98.5%、≥98.0%、≥96.0%。 食品级磷酸二氢铵除要求NH4H2PO4质量分数≥96%外,对氟化物、砷和铅等重金属含量亦有严格要求。高纯度磷酸二氢铵除用作水溶肥、阻燃剂、饲料添加剂和食品添加剂外[1-2],近年来在制备磷酸盐光学玻璃[3]、锂电池正极材料[4-5]和非线性光学器件[6-7]等方面的研究逐渐增多,因其在农业、消防、食品和材料等领域有广阔的应用及市场前景,其需求量不断增大。磷酸二氢铵制备方法有热法磷酸和萃取法净化磷酸[8]路线。前者工艺简单、产品质量高,但受资源、能源和环境制约。 萃取法净化磷酸路线先以溶剂萃取法制得精制磷酸,再通氨中和,经多效浓缩、冷却结晶得到磷酸二氢铵[8],此法工艺长,萃取精制环节设备、技术投资大,成本高。 廖晓婷等[9]提出了磷酸脲母液溶剂萃取制磷酸二氢铵的工艺路线,产品纯度达到99.45%、P2O5回收率达到85.34%, 但过程涉及多次萃取,流程复杂、萃取剂用量大。 故研究者更关注湿法磷酸直接制工业级磷酸二氢铵,此路线采用氨化方式将铁、铝、镁、氟等杂质以磷酸复盐形式沉淀析出[10],pH 越高,杂质去除率越高,但磷损失越大,产品P2O5收率仅为25%~40%[11-12],严重制约了该路线的经济效益。
目前,湿法磷酸直接制工业级磷酸二氢铵技术的研究集中于调控氨化pH。湿法磷酸一步(或两步)通氨中和至磷酸二氢铵中和度的路线虽简单, 但产品含杂质较多,纯度常低于95.7%[13-14];一步(或分步)通氨中和至pH>5,再以高纯磷酸等将料液一步或分步中和至pH=4.5 的路线,磷酸二氢铵纯度大于97.3%,但需多次调节pH 和固液分离,工艺复杂[15-16]。 磷酸二氢铵料液中加入络合剂(如柠檬酸、柠檬酸钠、EDTA 和EDTA 二钠等)可络合液相中残存金属离子,抑制其结晶析出,从而可提高磷酸二氢铵纯度[17-18]。 此外,也有文献报道用氢氟酸[19-20]净化湿法磷酸,使镁、铝等杂质形成不含磷沉淀除去,如(NH4)x(Mg)y(Al)zF6(OH)6·2H2O、NaMgAlF6·xH2O、MgAl2F8、MgAlF5等,该法可减少P2O5损失,但需预加Al(NO3)3、Na2CO3等调整Al3+、Mg2+、Na+比例。 为进一步改善湿法磷酸直接制工业级磷酸二氢铵的路线,降低过程磷损失,简化流程,本文考察了采用氟化钠选择性除杂再氨化中和制磷酸二氢铵工艺的可行性,在探讨过程规律基础上,初步建立了优化工艺。
1 实验方法
1.1 实验原料
采用国内某磷化工企业提供的湿法磷酸为原料,组成见表1。
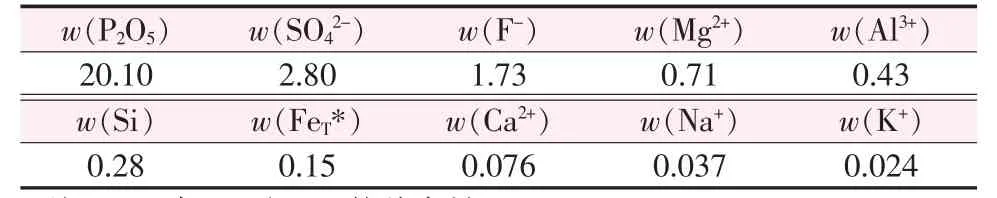
表1 湿法磷酸化学组成 %Table1 Chemicalcompositionofwet-processphosphoricacid
1.2 实验方法
预除杂:称取一定量湿法磷酸于烧杯中,置于恒温磁力搅拌(250 r/min)水浴锅,升温至60 ℃后按化学计量比加入Ca(OH)2和Na2CO3以脱除SO42-和SiF62-。 反应2.0 h 后过滤分离。 选择性除杂:称取一定量预净化磷酸于烧杯中,置于恒温磁力搅拌(250 r/min)水浴锅,升温至50 ℃后加入NaF,反应1.0 h 后过滤分离。 固相用超纯水洗涤后烘干待测(80 ℃)。磷酸二氢铵制备:称取300 g 预除杂湿法磷酸,加入适量NaF,控制氟化钠与磷酸质量比(mNaF/mH3PO4)为2.5%,在50 ℃下反应1.0 h 后,过滤滤液通氨至pH=4.5~4.6,80 ℃反应1.0 h 后过滤,滤液经浓缩、结晶制得磷酸二氢铵。
1.3 分析检测
采用喹钼柠酮重量法测定P2O5含量;氟离子选择电极法测定F-含量;采用蒸馏后滴定法测定总氮含量; 利用电感耦合等离子体光谱仪(ICP,Spectro Arcos)测定金属离子(Fe、Al、Mg、Ca、Na 和K)浓度;利用X 射线粉末衍射仪(XRD,D8 advanced)分析沉淀物组成;利用扫描电子显微镜(SEM,JSM 7401F)观察沉淀物形貌。
2 结果与讨论
2.1 氟化钠对沉淀物组成的影响
图1 为mNaF/mH3PO4为1.2%~6.0%时,反应1.0 h 后形成的沉淀物的XRD 谱图。沉淀物主要由氟化复盐[NaMgAl (F,OH)6·H2O、NH4MgAlF6、KMgAlF6和NaMgAlF6]组成。 以上4 种氟化复盐出峰位置极接近, 但2θ 在29~31°的两个特征峰的相对强度有差异。mNaF/mH3PO4<3.5%时,沉淀物以NaMgAl(F,OH)6·H2O、XMgAlF6(X=K+或NH4+)为主;mNaF/mH3PO4>3.5%时,沉淀物中NaMgAlF6衍射峰逐渐增强。mNaF/mH3PO4为6.0%时,沉淀物中出现钙的硅铝酸盐物相。
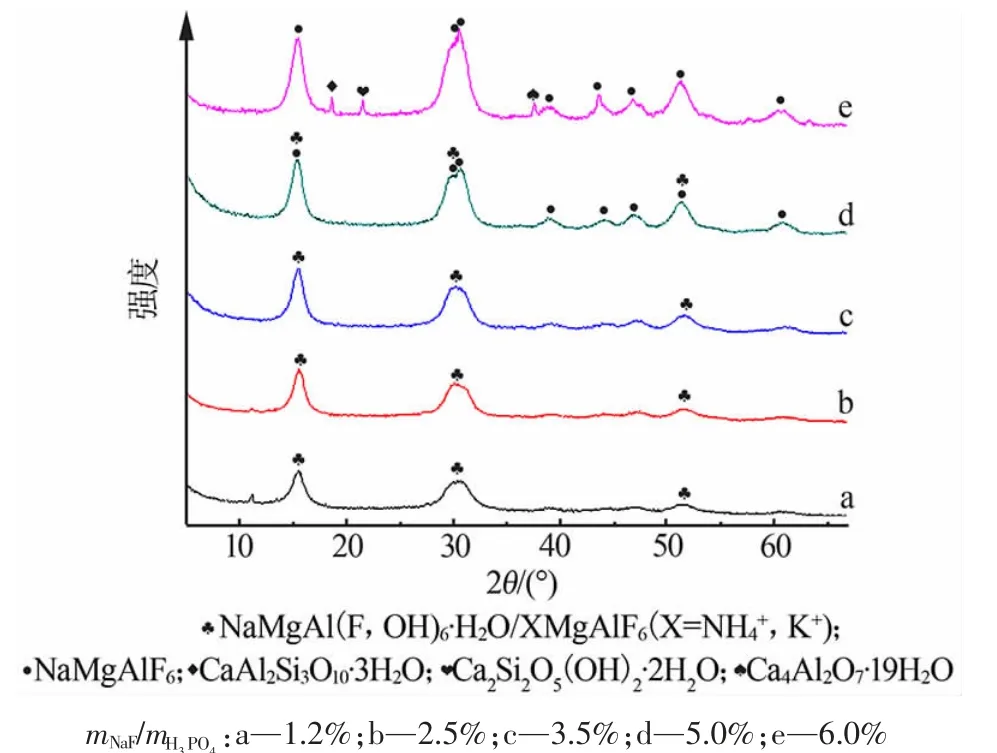
图1 氟化钠对沉淀物XRD 谱图的影响Fig.1 Influence of NaF on XRD patterns of precipitates
2.2 氟化钠对沉淀物形貌的影响
图2 为氟化钠对沉淀物形貌的影响。mNaF/mH3PO4为1.2%时,沉淀物呈细砂砾状,mNaF/mH3PO4为2.5%时,沉淀物粒径更细小,但有较明显的松散团聚体,过滤时间分别为1 min 和3 min;氟化钠添加量越多,形成的难过滤胶状物越多,当mNaF/mH3PO4增大到6.0%时,沉淀物极其细小细密,过滤时间延长至21 min。

图2 沉淀物SEM 图Fig.2 SEM of precipitates
2.3 氟化钠对杂质脱除的影响
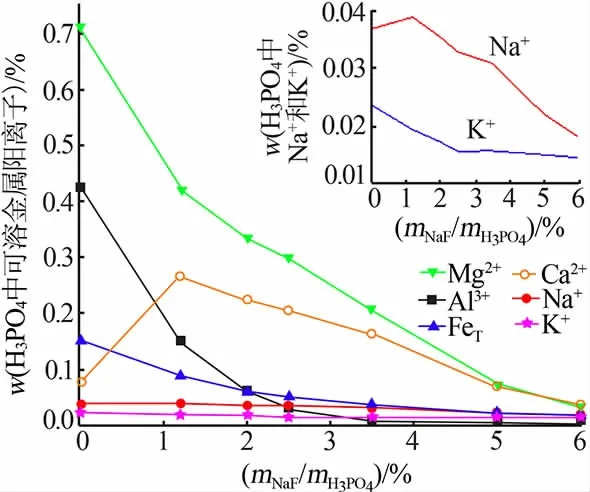
氟化钠对杂质脱除的影响见图3。 氟化钠用量增大,磷酸中金属阳离子含量总体呈下降趋势,杂质脱除率提高。mNaF/mH3PO4为6.0%时,镁、铝、铁、钾和钠质量分数分别下降至0.029%、0.002 7%、0.012%、0.014%和0.018%。镁、铝、钾和钠析出主要是由于形成NaMgAl(F,OH)6·H2O、XMgAlF6(X=Na+、K+或NH4+)沉淀,铁的脱除可能是共沉淀作用[20]。 湿法磷酸中SiF62-在碱性条件下易生成硅凝胶(反应1),影响料浆黏度,使料浆难以过滤,故以Na2CO3进行预脱除(反应2);为消除SO42-对磷酸二氢铵结晶的影响,加入Ca(OH)2将其预脱除(反应3)。mNaF/mH3PO4在0~1.2%范围时, 添加NaF 对Na+、Ca2+浓度降低的影响还不足以抵消外引Na2CO3和Ca(OH)2带来的影响,这是图3 中Na+和Ca2+浓度稍有上升的原因。随氟化钠用量增大,NaMgAl(F,OH)6·H2O、钙的硅铝酸盐等沉淀逐渐增多,Na+和Ca2+含量持续下降,Ca2+质量分数逐渐降至0.037%(mNaF/mH3PO4为6%)。

2.4 氟化钠对磷酸中残余F-含量的影响
氟化钠对磷酸中残余F-含量的影响如图4 所示。mNaF/mH3PO4由1.2%增至2.5%时,磷酸中F-含量变化不大;mNaF/mH3PO4由2.5%增至5%时,磷酸中F-含量迅速由0.148%增至0.331%。 综合考虑杂质脱除、残留氟和过滤性能,mNaF/mH3PO4为2.5%时较合适。
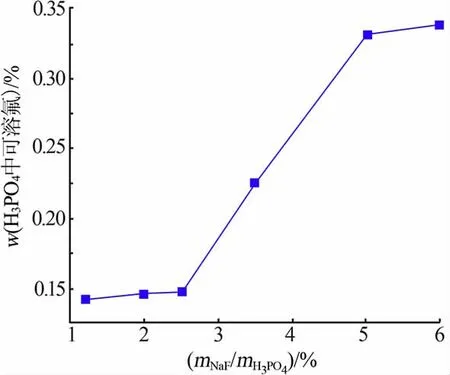
图4 氟化钠对磷酸中残余F 含量的影响Fig.4 Effect of NaF on residual fluoride content in phosphoric acid
2.5 磷酸二氢铵的制备
图5 为制得的磷酸二氢铵形貌及XRD 谱图,其他结果见表2。 由图5 可看出,制得的磷酸二氢铵呈四棱短柱状,但颗粒大小不均匀,其XRD 特征峰位置与标准谱图基本一致, 磷酸二氢铵平均纯度达到98.53%,收率为86.2%,含氟质量分数为0.23%。
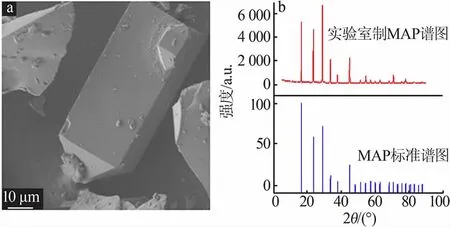
图5 磷酸二氢铵SEM(a)及XRD 谱图(b)Fig.5 SEM(a)and XRD pattern(b)of ammonium dihydrogen phosphate

表2 磷酸二氢铵产品质量 %Table2 Productqualityofammoniumdihydrogenphosphate
3 结论
本文通过对湿法磷酸进行选择性除杂,使液相中杂质金属离子以NaMgAl(F,OH)6·H2O、XMgAlF6(X=Na+、K+或NH4+) 和钙的硅铝酸盐等非含磷沉淀析出,由此可降低氨化过程P2O5损失。 mNaF/mH3PO4为2.5%时,磷酸二氢铵纯度达到98.53%、收率为86.2%、氟残留量较低(0.23%),满足工业级磷酸二氢铵Ⅱ类指标。
