双歧杆菌四联活菌治疗小儿急性淋巴细胞白血病的研究
2021-04-08王朝荣管玉洁宋丽丽毛彦娜刘炜
王朝荣 管玉洁 宋丽丽 毛彦娜 刘炜#
(1 河南省儿童医院 郑州450046;2 河南省郑州儿童医院 郑州450046;3 郑州大学附属儿童医院血液肿瘤科 河南郑州450046)
儿童急性淋巴细胞白血病(Acute Lymphoblastic Leukemia, ALL) 是儿童最常见的恶性肿瘤之一,疾病控制不佳可能并发感染,还易出现胃肠功能紊乱,降低患儿对化疗的耐受性[1]。 双歧杆菌四联活菌作为一种微生态制剂,能补充肠道正常菌群,纠正胃肠道菌群紊乱,但尚不清楚是否对化疗效果产生影响[2]。因此,本研究旨在探讨在ALL 化疗患儿中联用双歧杆菌四联活菌,对改善患儿胃肠功能以及提高细胞免疫功能方面的效果作出评估。 现报道如下:
1 资料与方法
1.1 一般资料 选取2018 年5 月~2019 年6 月我
院收治的小儿急性淋巴细胞白血病84 例,随机分为对照组和研究组,各42 例。 对照组男23 例,女19例;年龄3~10 岁,平均(7.21±2.03)岁;急性B 淋巴细胞白血病(B-ALL)12 例,急性T 细胞型淋巴母细胞白血病(T-ALL)2 例;低危ALL 20 例,中危ALL 18 例,高危ALL 4 例。 观察组男22 例,女20 例;年龄4~11 岁, 平均(7.34±2.03) 岁;B-ALL 9 例,T-ALL 3 例;低危ALL 21 例,中危ALL 16 例,高危ALL 5 例。两组患儿一般资料均衡可比(P>0.05)。纳入标准: 符合ALL 诊断标准并伴有胃肠功能紊乱[3];年龄1~12 岁;研究前未服用微生态制剂;无胃肠道基础性疾病。 排除标准:临床资料不全;合并有心、肝、肾等器官重大疾病;患儿依从性极差,不愿意配合。
1.2 治疗方法 对照组患儿给予中国儿童白血病协作组-2008(CCLG-ALL2008)方案[4]进行分级并化疗, 患儿缓解期应用大剂量甲氨蝶呤片(MTX)(国药准字H31020644) 口服, 低危患儿剂量2.0 g/m2,中危患儿3.0 g/m2;地塞米松磷酸钠注射液(国药准字H41021924)静脉滴注,0.2 mg/kg。 观察组在对照组治疗基础上口服双歧杆菌四联活菌(思连康)(国药准字S20060010),1~6 岁患儿,2 片/ 次,2~3次/d;6~12 岁患儿2~3 片/次,3 次/d。 治疗4 周。
1.3 化疗疗效判定标准 参照《实体瘤治疗疗效评价标准》[5], 完全缓解(CR): 病灶消失; 部分缓解(PR):病灶较治疗前体积缩小30%以上;疾病稳定(SD):病灶无明显变化;疾病进展(PD):病灶体积较治疗前增大20%以上。 客观缓解率=(CR 例数+PR 例数)/总例数×100%。
1.4 观察指标 (1)比较两组化疗效果。(2)比较两组严重毒副反应, 参照不良事件通用术语标准(CTCAE)中感染、发热、骨髓抑制、腹泻等化疗后毒副反应分级标准[6]。 根据化疗后各项毒副反应严重程度分为Ⅰ~Ⅳ级。Ⅲ级、Ⅳ级为严重毒副反应。(3)比较两组治疗前后胃肠功能, 在治疗前和治疗后分别取空腹静脉血3 ml,4℃,3 000 r/min 条件下离心后分离上层血清, 使用放射免疫分析法得出血浆胃动素(MTL)、血清胃泌素(GAS)。(4)比较两组治疗前后免疫功能指标,分别在治疗前后空腹抽取6 ml静脉血后加入EDTA 抗凝,室温下静置20 min 后加入2 ml 红细胞裂解液混均匀, 置于离心机(速度3 000 r/min)中分离血清,用PBS 洗涤2 次后上机检测。 采用荧光直接标记发测定CD3+、CD4+、CD8+细胞水平,采用流式细胞仪测定自然杀伤细胞(NK)水平。
1.5 统计学方法 本研究采用SPSS19.0 统计学软件分析处理,计量资料以(±s)表示,采用t检验,计数资料用率表示,采用χ2检验,等级计数资料采用秩和检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组化疗效果比较 治疗4 周后,两组客观缓解率比较,差异无统计学意义(P>0.05)。 见表1。
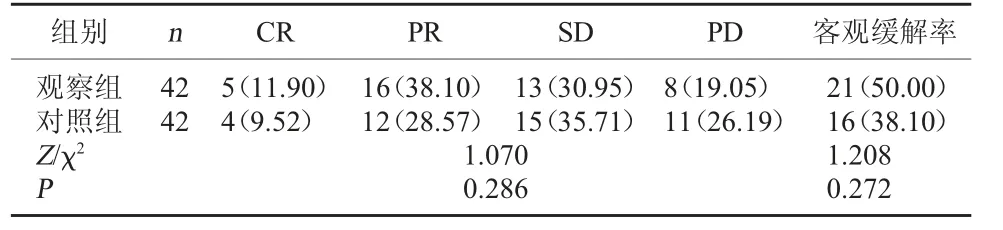
表1 两组化疗效果比较[例(%)]
2.2 两组胃肠功能指标比较 治疗4 周后,两组血清GAS、血浆MTL 水平较治疗前升高,且观察组高于对照组(P<0.05)。 见表2。
表2 两组胃肠功能指标比较(±s)
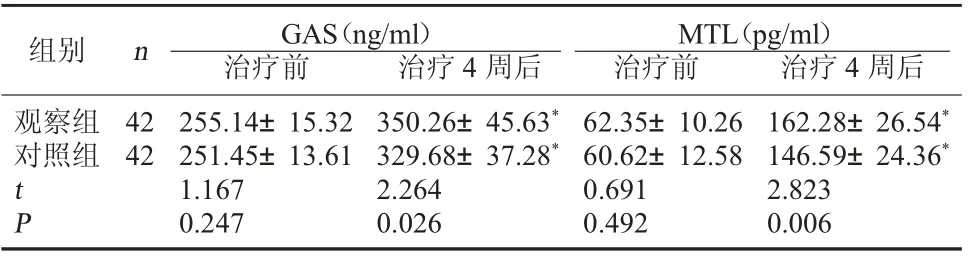
表2 两组胃肠功能指标比较(±s)
注:与同组治疗前比较,*P<0.05。
MTL(pg/ml)治疗前 治疗4 周后观察组对照组组别 n GAS(ng/ml)治疗前 治疗4 周后42 42 t P 255.14±15.32 251.45±13.61 1.167 0.247 350.26±45.63*329.68±37.28*2.264 0.026 62.35±10.26 60.62±12.58 0.691 0.492 162.28±26.54*146.59±24.36*2.823 0.006
2.3 两组免疫功能指标比较 治疗4 周后, 两组CD3+、CD4+、NK 水平较治疗前升高, 且观察组高于对照组;两组CD8+水平较治疗前降低,且观察组低于对照组(P<0.05)。 见表3。
表3 两组免疫功能指标比较(%,±s)

表3 两组免疫功能指标比较(%,±s)
注:与同组治疗前相比,*P<0.05。
组别 n 时间 CD3+ CD4+ CD8+ NK观察组t P 42治疗前治疗4 周后对照组42治疗前治疗4 周后t P t 治疗后组间比较P 治疗后组间比较53.16±9.68 60.34±9.98*3.347 0.001 49.76±11.24 55.32±12.08*2.184 0.032 2.076 0.041 30.49±5.67 46.71±5.43*13.390<0.001 29.87±6.07 32.55±5.41*2.136 0.036 11.972<0.001 32.16±4.73 29.18±4.23*3.015 0.034 34.21±4.23 32.06±4.43*2.275 0.026 3.016 0.003 9.26±2.49 11.24±3.72*2.867 0.005 8.97±3.14 10.85±3.68*0.161 0.873 2.960 0.004
2.4 两组严重毒副反应比较 治疗4 周后,观察组发生4 例骨髓抑制、1 例感染、1 例发热;对照组发生5 例骨髓抑制、5 例感染、4 例发热。观察组严重毒副反应率发生率为14.29%(6/42), 低于对照组的33.33%(14/42), 差异有统计学意义(χ2=4.200,P=0.040)。
3 讨论
ALL 发病率较高,患儿通常病情重、并发症多,严重影响其生命安全。 目前常规化疗可提高患儿生存率,但同时会对胃肠黏膜造成损害,倘若不采取及时有效措施易引发肠源性感染,因此化疗过程中有效调节胃肠道功能紊乱尤为关键[7]。
常规化疗药物易损伤患儿消化道上皮细胞,诱发机体产生炎症反应,导致肠道通透性发生改变、使肠道菌群失衡,肠黏膜屏障功能受损,进而导致免疫功能下降。 本研究结果显示, 治疗4 周后, 两组CD3+、CD4+、NK 水平较治疗前升高, 且观察组高于对照组;两组CD8+水平较治疗前降低,且观察组低于对照组(P<0.05),提示化疗联合思连康能激活人体非特异性免疫功能、提高机体免疫力、进一步提高机体细胞免疫活性,从而降低感染风险。 究其原因是思连康能够促进益生菌在宿主肠道内生长繁殖,同时提高巨噬细胞活性,保护T 细胞功能从而提高机体免疫力。
思连康可增强肠黏膜乳糖酶活性, 阻断毒素与肠黏膜受体结合, 加快肠蠕动, 提高胃肠道功能水平, 有效避免肠道产生内源性感染后对炎症介质的刺激,加重感染风险,形成恶性循环[8]。 本研究结果显示,治疗后两组血清GAS、血浆MTL 水平均较治疗前升高,且观察组高于对照组,表明思连康在保护胃肠道黏膜的同时能够有效加快胃泌素分泌, 调整化疗药物对患儿胃肠道造成的紊乱状态。 思连康富含与人体肠道内一致的菌种, 服用能加快患儿肠道菌群恢复,促进饮食消化吸收,有效预防患儿化疗后肠道粘连、腹胀腹痛以及消化不良等症状。
放疗后的毒副反应影响着化疗效果以及患儿正常生活。 化疗药物易损伤肠黏膜同时破坏黏膜通透性,同时产生的严重毒副反应易引发内源性感染。本研究结果显示, 观察组严重毒副反应率发生率为14.29%(6/42),低于对照组的33.33%(14/42),差异有统计学意义, 提示联合运用思连康较单独使用化疗方案在减轻化疗后患儿胃肠道毒副的反应方面作用更为显著,可有效降低继发性感染及发热风险。究其原因是辅助口服思连康, 降低化疗药物对患儿胃肠道损伤,修复胃肠黏膜,从而抵抗胃肠道相关毒副反应,提高化疗效果。综上所述,在ALL 化疗致胃肠功能紊乱患儿中应用思连康治疗, 有利于调节患儿胃肠道紊乱状态、减少胃肠道严重毒副反应、增强机体免疫力的同时确保化疗效果,效果显著。
