MTHFR 与ABCB1 基因多态性对血液系统恶性肿瘤患者大剂量甲氨蝶呤排泄延迟和肝肾毒性的影响*
2021-04-08吕冬梅
马 乐 ,韩 佳 ,吕冬梅 △
(1. 徐州医科大学,江苏 徐州 221009; 2. 徐州医科大学附属医院药学部,江苏 徐州 221002)
甲氨蝶呤(MTX)属叶酸拮抗剂,大剂量甲氨蝶呤(HD-MTX)能显著提高肿瘤患者的长期生存率[1-2],目前广泛用于多种血液系统恶性肿瘤[如急性淋巴细胞白血病(ALL)和骨肉瘤]的治疗。患者行 HD-MTX 治疗后常会出现MTX 排泄延迟现象,并引发肝肾功能损伤等毒副反应,且个体差异较大。亚甲基四氢叶酸还原酶(MTHFR)和三磷酸腺苷(ATP)结合盒B 亚家族成员1转运蛋白(ABCB1)的基因多态性与MTX 排泄延迟及肝肾毒性可能相关,但已有研究的结果不一致[3-5]。本研究中选取徐州医科大学附属医院收治的使用HD-MTX化学治疗(简称化疗)的血液系统恶性肿瘤成年患者131 例,通过监测用药后48 h 体内MTX 的血药浓度及用药前后的肝肾功能,研究MTHFR C677T(rs1801133)和 ABCB1 C3435T(rs1045642)2 个位点基因多态性对MTX 排泄延迟及肝肾毒性的影响,为HD-MTX 个体化用药提供更多依据。现报道如下。
1 资料与方法
1.1 研究对象
收集徐州医科大学附属医院2019 年4 月至2020 年5 月收治的131 例血液系统恶性肿瘤成年患者的基本信息、给药剂量、合并用药情况等。其中男67 例,女64 例;平均年龄(54.31 ±14.01)岁。纳入标准:入院后确诊为 ALL、中枢神经系统淋巴瘤、非霍奇金淋巴瘤等血液系统恶性肿瘤;采用大剂量(>500 mg/m2)甲氨蝶呤注射液(辉瑞制药有限公司,进口药品注册证号H20140205,规格为每支10 mL ∶1 g)治疗,且化疗过程中未出现严重过敏反应;用药过程中及用药后24 h 内未使用非甾体类抗炎药、复方磺胺甲唑及质子泵抑制剂等影响MTX 血药浓度的药物;使用HD-MTX 前12 h 及用药后给予充分水化及碱化尿液;化疗前查血常规、肝肾功能等实验室指标均正常。
1.2 方法
1.2.1 血药浓度测定
采集患者给予MTX 后48 h 时的外周静脉血,加入乙二胺四乙酸(EDTA)抗凝管,离心,取上清液,使用Viva-E 型快速血药浓度监测仪(德国Siemens 公司)测定血药浓度并记录,以超过 1 μmol/L 为排泄延迟[6-7]。
1.2.2 基因型检测
使用核酸提取及纯化试剂(上海百傲科技有限公司)提取DNA,置-20 ℃冰箱内贮存。使用聚合酶链反应(PCR)扩增试剂盒(上海生工生物工程有限公司),配制50 μL 扩增体系,置 PCR 仪(美国 ABI 公司)内完成扩增。
引物(由上海生工合成)序列:MTHFR C677T(rs1801133),上游 5′-GGTCAGAAGCATATCAGTCATG-3′,下游:5′-AGCGAACTCAGCACTCCAC-3′。
ABCB1 C3435T(rs1045642):上 游 5′-TTCAGCTGCTTGATGGCAAA-3′ ,下 游 5′-AGGCAGTGACTCGATGAAGG-3′。
PCR 扩增程序:MTHFR C677T,95 ℃预变性 5 min。95 ℃变性 30 s;58 ℃ 退火 30 s;72 ℃延伸 40 s;共 30 个循环。72 ℃延伸 7 min 结束,4 ℃ 保存。ABCB1 C3435T,95 ℃预变性 5 min。95 ℃变性 30 s;57.1 ℃退火 30 s;72 ℃延伸 30 s;共 30 个循环。72 ℃延伸 5 min 结束,4 ℃ 保存。
检测:扩增结束后用2%琼脂糖凝胶电泳对扩增产物进行特异性验证。剩余PCR 产物原液送至生工生物工程(上海)股份有限公司测序,测序结果以CHOMAS软件与MTHFR 和ABCB1 基因SNP 位点的标准序列比照,以确定基因型。
1.2.3 肝肾功能评价
记录患者使用HD-MTX 治疗前后的肝肾功能,肝脏毒性反应评价参照美国国立研究所常规毒性判定标准,其中肝功能损害主要表现为丙氨酸氨基转移酶水平升高;肾功能损害的判定为血肌酐值超过基础值的1.5 倍。
1.3 统计学处理
采用 Excel 2019 和 SPSS 25.0 统计学软件分析。计数资料以率(%)表示,计数资料比较及基因型分布与Hardy-Weinberg 平衡定律相符情况分析采用 χ2检验。P < 0.05 为差异有统计学意义。
2 结果
2.1 基因型分布
采用 PCR-直接测序法测定 MTHFR 677 与ABCB1 3435 位点基因型,结果见图1 和图2(箭头所指为变异碱基 )。131 例患者中,MTHFR 677 CC 型 52 例(39.69%),CT 型 53 例(40.46%),TT 型 26 例(19.85%),C 和T 的等位基因分布频率分别为59.92%和40.08%。ABCB13435CC 型 53 例(40.46%),CT 型 45 例(34.35%),TT 型 33 例(25.19% ),C 和 T 的等位基因分布频率分别为 57.63%和 42.37%。且 2 个位点均以 CC 型为野生纯合型,CT 型为突变杂合型,TT 型为突变纯合型。经 χ2检验,各基因多态位点基因型分布均符合Hardy-Weinberg 定律(P > 0.05),入选样本具有群体代表性。
2.2 基因多态性与MTX 排泄延迟的关系
图1 MTHFR 677 位点基因分型波形图Fig.1 Genotyping waveform figure of MTHFR 677 site
图2 ABCB1 3435 位点分型波形图Fig.2 Genotyping waveform figure of ABCB1 3435 site
131 例患者中,出现 MTX 排泄延迟 70 例(53.44% )。MTHFR 677 位点及 ABCB1 3435 位点 CT 型携带者和TT 型携带者发生排泄延迟的比例均高于CC 型携带者,但差异均无统计学意义(P >0.05)。详见表 1。
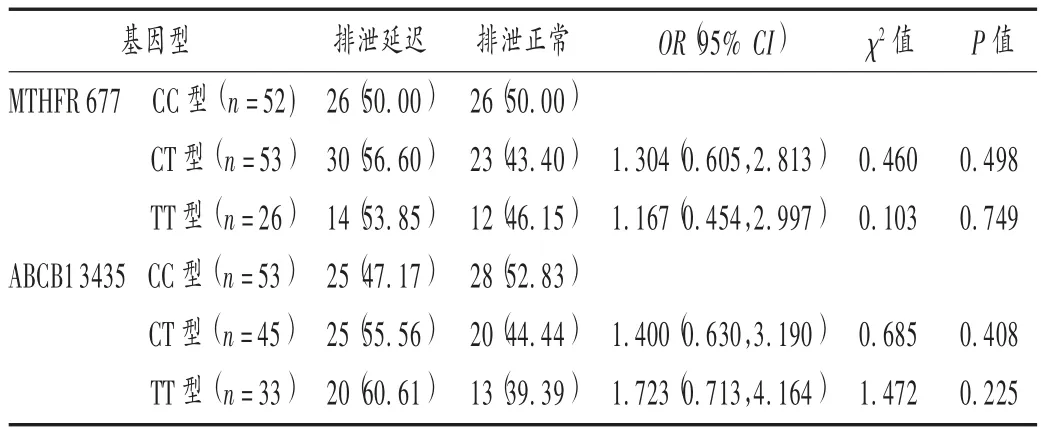
表1 基因多态性与甲氨蝶呤排泄延迟的相关性[例(%)]Tab.1 The correlation between gene polymorphisms and MTX-elimination delay[case(%)]
2.3 基因多态性与MTX 肝肾毒性的关系
131 例患者中,发生肝功能异常 23 例(17.56% ),肾功能异常10 例(7.63%)。由于发生肝肾损伤的人数较少,将患者按是否携带T 等位基因分为CC 型(野生型)组和(CT+TT)型(突变型)组进行分析。本研究中,MTHFR 677 位点(CT+TT)型携带者肝肾功能损伤发生率均较 CC 型高,但差异无统计学意义(P > 0.05),结果见表 2;ABCB1 3435 位点(CT+TT)型携带者肝功能损伤发生率明显高于 CC 型(P <0.05),两者肾功能损伤发生率比较,差异无统计学意义(P >0.05)。详见表 2和表3。

表2 MTHFR 677基因多态性与甲氨蝶呤肝肾损伤的相关性[例(%)]Tab.2 The correlation between gene polymorphism of MTHFR 677 and MTX-induced liver and kidney injury[case(%)]

表3 ABCB1 3435 基因多态性与甲氨蝶呤肝肾损伤的相关性[例(%)]Tab.3 The correlation between ABCB1 3435 gene polymorphism and MTX-induced liver and kidney injury[case(%)]
3 讨论
MTHFR 是参与DNA 合成和甲基化的重要限速酶,催化体内的5,10-亚甲基四氢叶酸还原为5-甲基四氢叶酸,影响核酸代谢过程。MTX 主要通过影响核酸代谢发挥细胞毒作用,药效与5,10-亚甲基四氢叶酸的浓度呈正相关。ABCB1 主要位于细胞膜上,可以通过机体内ATP 水解释放的能量以主动转运形式将药物泵出细胞,由它编码的 P-糖蛋白能影响药物在机体内的吸收、分布和排泄。
李静等[8]研究发现,携带 MTHFR 677 位点(CT+TT)型ALL 患者用药后48h 时的血药浓度明显高于CC 型(P < 0.05)。杨丽华等[9]研究 40 例 ALL 患儿的结果显示,携带(CT+TT)型患儿接受HD-MTX 治疗后48 h时的 MTX 血药浓度明显高于 CC 型(P = 0.006)。但以上研究并未对患者(儿)MTHFR 677 基因多态性与MTX用药后48 h 排泄延迟的相关性进行讨论。李菲等[10]的研究结果表明,携带MTHFR 677 位点(CT+TT)型不同患儿的 MTX 排泄延迟发生率相当(P > 0.05),本研究结果与之一致。近年来,对ABCB1 3435 位点(CT+TT)型与MTX 在体内代谢排泄相关性的研究结果也不尽相同。KIM 等[11]研究 ABCB1 3435(CT+CC)型与 MTX 清除率的关联性时发现,CC 型和CT 型携带者清除率明显大于 TT 型(P < 0.05)。SUTHANDIRAM 等[12]测定了亚洲成人ALL 与非霍奇金淋巴瘤患者使用HD-MTX化疗后48 h 的血药浓度与ABCB1 3435 位点(CT+TT)型基因多态性。两者结果均与本研究一致。GREGERS等[13]对丹麦急性白血病患儿的研究显示,ABCB1 3435位点(CT+TT 型)基因多态性对MTX 的药物代谢动力学无明显影响,本研究中亦未发现该位点多态性与MTX 排泄延迟有关。
郑苗苗等[14]对 52 例 ALL 患儿进行了 MTHFR 677位点(CT+TT)型基因型检测,按国立癌症研究所常规毒性判定标准对患者化疗后不良反应进行统一评价,结果显示,各基因型发生HD-MTX 相关毒副反应的差异无统计学意义(P > 0.05)。伍艳鹏等[15]筛选了 ALL 患儿 73 例,PCR 扩增后测序鉴定 MTHFR 677 位点(CT+TT)基因型,显示该位点与MTX 引发的不良反应无显著相关性。陈先睿等[16]研究发现,闽南地区 ALL 患儿MTHFR 677 位点(CT+TT)型不同基因组的 MTX 化疗肝肾功能损害发生率相当(P > 0.05)。朱忱等[17]纳入9 篇文献进行Meta 分析,结果与上述研究结果相同。本研究结果显示,MTHFR C677 位点(CT+TT)型基因与肝肾功能损伤的发生率无明显相关性,ABCB1 3435位点(CT+TT)型携带者肝功能损伤的发生率明显较CC 型 高 (P < 0.05)。CORNET 等[18]的 研 究 显 示 ,当ABCB1 3435 位点发生C >T 突变后可产生不耐热的酶变体,导致用药后体内同型半胱氨酸水平迅速上升,造成肝功能损伤。陆爱东等[19]报道,ALL 患儿的 ABCB1 3435 位点(CT+TT)型在使用HD-MTX 后肝功能损伤发生率高于 CC 型。朱影等[20]研究发现,ABCB1 3435 位点TT 型携带者发生肝功能损伤的风险较高。刘爽等[21]纳入12 篇相关文献的Meta 分析结论与上述资料相同。本研究结果与陆爱东等[19]的研究结果一致。
综上所述,ABCB1 3435 位点(CT+TT)型基因多态性与血液系统肿瘤患者使用HD-MTX 后的肝功能损伤相关,后续将进一步研究MTX 代谢排泄相关酶基因多态性与MTX 排泄延迟、毒副作用相关性的机制,为HD-MTX 个体化用药提供更多依据。
