CT扫描电压与CT值-相对电子密度值转换曲线不匹配对放疗计划剂量的影响
2021-04-08孔繁图陈露茜金锦辉董洁贺亚迪李政欢
孔繁图,陈露茜,金锦辉,董洁,贺亚迪,李政欢
1.中山大学附属第三医院肿瘤放射治疗科,广东广州510630;2.南方医科大学生物医学工程学院,广东广州510515
前 言
随着现代放疗技术的成熟和设备的不断发展,精确放疗对设备精度和治疗计划系统的计算精度要求也越来越高,以CT 扫描为基础的放射治疗计划设计在肿瘤治疗中扮演了越来越重要的角色[1]。定位CT作为放疗计划设计的重要组成部分,CT扫描参数的差异可能会使某一组织重建影像的CT 值发生改变[2]。物质的相对电子密 度(Relative Electron Density,RED)影响着射线在人体组织中的吸收与散射,因此准确标定采集数据时CT 值与物质RED 的关系,成为提高现代精确放疗计划系统中不均匀组织计算精度的基础[3]。
保证计划系统剂量计算的准确性是精确放射治疗的基础,而放疗定位图像CT 值的准确性决定着剂量计算的精度[4-5]。CT 值代表X 射线穿过组织被吸收后的衰减值,主要有3 个方面的因素影响CT 值:(1)CT 的设备参数,如扫描电压、图像采集层厚等的影响;(2)患者因素,如患者外轮廓、植入物等的影响;(3)其他辅助设备,如病床、固定材料等的影响[6]。
在6 MV 光子线下,高密度组织材料对剂量的影响比低密度组织材料更敏感,高密度组织材料(HU值>100)中10%的RED值变化将会引起3%的剂量改变[7]。高密度组织在不同的扫描电压下,其CT 值变化较低密度组织大;CT 值-相对电子密度值(CTRED)转换曲线造成的剂量计算差异不受放疗技术(如适形、调强)的影响[8]。人体各部位的组织构成复杂,在不同扫描部位采集得到的CT-RED 转换曲线会不一样,为了确保剂量计算的精度,对于头部与胸部肿瘤应该尽量选择各自扫描模式下的CT-RED 转换曲线进行剂量计算[9]。本研究旨在探讨CT扫描电压与CT-RED 转换曲线不匹配的情况下对放疗计划剂量计算的影响。
1 材料
使用放疗定位CT,设置特定参数及序列,扫描已知密度模体,选用CIRS062M 型模体通过放疗计划系统(TPS)建立各个扫描条件下的CT-RED 曲线,并利用TPS 设计模体照射计划。其中,放疗定位CT 为西门子(Siemens)的SOMATOM Definition AS64层大孔径螺旋扫描CT,定位床面为放疗专用碳纤维平面床板;激光定位仪为GAMMEX 公司的三维移动激光灯;TPS为医科达公司的MONACO5.11.01版本。
计划设计模体如图1所示,其结构为直径14 cm的均匀密度石蜡,石蜡中心为CIRS062M 型的062MA-18 号模体,物理密度1.82 g/cc,电子密度5.66×1023electrons/cc,相对水电子密度1.695,直径2.5 cm。

图1 高密度模体嵌入均匀石蜡CT图像Fig.1 CT image of high-density phantom embedded in a uniform paraffin phantom
2 方法
2.1 建立CT-RED转换曲线
扫描前进行放疗大孔径CT机自检,确保CT工作状态正常。CT 扫描电压分别设置为80、100、120 和140 kV,电流均为382 mAs,扫描层厚为3 mm。扫描模体及其CT图像如图2所示。在CT横断面中测量各模体棒的对应CT值,测量选取区域为模体棒中心。以圆形取样,其直径为模体棒直径的1/3,共取4个层面统计其CT均值。将相同模体内层和外层CT值取平均,结果如表1所示。通过MONACO计划系统CT-RED转换曲线程序建立不同扫描电压的CT-RED转换曲线(图3)。

图2 CRIS062电子密度模体及其CT扫描图像Fig.2 CRIS062 electron density phantom and its CT image
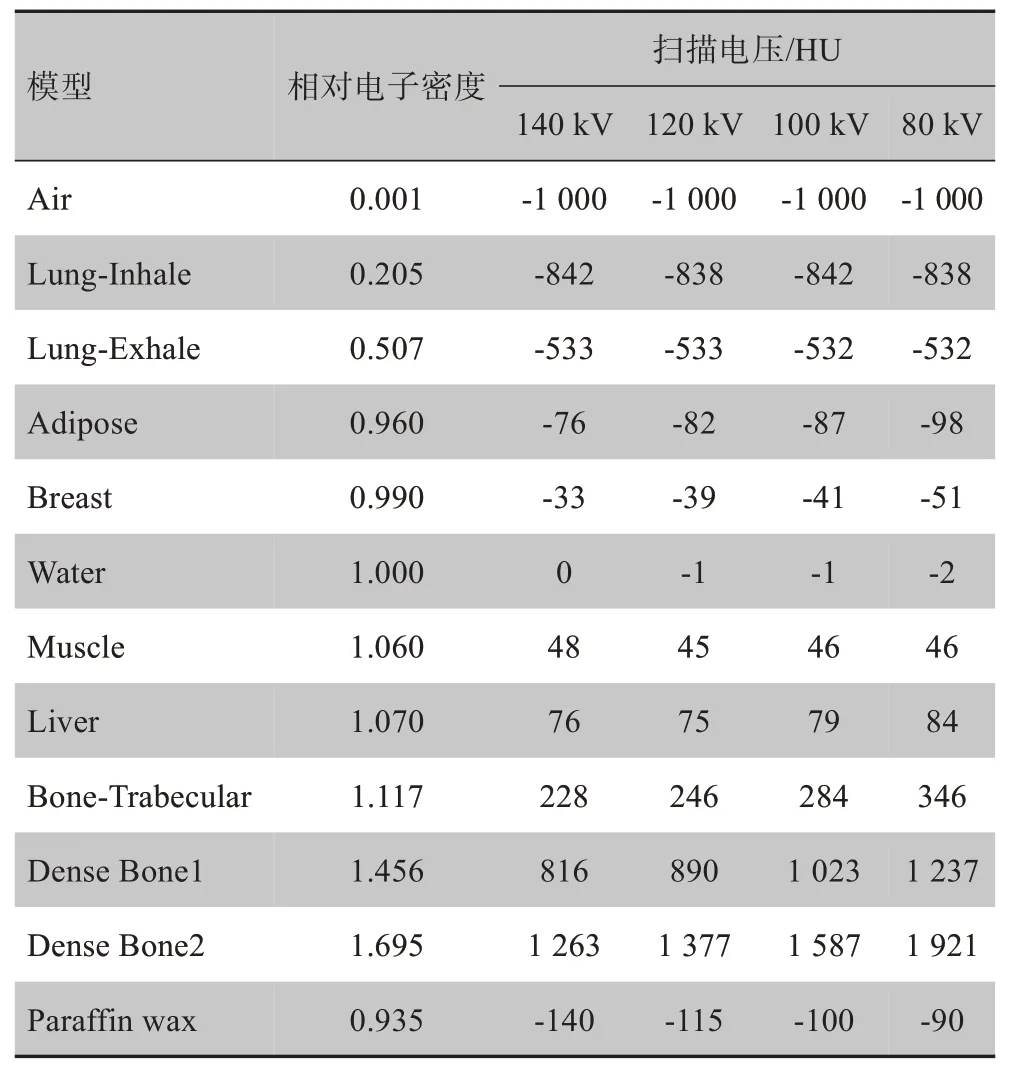
表1 等效组织模体对应的相对电子密度和CT值Tab.1 Relative electron density(RED)and CT number of the tissue-equivalent phantom
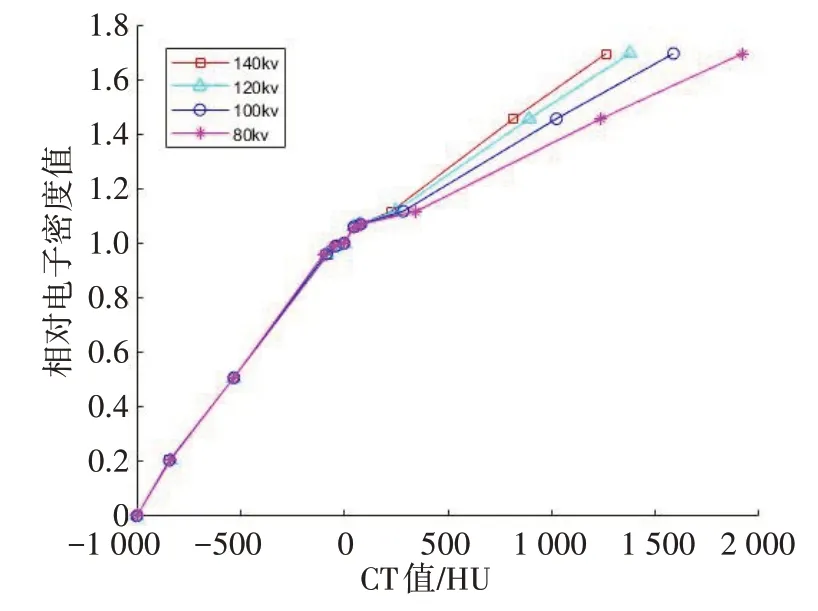
图3 不同扫描电压下CT值与相对电子密度值的转换曲线Fig.3 CT-RED conversion curves under different voltages
2.2 实验设计
嵌有062MA-18 高密度模体的石蜡分别以电压80、100、120、140 kV,电流382 mAs,3 mm 层厚进行扫描,将该4 套CT 图像传至MONACO 治疗计划系统。勾画石蜡外轮廓并命名为Patient,勾画高密度组织并命名为计划靶区(Planning Target Volume,PTV),在该4 套CT 图像分别设计0°、45°、90°、135°、180°、225°、270°、315°的单野计划,图4为0°的单野计划,射野参数如下,grid spacing:3 mm、statistical uncertainty:2%,PTV 外放1.0 cm 得到照射野范围,机器跳数100 MU,分别在射野中心轴上PTV 前、PTV中心、PTV 后等距离4 cm 处建立3 个感兴趣点,命名为I1、I2、I3。按照射线衰减规律,DI1、DI2、DI3(感兴趣点I1、I2、I3点剂量)及PTV 剂量统计值Dmean(靶区剂量均值)、D2(2%体积覆盖剂量)、D98(98%体积覆盖剂量)能有效反映不同照射计划情况下,照射计划的剂量学统计情况。

图4 0°单野计划,图中“+”依次为I1、I2、I3感兴趣点Fig.4 Three points of interest(I1,I2 and I3)were marked as‘+’in the 0°single-field radiotherapy plan
在0°、45°、90°、135°、180°、225°、270°、315° 8 个角度分别设计相同参数的单野计划,每个角度正确选择CT 扫描电压和CT-RED 转换曲线分别存在4 种情况,扫描电压和CT-RED 转换曲线匹配共32 组,命名为A,如表2所示。将CT扫描电压与CT-RED转换曲线不匹配的分组命名为B,共96 组,如表3所示。整个研究共计128 组计划数据,每组包含6 个剂量学统计参数,实验结果数据使用SPSS 20 进行独立样本t检验,以验证计划剂量差异情况。

表2 CT扫描电压与CT-RED转换曲线匹配的分组Tab.2 Match of voltages and CT-RED conversion curves and its grouping

表3 CT扫描电压与CT-RED转换曲线不匹配的分组Tab.3 Mismatch of voltages and CT-RED conversion curves and its grouping
2.3 实验结果
根据不同CT 扫描电压建立的CT-RED 转换曲线表明,在不同扫描电压下高密度组织材料的RED 并不完全相同,扫描电压越高RED 越大。包含代表肺、水、肌肉和骨头组织的模体在不同CT 扫描电压下的CT值如图5所示,其中在模体RED值为1.456时因不同扫描电压造成的CT 值变化较其余RED 值大。CTRED 转换曲线(图3)表明在CT 值500 以下时的RED值几乎重叠,因剂量计算以相对电子密度为基础,CT值为500 以下的组织并不会带来明显的剂量计算差异。本课题研究的高密度组织CT 值为1 500,处于RED 变化较大的区域,由此将引起较大的剂量计算差异。

图5 不同扫描电压下不同密度模体CT值差异Fig.5 Differences in CT number of different density phantoms under different voltages
设计不同条件的照射计划,其剂量学统计结果如表4所示。分组A 和B 分别为32 组和96 组,共计128 组数据,A 组和B 组的剂量学参数Dmean、D2、D98、DI1、DI2和DI3统计值如表4所示。利用独立样本t检验统计A 组与B 组的剂量学参数差异情况。其中进行独立样本t检验前提条件为方差齐次,其各项参数统计值F值均大于0.05(F>0.05),说明其为方差齐次,可以进行独立样本t检验分析数据。统计分析数据显示,剂量学参数D2和DI1的比较差异,不具有统计学意义(P>0.05),而Dmean、D98、DI2和DI3的比较差异,具有统计学意义(P<0.05)。独立样本t检验表明,CT 扫描电压与CT-RED 转换曲线匹配与不匹配情况下,其带来的剂量学差异具有统计学意义。
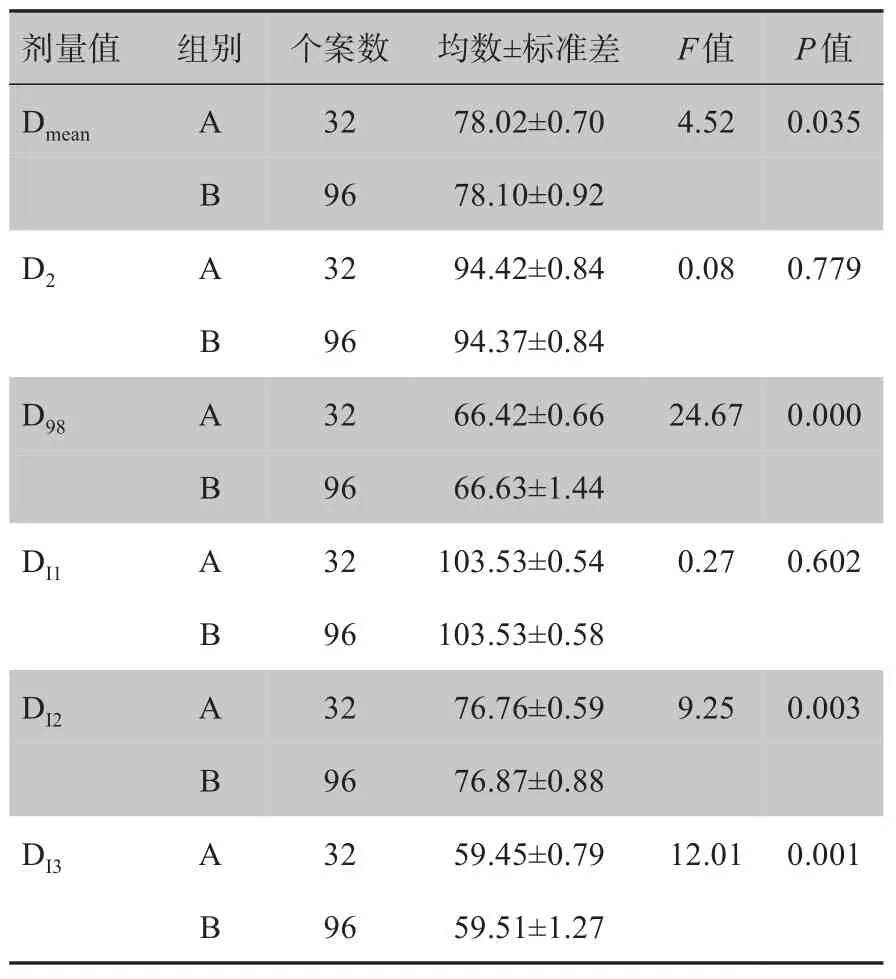
表4 分组数据统计结果(Gy)Tab.4 Results of statistical analysis on grouping data(Gy)
3 结论与讨论
根据统计分析结果,其符合射线入射物体前后的衰减规律,其剂量学统计量I1表示射线在入射高密度物体前剂量差别不大,配合CT-RED 转换曲线(图3)可得知,射线入射前经过区域的CT 值变化不大,其对应RED 值几乎无差异,计划系统计算剂量亦无差异。而剂量学参数Dmean、D98、DI2和DI3比较差异有统计学意味着射线通过高密度物质后,因为其RED值的差异造成计划系统计算剂量的差异,因此错误匹配的CT-RED 转换曲线会造成高密度物质内部与射线出口处的剂量差异。综合各项剂量学参数统计学比较结果,为保证剂量计算结果准确,放疗患者CT定位的扫描电压需要与TPS 计划设计时选取的CTRED 转换曲线匹配,否则会造成高密度组织中的剂量和射野出口处的剂量计算有较大差异,从而影响放疗计划的准确性。
放射治疗过程中,患者所接受的剂量通常与照射区域内组织的电子密度有关。组织不均匀性对剂量分布的影响主要有以下两个方面:改变了照射区域内原射线的吸收和散射的分布,改变了次级电子的注量分布[10]。CT值是放射治疗计划系统剂量计算的基础,反映物质对X 射线的平均衰减能力,因此不同组织就体现了不同的CT值[11]。
CT球管发射出的射线能量会因不同工作电压而发生变化,不同的射线能量和物质相互作用导致的光电效应强度产生变化,光电效应在高电子密度组织中差异较大。不同扫描电压下,CT 值在相对较低的电子密度组织中差异较小,在相对较高的电子密度组织中差异较大[12]。不均匀组织中吸收剂量计算点所在位置对剂量点的剂量计算影响很大,位于不均匀组织后方的点,所受影响主要是原射线衰减的改变;位于不均匀组织附近的点,散射线的改变影响是主要的;位于不均匀组织中及组织界面处,次级电子注量的改变是主要的[13]。在计划系统中,根据从CT 图像中得到的RED 进行剂量计算,对不均匀组织电子密度进行校正,再依据蒙特卡罗算法精确计算照射区域内的剂量分布[14-16]。相同组织在不同扫描条件下,会造成最大265 HU 的CT 值差别,此时可造成2.1%的剂量计算偏差[17]。
如图3所示,在不同扫描电压下建立的CT-RED表,CT值为-1 000到0之间的曲线几乎重合,CT-RED曲线不随着扫描电压变化而变化,因而在此CT 值范围内的相对电子密度恒定,所以在射线进入高密度组织材料前的剂量计算点I1的剂量并不会随着扫描电压变化而变化。根据ICRU 24号报告,肿瘤靶区剂量精确性应好于5%[18]。但是影响剂量计算精确性的因素很多,在直线加速器执行治疗过程中多叶光栅到位精度会随着机架的运动而受到重力作用的影响[19],同时治疗床板对射线也会产生1.7%~6.1%衰减的影响[20-21]。但本研究中CT 值超过1 000 HU 后,随着CT 值的增加在不同扫描电压下造成的RED 值差距越来越大,本研究中高密度材料在80、100、120和140 kV 时的RED 曲线显著分开,因此可带来剂量计算的偏差。本研究TPS中采用的是蒙特卡罗算法,但是选择蒙特卡罗、卷积、锥形束等不同的计算方法并不会对剂量计算产生明显的误差[22]。CT模拟定位机的扫描电压对剂量计算的影响很大,因此治疗计划中选用的CT-RED 转换曲线电压应与CT 扫描电压相一致[23]。在放射治疗中,物理师在设计治疗计划时,使用精确的CT-RED 转换曲线非常重要,需要与患者的CT 模拟定位时扫描电压相一致,确保剂量计算用的相对电子密度信息与患者体内相对电子密度相一致。
从分析的数据来看,选择不同的扫描电压及选用不同电压的CT-RED 曲线对高密度组织中及高密度组织后的剂量影响较大。为保证最终剂量计算的精度,特别是当CT 图像中有高密度组织材料存在的时候,扫描电压和选用的CT-RED 表的电压应该一致。
