蛋白激酶SAPK2响应水稻缺钾胁迫的机制研究
2021-04-08娄灯吉李沁妍赵秋红杨晓艳余迪求
娄灯吉,陈 祯,李沁妍,陈 琴,赵秋红,杨晓艳,余迪求
(1.玉溪师范学院 化学生物与环境学院/云南省高校滇中道地药材研究重点实验室,云南 玉溪 653100;2.昆明理工大学 生命科学与技术学院,云南 昆明 650500;3.云南大学 云南省生物资源保护与利用国家重点实验室,云南 昆明 650091)
在植物的营养生长阶段和生殖生长阶段都需要钾(K)元素。一般来说,植物细胞质中的K浓度保持在100 mmol/L左右,以维持各种生理和生化代谢过程的顺利进行[1]。植物受到低K或缺K胁迫信号时,首先被根系表皮细胞的质膜(Plasma membrane)所感知,然后传递到细胞中,植物体会产生一系列的生理生化反应来应对K逆境胁迫[2]。短时间缺K,植物在开始的几个小时内最明显的特征就是细胞膜电位的改变和ROS(Reactive oxygen species)产生等[3]。尽管细胞外的K浓度低,短期缺K时细胞内的K浓度不会有太大变化,但是长期缺K会导致细胞内的K浓度显著降低,植物会出现典型的缺K症状,一些代谢活动也会受到抑制[4]。
K是影响水稻(Oryzasativa)产量和品质的关键因子之一,由于我国K肥资源匮乏,且长期高密度种植,造成土壤缺K现象越来越严重,这一情况已严重制约我国农业的发展和粮食安全。20世纪60年代,研究人员对大麦K吸收动力学进行研究,提出了植物K吸收的2种机制:机制Ⅰ和机制Ⅱ。其中,机制Ⅰ在K浓度极低(≤0.2 mmol/L)条件下起作用,因此被称为高亲和性K吸收系统;机制Ⅱ在高K浓度(≥1 mmol/L)条件下起作用,被称为低亲和性K吸收系统。2002年BAFIUELOS等[5]报道了KUP/HAK/KT(K+uptake permeases/high-affinity K+transporter/K+transporter)家族的17个成员(OsHAK1—OsHAK17),此后,又发现了10个成员(OsHAK18—OsHAK27)[6]。研究表明,在缺K和盐胁迫下,OsHAK1—OsHAK17在不同程度上受缺K和盐胁迫诱导表达,其中OsHAK1、OsHAK7、OsHAK16上调表达较明显[5]。
SnRK(Sucrose non-fermenting1-related protein kinase )在植物激素信号传导、逆境胁迫响应和生长发育调节等生理过程中发挥重要作用[7-10],其中SnRK2可通过激活离子通道蛋白KAT1(Potassium channel 1)、SLAC1(Slow anion channel 1)来响应渗透胁迫和ABA[7,9]。植物SnRK家族可以分为3个亚家族:SnRKl、SnRK2和SnRK3[11]。水稻基因组中有10个SnRK2成员,命名为SAPKs(Osmotic stress/ABA-activated protein kinases),依次是SAPK1—SAPK10,可分为3个亚家族,SnRK2Ⅰ包含SAPK4—SAPK7,SnRK2Ⅱ包含SAPK1—SAPK3,SnRK2Ⅲ包含SAPK8—SAPK10[12]。许多研究表明,SnRK2Ⅰ和SnRK2Ⅲ在水稻逆境胁迫和生长发育中发挥重要作用[13-15]。对于水稻中SnRK2 Ⅱ相关基因的研究相对较少,SAPK2是水稻SnRK2 Ⅱ亚家族成员,并且是拟南芥中SnRK2.7和SnRK2.8的同源基因,其生物学功能和作用机制相关信息较匮乏。KIM等[16]研究发现,SAPK2与OsPYL/RCAR5(Pyrabactin resistance-like/regulatory component of ABA receptor 5)互作,超表达OsPYL/RCAR5基因的转基因水稻种子萌发和萌发后生长阶段对ABA敏感。最近的研究表明,OsbZIP23(Basic region-leucine zipper 23)和OsbZIP46都可以被SAPK2、6、9磷酸化并提高水稻抗旱性[17-18]。本实验室前期研究发现,SAPK2在水稻干旱胁迫和ABA条件下作为正调控因子发挥作用[19]。 UMEZAWA等[20]报道,SAPK2基因在拟南芥中的同源基因SnRK2.8,在K元素缺乏的条件下表达量下调,参与钾元素的代谢过程。但关于SAPK2基因是否参与水稻中K元素代谢的报道至今未见。为此,对SAPK2基因在水稻缺N、P、K元素条件下的表达模式进行分析,并对SAPK2基因响应缺K胁迫的机制进行了初步探究,以期为进一步揭示SnRK2蛋白激酶家族的作用机制奠定理论基础。
1 材料和方法
1.1 试验材料
供试水稻材料为粳稻日本晴(OryzasativaL.spp.)。突变体株系sapk2-1和sapk2-7(S2-1和S2-7)均为本实验室保存,sapk2突变体在设计靶点序列时选在了SAPK2的第三外显子的编码序列(即111—118位氨基酸对应的CDS序列)。经鉴定,sapk2单突变体在相应位置均有移码突变,导致SAPK2的氨基酸序列在158位氨基酸(Ser)处过早终止[19]。试验中所有的水稻材料种子均为同一批次收获,并在同一条件下保存。
1.2 水稻SAPK2基因的序列分析
经生物信息学分析,SAPK2是水稻SnRK2Ⅱ家族成员。SAPK2的开放阅读框为1 020 bp,编码一个含339个氨基酸的多肽(LOC_Os07g42940)。
1.3 水稻SAPK2基因缺素表达模式分析
为了研究水稻SAPK2在不同元素(K、P、N)缺乏处理下的表达模式,对野生型和突变体材料进行了K、P、N缺乏处理。将野生型和突变体材料种子去种皮,经30%次氯酸钠消毒30 min后,用灭菌的双蒸水清洗5~6次,直至将残留的次氯酸钠洗净。随后将洗好的种子播种在MS培养板上,并置于人工气候室(光照周期为14 h光照/10 h黑暗,生长温度为白天28 ℃、晚上20 ℃)内萌发,7 d后用1/2 MS营养液培养。待水稻长至两叶一心后分别进行缺K(0 μmol/L K,-K)、缺磷(0 μmol/L P,-P)和缺氮(20 μmol/L N,-N)处理,分别在0、3、6、9、12、24 h采集叶片,液氮冷冻备用。根据NCBI 网站提供的mRNA 序列,利用软件Primer Premier 5.0设计水稻SAPK2基因的实时荧光定量PCR(qRT-PCR)引物(表1),根据TaKaRa公司生产的SYBR Primix ExTaq试剂盒配置试剂,并在RocheLightCycler480 定量PCR 仪上进行反应,选OsActin为内参基因。
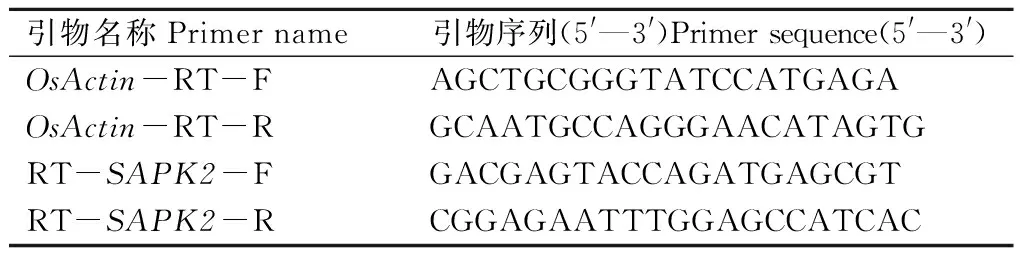
表1 SAPK2基因qRT-PCR引物信息Tab.1 Information of primers used in qRT-PCR of SAPK2 gene
1.4 水稻萌发试验
将野生型和突变体种子去种皮,经30%次氯酸钠消毒30 min后,用灭菌的双蒸水清洗5~6次,直至将残留的次氯酸钠洗净。随后将洗好的种子播种在不同的MS培养板上(正常MS培养板和缺K的MS培养板),并置于人工气候室(光照周期为14 h光照/10 h黑暗,生长温度为白天28 ℃、晚上20 ℃)内萌发10 d,每天固定时间统计萌发率直至第10天。
1.5 水稻缺K水培试验
野生型和突变体种子在1/2 MS 培养基上萌发,7 d后选取长势一致的幼苗移入同规格的水培盆中,先清水缓苗,然后MS全营养液培养,每盆30株(野生型和突变体各半)。调营养液pH值至5.8,每2 d 换一次营养液。水培21 d后移入正常培养液和缺K培养液中分别培养14 d,将幼苗分成地上部和根,分别测定其长度及干质量。
1.6 K+代谢相关基因的表达水平检测
野生型及突变体幼苗在1/2 MS营养液中培养,长至两叶一心后分别进行缺K(0 μmol/L K,-K)处理24 h,采集叶片,液氮冷冻备用。根据NCBI 网站提供的mRNA 序列,利用软件Primer Premier 5.0设计OsKAT1、OsKAT2、OsAKT1(Shaker K+channel 1)和OsHAK1等基因的qRT-PCR引物(表2),根据TaKaRa公司生产的SYBR Primix ExTaq试剂盒配置试剂,并在RocheLightCycler480 定量PCR 仪上进行反应,选OsActin为内参基因。
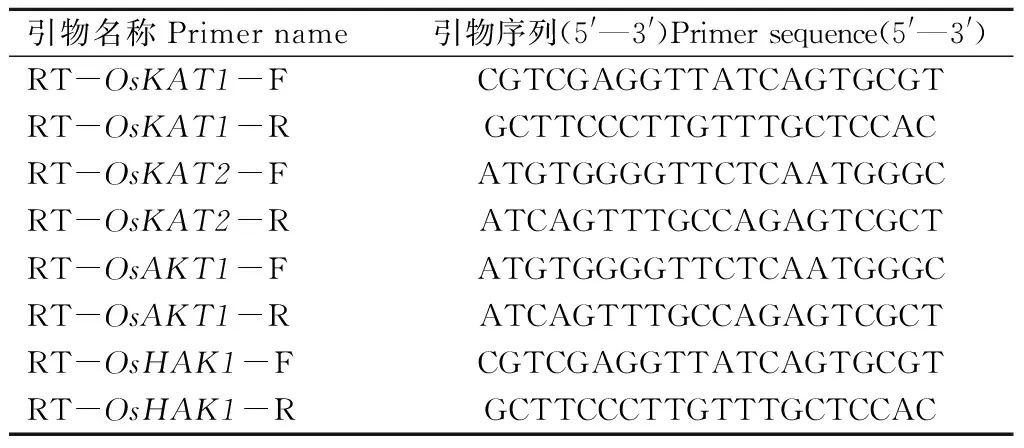
表2 K+代谢相关基因qRT-PCR引物信息Tab.2 Information of primers used in qRT-PCR of K+metabolisme related genes
1.7 数据处理
数据使用Excel 2010整理,用SPSS 22.0 软件进行差异显著性分析。
2 结果与分析
2.1 水稻SAPK2基因表达模式分析
qRT-PCR结果显示,SAPK2基因在缺N、P、K条件下表达量极显著下降,且随着处理时间的延长表达量不断下降(图1)。表明SAPK2可能参与了缺N、P、K胁迫的响应。
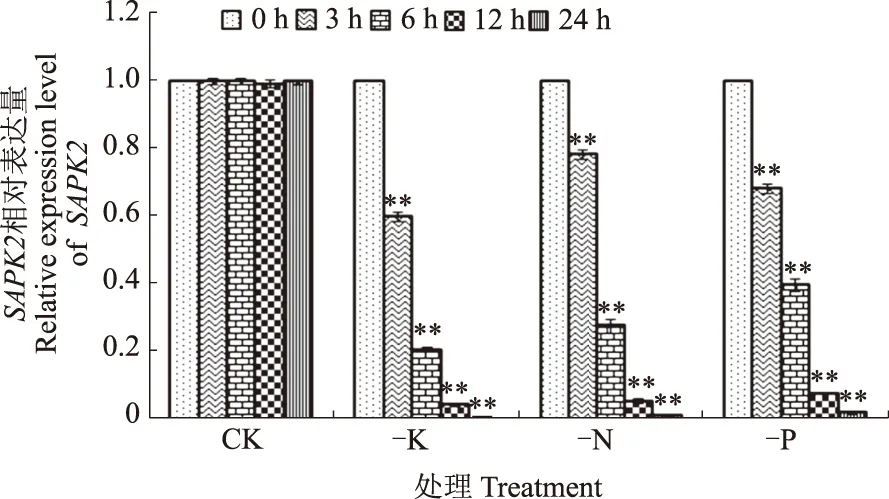
**表示0 h和其他时间之间存在极显著差异(P<0.01)** indicates statistically significant differences between 0 hour and other times (P<0.01)图1 水稻SAPK2基因在缺N、P、K条件下的表达模式分析Fig.1 Analysis of rice SAPK2 expression levels under K,N,P-deficient conditions
2.2 sapk2突变体在缺K条件下种子萌发情况分析
为了探讨SAPK2是否在种子萌发过程中参与K元素的代谢调节,研究了sapk2-1和sapk2-7突变体株系在种子萌发阶段响应缺K胁迫的情况。从2个突变体株系(sapk2-1和sapk2-7)的种子萌发试验结果可以看出,在正常MS培养板上,sapk2突变体和野生型之间无明显差异(图2A)。然而,缺K处理条件下,野生型种子在处理7 d时萌发率已经达到100%,而sapk2突变体种子在处理10 d时仍有部分种子没有萌发,萌发率约为92%(sapk2-1和sapk2-7种子萌发率分别为91%和93%)(图2B、C)。以上这些结果表明,SAPK2在种子萌发阶段,作为正调节因子响应K缺乏。


A:sapk2突变体与野生型水稻种子在正常固体培养基上的萌发率; B:sapk2突变体与野生型水稻种子在缺K固体培养基上的萌发率; C:sapk2突变体与野生型水稻种子在缺K固体培养基上的萌发情况A:Germination rates of seeds from sapk2 mutants and wild type plants grown on MS agar medium under control conditions; B:Germination rates of seeds from sapk2 mutants and wild type plants grown on MS agar medium under K deprivation condition; C:Germination phenotype of seeds from sapk2 mutants and wild type plants grown on MS agar medium under K deprivation condition图2 野生型和sapk2突变体种子在缺K条件下的萌发情况Fig.2 Germination phenotype of WT and sapk2 mutants under K deprivation condition
2.3 sapk2突变体在缺K条件下苗期生长情况分析
缺K胁迫通常会对水稻幼苗的生长产生严重的抑制。由图3可知,正常培养条件下,sapk2突变体和野生型地上部、根的长度和干质量均无明显差异;但是在缺K培养条件下,sapk2突变体与野生型相比,地上部长、干质量和根干质量均极显著下降,根长显著下降。表明SAPK2在水稻缺K响应中作为正调节因子发挥重要作用。
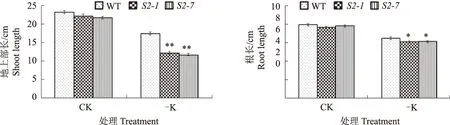

*、**分别表示突变体和野生型之间有显著(P<0.05)、极显著(P<0.01)差异,下同 * and ** indicate significant differences between mutant lines and wild type plants at 0.05 and 0.01 levels,the same below图3 缺K胁迫下野生型和sapk2突变体苗期生长情况Fig.3 Growth phenotype of WT and sapk2 mutants under K deprivation condition
2.4 sapk2突变体中K+代谢相关基因的表达水平分析
已有研究表明,内流型K离子通道是植物K吸收的主要途径,电化学分析表明,OsKAT1和OsKAT2能够作为内流型钾离子通道起作用,且OsKAT2比OsKAT1具有更高的K+吸收能力[21]。OsAKT1基因的突变体表现出K+吸收降低,老叶出现斑点,整个生长周期发育受到抑制,抽穗期和灌浆期延迟,产量降低[22]。OsHAK1在主根和侧根中表达,在表皮细胞和中柱、根茎结合部、茎、叶片以及小穗轴中均有表达[23]。K缺乏或者盐胁迫条件会诱导水稻中OsHAK1表达,与野生型相比,oshak1突变体对盐胁迫的敏感性增加,K的吸收以及K/Na降低,OsHAK1过表达则会增加水稻对K的吸收以及K/Na[23]。
为了进一步探究SAPK2参与调节K+平衡的可能途径,分析了OsKAT1、OsKAT2、OsAKT1和OsHAK1等K+代谢相关基因在缺K处理前后的表达水平。qRT-PCR结果显示,在缺K条件下,与野生型植株相比,sapk2突变体中OsKAT1、OsKAT2、OsAKT1和OsHAK1基因的表达水平均极显著下调(图4)。综合这些结果可知,SAPK2可能通过直接或者间接途径调节K+代谢相关基因的表达水平,参与调节K+在植物体内的平衡,从而参与水稻的缺K胁迫响应。
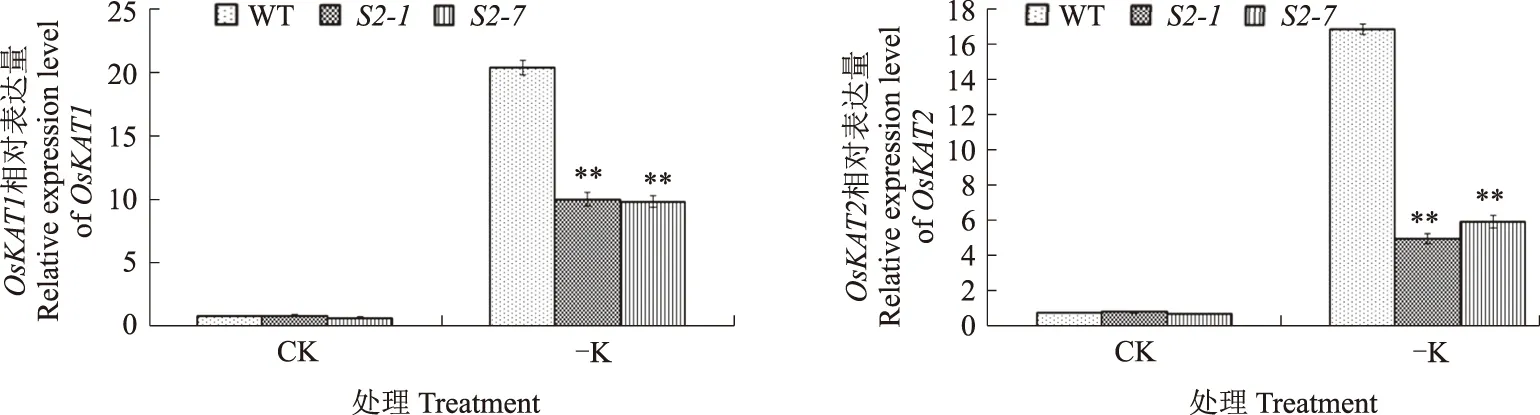
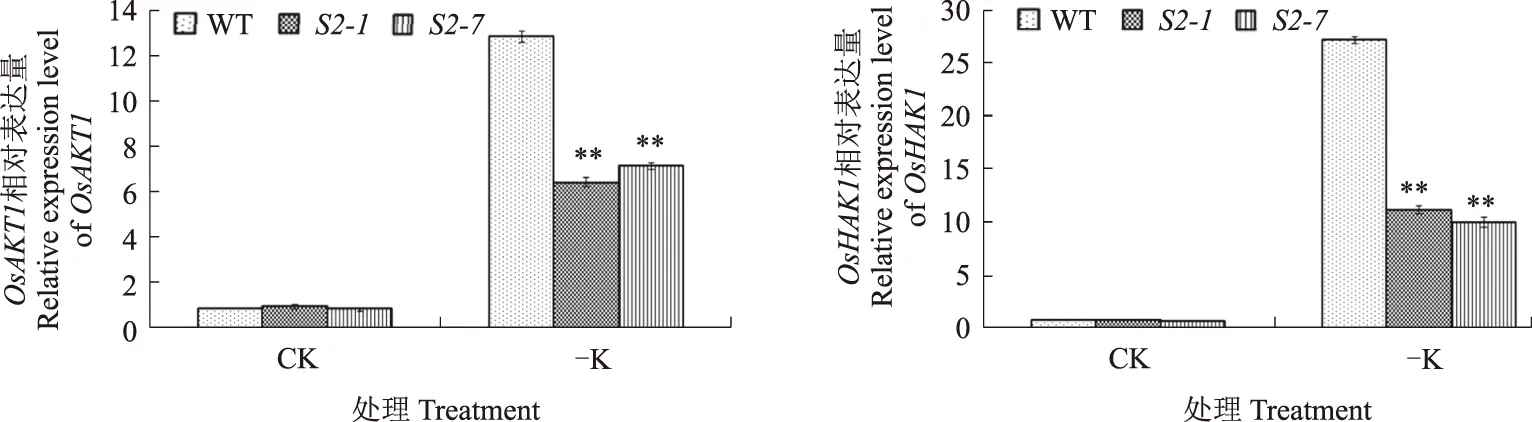
图4 水稻K+代谢调节基因的表达分析 Fig.4 Analysis of K+ homeostasis genes expression level in rice
3 结论与讨论
SAPK2是水稻SnRK2 Ⅱ亚家族成员,并且是拟南芥中SnRK2.7和SnRK2.8的同源基因。拟南芥中SnRK2.7和SnRK2.8基因的研究报道较多,但大多与逆境胁迫响应相关,关于参与元素代谢的报道仅见于UMEZAWA等[20]在2004年的报道,SAPK2的同源基因SnRK2.8参与K元素的代谢过程,而水稻中SAPK2参与K元素代谢至今未见报道。
拟南芥SRK2C/SnRK2.8正调控根系抗旱响应,超表达SnRK2.8基因可以上调相关胁迫响应基因的表达从而增加拟南芥植株的抗旱性[24]。SRK2C/SnRK2.8也参与根的生长代谢过程,超表达SRK2C/SnRK2.8基因可以促进根的伸长[25]。此外,研究表明,在拟南芥中超表达SnRK2.8基因能够明显促进根的发育和增加植株鲜质量,缺K处理会导致SnRK2.8基因的表达量明显下降[25]。本研究对SAPK2表达模式进行分析发现,缺N、P、K处理导致水稻中SAPK2表达量极显著下降,此结果说明SAPK2可能具有SnRK2.8类似的功能,参与N、P、K的代谢过程。
研究表明,ABA在抑制种子萌发和幼苗生长过程中发挥了重要作用[22]。最新研究报道指出,SAPK2参与水稻中ABA信号的传导,SAPK2依赖ABA对种子萌发和萌发后生长起正调节作用[19]。本研究中,在种子萌发期进行缺K处理的研究结果显示,与野生型相比,sapk2突变体在缺K条件下萌发明显延迟。此结果表明,SAPK2在缺K条件下的水稻种子萌发过程中发挥重要的正调节作用。为了进一步分析SAPK2在水稻缺K条件下的功能,分析了水稻苗期缺K条件下的生长情况,结果显示,与野生型相比,sapk2突变体在缺K条件下苗期生长受到严重的抑制,根和地上部的长度和干质量均显著下降。此结果表明,SAPK2在缺K环境下水稻苗期营养生长阶段发挥重要的正调节作用。另外,与野生型植株相比,sapk2突变体中OsKAT1、OsKAT2、OsAKT1和OsHAK1等K+代谢相关基因的表达水平明显下调,表明SAPK2可能通过调节K+代谢相关基因的表达水平,参与调节K+在植物体内的平衡,从而参与到水稻的缺K胁迫响应中,但其具体的信号通路有待于进一步研究。
