贵州猕猴桃果实腐烂病病原菌鉴定及分析
2021-04-08苏文文韩振诚李良良李苇洁任春光
苏文文,吴 迪,韩振诚,李良良,李苇洁,任春光
(贵州省山地资源研究所,贵州 贵阳 550001)
猕猴桃是我国重要的藤本果树,由于风味独特,营养价值极高,近年来已逐渐成为多个地区的支柱产业[1-2]。贵州生态环境优良,小气候多样,猕猴桃种质资源丰富,是我国猕猴桃种植大省。红阳和贵长作为贵州猕猴桃主栽品种,对大力推进贵州省经济发展发挥了重要作用[3]。近年来,随着种植面积的不断扩大,猕猴桃果实病害日益严重。研究表明,大多数病害主要由真菌侵染造成,影响猕猴桃的贮藏,给猕猴桃产业带来了一定的经济损失[4-5]。猕猴桃果实腐烂病主要发生在采摘后及贮藏期,发病初期果实表面没有明显特征,后期果实明显变软、腐烂,且伴有酒味,严重影响猕猴桃的外观及风味[6]。
猕猴桃果实腐烂病主要包括软腐病、蒂腐病、青霉病、日灼病。其中,对果实危害程度较大的为软腐病、蒂腐病[7-8]。目前,国内外关于猕猴桃软腐病病原菌的报道主要有葡萄座腔菌(Botryosphaeriadothidea)、间座壳菌(Diaporthephaseolorum)、拟茎点霉菌(Phomopsiscauloides)、盘多毛孢菌(pestalotiopsismicrospora)、交链格孢菌(Alternariaalternata)等[9-11]。关于猕猴桃蒂腐病病原菌的报道主要有间座壳菌和灰霉菌(Botrytiscinerea)[12-15]。随着病原菌的致病性分化以及环境等因素的影响,危害猕猴桃果实的病原菌种类在不断增加,其鉴定及相应的防控需要更多关注和研究。鉴于此,通过形态学及病原菌rDNA内部转录间隔区ITS序列对猕猴桃果实主要病原菌进行鉴定,通过致病性检测了解不同病原菌的致病性,明确引起贵州省猕猴桃果实腐烂病的病原菌种类,为猕猴桃果实病害防控及贮藏提供理论依据。
1 材料和方法
1.1 试验材料
供试病样及果实:于2018—2019年7—10月在贵州省水城县及修文县采集发病果实30个,病果分别为贵州猕猴桃主栽品种红阳和贵长。致病性检测所用果实为健康无病、大小一致的红阳和贵长,其中,红阳于水城主产区果园采购,贵长于修文县农户果园采购。
试剂及仪器:真菌基因组DNA快速抽提试剂盒及DNA Marker DL2000均从生工生物工程(上海)股份有限公司采购,引物 ITS1/ITS4送至生工生物工程(上海)股份有限公司进行合成。其余试验器材有超净工作台(苏州安泰空气技术有限公司)、光学显微镜(日本尼康有限公司)、水浴锅(天津市泰斯特仪器有限公司)、普通离心机(四川蜀科仪器有限公司)、移液枪(赛默飞世尔科技有限公司)、PCR仪(赛默飞世尔科技有限公司)、电泳仪(北京六一仪器厂)、凝胶成像系统(美国伯乐有限公司)、纯水仪[威立雅水处理技术(上海)有限公司]。
PDA培养基制备:马铃薯 200 g、琼脂粉17 g、葡萄糖20 g、去离子水1 L,调节pH值至7。
1.2 试验方法
1.2.1 病样采集与病原菌分离及纯化 于猕猴桃成熟期定期到田间采集果实,用流水冲洗干净,将果实病健交接部位的果皮撕下,放入75%的乙醇中消毒1 min。然后用灭菌的去离子水冲洗3次,放在灭菌的定性滤纸上,待残留的水分挥发后将病样置于PDA培养基中。将培养基放入25 ℃、黑暗培养箱中培养2~3 d。观察菌丝生长情况,并进行菌株纯化。具体方法:从培养基中挑取菌落边缘菌丝,置于新的PDA培养基上培养,即可得到纯化后的单个病原菌。
1.2.2 病原菌的形态学观察 将纯化的病原菌接种至新的培养基中,置于25 ℃条件下培养,于接种后6 d后对病原菌菌落特征进行观察。同时取少量菌丝于载玻片上,滴入适量蒸馏水,在显微镜下观察分生孢子形态特征,依据传统的真菌分类方法,初步确定病原菌种类[16]。
1.2.3 病原菌的分子生物学鉴定 参照真菌基因组DNA提取试剂盒操作说明提取菌株DNA。选取部分有代表性的菌株,利用通用引物ITS1(5′-TCCGTAGGTGAACCTGC-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[17]对其rDNA-ITS区域进行扩增。反应体系15 μL:模板DNA 2.1 μL、上游引物1.5 μL、下游引物1.5 μL、2×TaqPCR Master Mix 7.5 μL、蒸馏水2.4 μL。PCR反应程序:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃终延伸10 min,16 ℃保存。将PCR产物进行琼脂糖凝胶电泳检测,然后送至生工生物工程(上海)股份有限公司进行测序,测序结果用NCBI的多序列比对工具BLAST在GenBank数据库中进行同源序列比较,进一步明确病原菌的种类。
1.2.4 病原菌的序列分析 将测序所得序列提交至NCBI核酸序列比对库,获得不同菌株的序列登录号,下载各菌株的代表序列,对所得序列利用MEGA 7中的最大似然法(MI)进行系统发育分析及进化树的构建。
1.2.5 病原菌的致病性检测 将健康无病的红阳和贵长果实用蒸馏水冲洗后置于75%的乙醇中消毒1 min,用蒸馏水反复冲洗,置于通风的超净工作台上晾干,进行接种试验。
有伤接种:在猕猴桃健康果实上依次扎3个直径5 mm、深3 mm的伤口,用无菌牙签挑取新鲜的菌丝进行接种。将从红阳病果上分离到的病原菌接种于红阳健康猕猴桃果实上,从贵长病果上分离到的病原菌接种于贵长健康猕猴桃果实上。
无伤接种:按上述病原菌与猕猴桃果实的对应关系将病原菌分别接种于无伤口的健康猕猴桃果实上。
上述2个试验均以接种无菌的PDA培养基作对照(CK)。将不同处理的果实放入底部垫有无菌滤纸的容器中,盖上盖子,置于25 ℃条件下培养。定期对果实进行观察和拍照,记录病斑大小。
2 结果与分析
2.1 病原菌的分离与形态学观察
从红阳猕猴桃和贵长猕猴桃果实上共分离到20株病原菌,依据病原菌的菌落形态及显微镜观察,将其分为4类,并依次编号为M1—M4(图1)。其中,病原菌M1、M3分离于红阳猕猴桃果实上,分离率分别为10%、20%;病原菌M4分离于贵长猕猴桃果实上,分离率为10%;病原菌M2在红阳和贵长上都存在,分离率达到60%。
病原菌M1:病原菌培养至第6天,菌落直径为8 cm,菌丝白色、稀疏,呈放射状生长,基质初期为白色,后期为黄褐色(图1A)。在显微镜下观察,其分生孢子呈椭圆形,单胞,无隔膜,透明(图1a)。依据病原菌形态特征初步将其鉴定为拟茎点霉菌(Phomopsiscauloides)。
病原菌M2:病原菌培养至第6天,菌落直径为4.9 cm,气生菌丝浓密、棉絮状,初期为白色,后期菌落中央呈红色,向四周扩散(图1B)。在显微镜下观察,其分生孢子单胞,光滑,有卵圆形,有镰刀形(图1b)。依据病原菌形态特征初步将其鉴定为镰刀菌(Fusarium)。
病原菌M3:病原菌培养至第6天,菌落直径为4.4 cm,菌丝绒毛状,生长密集,初期为白色,后期逐渐变为黄褐色(图1C)。在显微镜下观察,其分生孢子呈棒状或者纺锤状,有隔(图1c)。依据病原菌形态特征初步将其鉴定为交链格孢菌(Alternariaalternata)
病原菌M4:病原菌培养至第6天,菌落直径为4 cm,菌落形态呈米色,紧贴于培养基表面(图1D)。在显微镜下观察,其分生孢子呈椭圆形,单胞,透明,光滑,里面有3个小油球(图1d)。病原菌形态特征与参考文献[18]报道相同,初步将其鉴定为黄瓜织球壳菌 (Plectosphaerellacucumerina)。
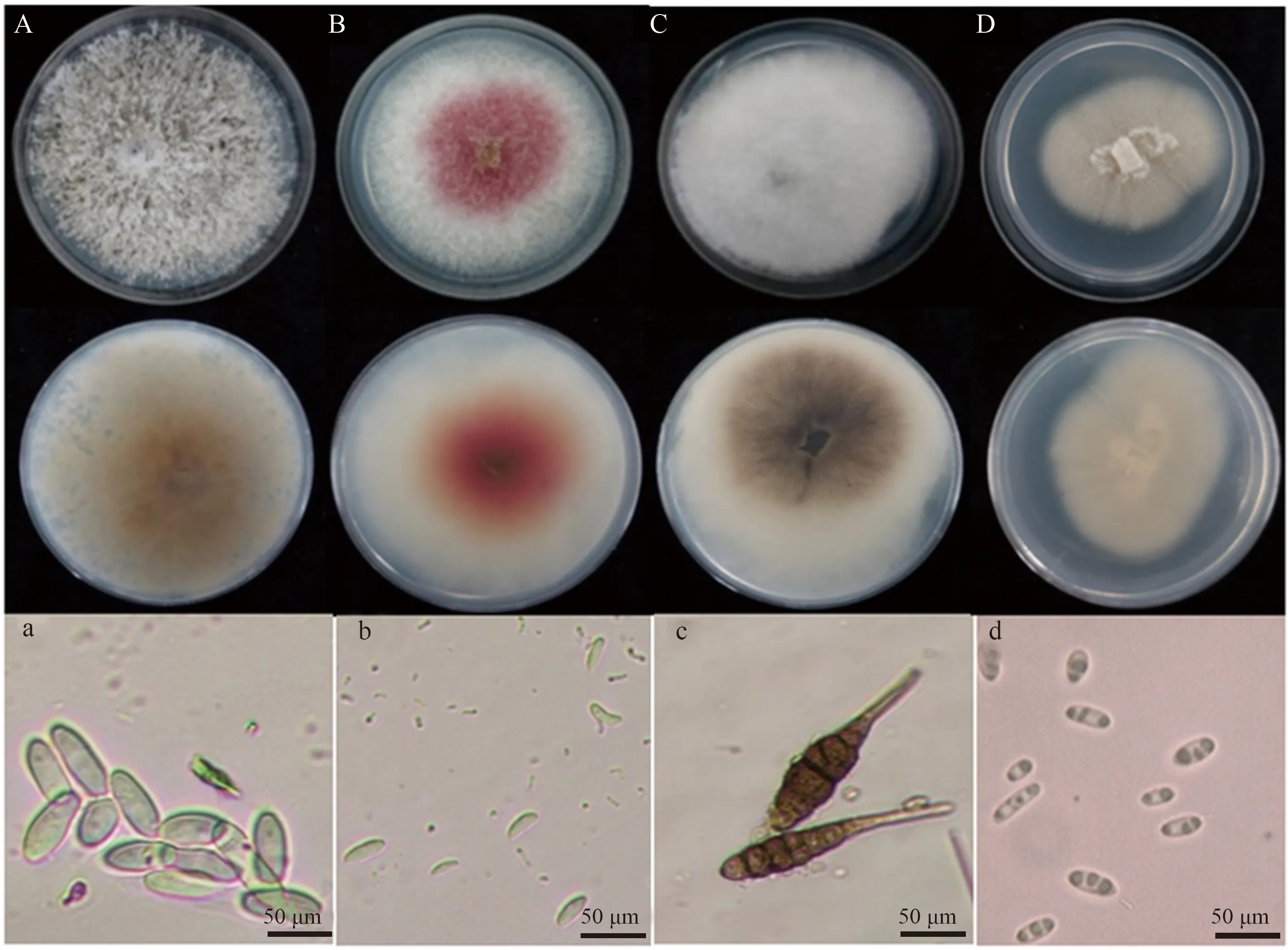
A—D:M1—M4病原菌,上、下图分别为菌落正面、背面;a—d:M1—M4病原菌分生孢子形态特征A—D:M1—M4 pathogens,the upper and lower pictures show the front and back of colony,respectively;a—d:Morphological characteristics of conidia of M1—M4 pathogens图1 病原菌菌落及分生孢子形态特征Fig.1 Morphological characteristics of colony and conidia of pathogens M1—M4
2.2 病原菌的分子检测及序列分析
将编号为M1—M4的菌株DNA进行PCR扩增,得到520 bp左右的片段。扩增测序结果提交到GenBank后,与同源序列比对构建的进化树见图2。由图2可知,病原菌M1位于拟茎点霉菌(Phomopsiscauloides)分支,病原菌M2位于镰刀菌(Fusarium)分支,病原菌M3位于交链格孢菌(Alternariaalternata)分支,病原菌M4位于黄瓜织球壳菌(Plectosphaerellacucumerina)分支,所比对序列的相似度均达到90%以上。结合形态学鉴定结果,判定此次分离得到的贵州猕猴桃果实腐烂病病原菌主要有拟茎点霉菌、镰刀菌、交链格孢菌和黄瓜织球壳菌。
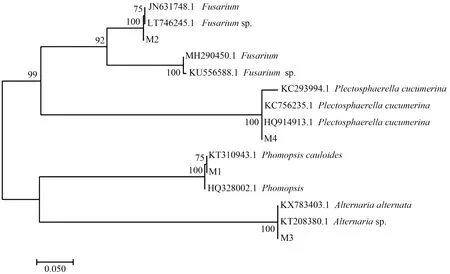
图2 基于rDNA-ITS基因序列的病原菌系统发育分析Fig.2 Phylogenetic analysis of pathogens based on rDNA-ITS gene sequence
2.3 病原菌的致病性检测
将病原菌M1—M4分别接种至大小一致、健康无病的果实后,无伤接种的果实均未发病。有伤接种的果实在接种后3 d开始发病,但发病特征不明显;接种后5 d,接种部位果实发生明显腐烂,肉眼可以观察到白色菌丝,有发酵汁液流出(图3),病斑最大直径可达3.75 cm(表1)。将接种后的果实进行组织分离,病原菌形态特征与前期分离的形态特征一致。

M1—M4:分别代表拟茎点霉菌、镰刀菌、交链格孢菌、黄瓜织球壳菌,前面的M2来源于红阳猕猴桃病果,后面的M2来源于贵长猕猴桃病果;a-f:CK和病原菌接种至果实后发病症状;a1-f1:CK和病原菌接种后发病果实截面M1—M4:Represents Phomopsis cauloides,Fusarium,Alternaria alternata and Plectosphaerella cucumerina respectively,the former M2 comes from the diseased fruit of Hongyang kiwifruit,and the latter M2 comes from the diseased fruit of Guichang kiwifruit;a-f:Symptoms of disease after inoculation of control and pathogens;a1-f1:Cross-section of diseased fruits after inoculation of control and pathogens图3 猕猴桃果实腐烂病菌致病性检测Fig.3 Detection of pathogenicity of the pathogens of kiwifruit rot disease
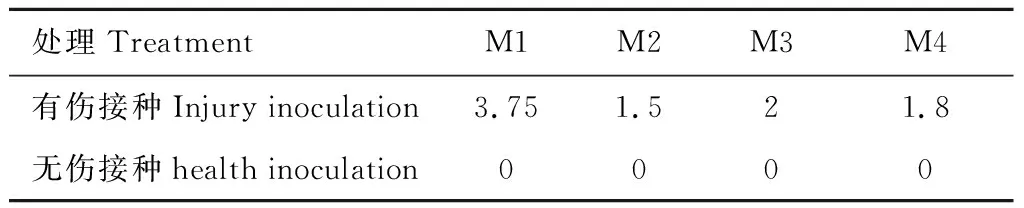
表1 病原菌分离物接种至猕猴桃果实后的病斑直径Tab.1 Disease spot diameter of pathogen isolates inoculated into kiwifruit cm
3 结论与讨论
猕猴桃果实腐烂病对猕猴桃的品质和风味有严重影响,鉴定猕猴桃果实腐烂病病原菌对提高猕猴桃产量及品质有重要作用。冯丽等[19]通过对贵长猕猴桃果实腐烂病进行研究,主要分离到曲霉菌(Aspergillussp.)、枝孢菌(Cladosporiumsp.)、镰刀菌和青霉菌(Penicilliumsp.)等;ZHOU等[9]从四川省猕猴桃主产区果实病害上鉴定出了葡萄座腔菌、小新壳梭孢菌(Neofusicoccumsp.)等;雷霁卿等[20]从贵州省红阳猕猴桃软腐病果实上鉴定出葡萄座腔菌、交链格孢菌、拟茎点霉菌、小新壳梭孢菌和间座壳菌等。本研究通过对贵州省水城县和修文县两地猕猴桃果实腐烂病病原菌的分离、纯化、形态学观察以及分子检测,得到4种主要病原菌,分别是拟茎点霉菌、镰刀菌、交链格孢菌和黄瓜织球壳菌。其中,拟茎点霉菌和交链格孢菌、镰刀菌在前人研究中均有报道,而黄瓜织球壳菌是首次在贵州省猕猴桃腐烂病病原菌鉴定中发现的致病菌。
黄瓜织球壳菌是寄主范围很广的真菌,可引起多种作物和瓜果发生萎蔫和腐烂。SATOU等[21]报道该病原菌引起了南瓜疫病;VITALE等[22]和GARIBALDI等[23]通过对葫芦科枯萎病和长尾菊叶斑病进行研究,认为该病原菌是引起作物猝倒病发生的主要原因。近年来,由黄瓜织球壳菌引起的病害逐渐增加,如日本报道的鲜切菊(Cichoriumendivia)发生茎部腐烂[22],意大利莴苣(Cichoriumendivia)出现叶斑病等[23],该病原菌也给我国辽宁省部分地区的番茄造成了严重危害[24]。本研究通过对猕猴桃果实病害进行病原菌分离,初步将黄瓜织球壳菌确定为侵染猕猴桃果实的一种新病原菌,其对猕猴桃果实造成的危害较拟茎点霉菌、镰刀菌和交链格孢菌轻,并且发生范围也较小,可能与该病原菌首次在猕猴桃果实上侵染有关。拟茎点霉菌、镰刀菌和交链格孢菌可以侵染猕猴桃果实,在猕猴桃根部和叶片病害的研究中也有报道[25-26],而黄瓜织球壳菌仅在猕猴桃果实病害中发生。黄瓜织球壳菌是在猕猴桃果实腐烂病鉴定中首次发现的一种病原菌,对猕猴桃果实病害的防控和生产实践具有一定的理论指导意义。
