伊立替康辅助FOLFOX化疗方案对结直肠癌患者血清肿瘤标志物及miR-200a、miR-190含量的影响
2021-04-08吴林峰郑梦梦陈伟克肖荣耀
吴林峰,郑梦梦,陈伟克,肖荣耀
吴林峰,郑梦梦,陈伟克,肖荣耀,温州市中西医结合医院肿瘤科 浙江省温州市 325000
0 引言
结直肠癌(colorectal cancer,CRC)为临床多发恶性肿瘤疾病,近年来受膳食结构转变及不良生活习惯养成等影响,其发病率持续增高,已成为严重威胁人类生命健康的疾病类型[1,2].化疗为临床治疗CRC的重要方式,其中FOLFOX (亚叶酸钙、奥沙利铂、氟尿嘧啶)为CRC常用化疗方案,可杀除恶性肿瘤病灶发挥治疗作用,但整体效果不佳[3-5].伊立替康在恶性肿瘤中也较常用,其属选择性DNA拓扑异构酶Ⅰ抑制剂,可结合于肿瘤细胞中DNA拓扑异构酶Ⅰ,断裂DNA双链,从而致使肿瘤细胞凋亡,具备广谱抗肿瘤活性[6].此外,miRNAs为具有良好应用前景的生物标志物,和肿瘤发生及进展关系密切,并具有癌基因及抑癌基因功能[7],因此认为通过观察miRNAs治疗前后变化情况可为临床治疗CRC提供新的思路.基于此,本研究选取我院结CRC者92例,分组探讨伊立替康辅助FOLFOX化疗方案应用价值.报告如下.
1 材料和方法
1.1 材料 选取2017-03月/2019-02我院CRC患者92例,依据简单随机数字表法分为研究组(n=46)与对照组(n=46).2组性别、年龄、肿瘤位置、病理类型、体质量指数(BMI)、美国东部肿瘤协作组(ECOG)体力状况评分等临床资料均衡可比(P>0.05),见表1,且本研究经我院伦理委员会审批通过.
1.2.1 选取标准:纳入标准:(1)符合《中国结直肠癌诊疗规范(2017年版)》[8]中原发性CRC诊断标准; (2)临床分期为Ⅳ期; (3)ECOG评分为0-2分; (4)预计生存期>6 mo;(5)年龄<80岁; (6)知晓本研究,签署同意书.
排除标准:(1)合并其他良恶性肿瘤; (2)合并肾肝等脏器器质性病变者; (3)合并无法控制性高血压者; (4)消化道出血或存在出血倾向者; (5)存在重度营养不良者;(6)合并全身性感染性病变者; (7)骨髓造血功能障碍者;(8)发生肝肺转移者.
1.2 方法
1.2.1 治疗方法:两组均给予靶向治疗,静脉滴注贝伐珠单抗5 mg/kg,1次/3 wk;对照组采取FOLFOX方案,第1 d静脉滴注奥沙利铂(江苏奥赛康药业有限公司,国药准字H20064296)100 mg/m2、共滴注2 h,第1 d静脉滴注亚叶酸钙(山西普德药业有限公司,国药准字H14022464)400 mg/m2、共滴注2 h,第1 d静脉注入氟尿嘧啶(上海旭东海普药业有限公司,国药准字H31020593) 400 mg/m2、随后持续滴注氟尿嘧啶2400 mg/m2,治疗2 wk后休息1 wk,共治疗4 wk.研究组在对照组基础上采取伊立替康(江苏恒瑞医药股份有限公司,国药准字H20061276),静脉滴注350 mg/m2,30-90 min内滴注完毕,1次/3 wk,共治疗4次.
1.2.2 检测方法:治疗前及治疗4周期后第2 d晨起时,在空腹状态下抽取5 mL外周静脉血,离心(3000 r/min,10 min)取上清液,置于-80 ℃环境中储存待检; 以美国Bio-RAD公司Bio-RAD550型酶标仪与配套试剂盒经酶联免疫吸附法测定血清肿瘤标志物[癌胚抗原(CEA)、糖链抗原125 (CA125)、CA199、CA72-4]及转化生长因子-α(TGF-α)、胰岛素样生长因子Ⅱ (IGF-Ⅱ)水平; 取血清标本,采用miRNA提取试剂盒(上海盈公生物技术有限公司)提取总RNA,以Taqman miRNA检测试剂盒通过实时逆转录定量聚合酶链反应检测miR-200a、miR-190,计算其相对表达量.
1.2.3 观察指标:(1)治疗4周期后统计2组肿瘤控制率,依据RECIST标准予以评估,完全缓解:原发病灶消失,且持续≥4 wk; 部分缓解:原发肿瘤病灶最大单径之和缩小>30%,且持续≥4 wk; 进展:原发肿瘤病灶最大单径之和增大>20%或有新病灶出现; 其余为稳定; 肿瘤控制率=(完全缓解+部分缓解+稳定)/总例数×100%[9];(2)统计2组治疗前后血清肿瘤标志物(CEA、CA125、CA199、CA72-4)水平; (3)统计2组治疗前后血清miR-200a、miR-190表达情况; (4)统计2组治疗前后血清TGF-α、IGF-Ⅱ水平; (5)统计2组毒副反应发生率,根据NCI标准评估,并分为Ⅰ-Ⅳ度[10]; (6)随访12 mo,统计2组生存率.
统计学处理通过SPSS 22.0对数据进行分析,计量资料(mean±SD)表示,t检验,计数资料n(%)表示,χ2检验,P<0.05表示差异有统计学意义.
2 结果
2.1 肿瘤控制率 研究组肿瘤控制率(71.74%)与对照组(65.22%)间无显著差异(P>0.05).见表2.
2.2 血清肿瘤标志物 治疗前2组血清CEA、CA125、CA199、CA72-4水平间无显著差异(P>0.05),治疗后研究组血清CEA、CA125、CA199、CA72-4水平低于对照组(P<0.05).见表3.
2.3 血清miR-200a、miR-190表达情况 治疗前2组血清miR-200a、miR-190表达间无显著差异(P>0.05),治疗后研究组血清miR-200a、miR-190表达高于对照组(P<0.05).见表4.
2.4 血清TGF-α、IGF-Ⅱ水平 治疗前2组血清TGF-α、IGF-Ⅱ水平间无显著差异(P>0.05),治疗后研究组血清TGF-α、IGF-Ⅱ水平低于对照组(P<0.05).见表5.
2.5 毒副反应发生率 2组均未发生Ⅳ度毒副反应,且研究组血红蛋白减少、胃肠道反应、呕吐恶心、骨髓抑制、中性粒细胞减少发生率与对照组相比无明显差异(P>0.05).见表6.
2.6 生存率 随访期间研究组、对照组各失访1例,研究组治疗后6 mo、9 mo、12 mo生存率(95.56%、88.89%、80.00%)与对照组(91.11%、75.56%、64.44%)间无显著差异(P>0.05).见表7、图1.
3 讨论
CRC发病率高,且可通过淋巴及血液循环等途径播散至其他器官组织,且若患者未及时得到有效干预,则可进展至中晚期,出现腹水、肝脏肿大、全身无力、贫血等诸多反应[11,12].因此,如何对CRC患者实施安全有效治疗仍是研究热点.

表1 2组一般资料比较

表2 2组肿瘤控制率比较[n (%)]

表3 2组血清肿瘤标志物水平比较(mean±SD)
贝伐珠单抗为晚期CRC重要靶向治疗药物,为重组人源化单克隆抗体,可对肿瘤新生血管生成予以抑制,影响内皮细胞增殖,可以血管内皮生长因子为靶点,和内源性血管内皮生长因子竞争性结合于血管内皮生长因子受体,阻止内皮细胞有丝分裂,促使现有肿瘤血管退化,减少新生血管生成,阻断肿瘤生长所需氧气、血液、其他营养供给,限制肿瘤生长,使存活肿瘤血管趋化正常.FOLFOX化疗在CRC中较常用,其中奥沙利铂属新型铂类抗肿瘤药物,可对DNA合成予以抑制,产生抗肿瘤作用及细胞毒作用; 氟尿嘧啶静脉注入机体后通过人体代谢酶作用,能转化为可抑制DNA合成的核苷酸,其能有效阻止肿瘤细胞分裂增殖; 而亚叶酸钙则可进一步增强氟尿嘧啶抗肿瘤活性[13].但FOLFOX化疗方案在CRC中整体效果不佳,李玉梅等[14]研究指出,贝伐珠单抗及西妥昔单抗等靶向治疗药物联合化疗对CRC患者实施治疗,可有效延长患者生存期限,但靶向治疗药物较昂贵,导致其临床应用存在一定局限性,无法广泛普及应用.伊立替康在恶性肿瘤中也较常用,其属半合成可溶性喜树碱衍生物,其可通过拓扑异构酶Ⅰ与DNA形成的复合体稳定结合,造成DNA单链断裂,导致DNA发生不可逆性损伤,最终造成细胞凋亡[15].本研究联合FOLFOX化疗方案及伊立替康对我院CRC患者实施治疗后发现,研究组总有效率略高于对照组,但血清肿瘤标志物水平低于对照组,且毒副反应发生率组间比较无显著差异,表明FOLFOX化疗方案及伊立替康联合治疗CRC可更有效下调血清肿瘤标志物水平,利于改善疾病治疗效果.分析其原因主要在于:奥沙利铂可通过水化衍生物作用于DNA,造成链间和链内交联,阻止DNA合成,但大剂量应用可引发诸多毒副反应,而联合氟尿嘧啶不仅能减少全身毒性作用,且可提升癌细胞中药物浓度; 氟尿嘧啶为核糖核酸重要组成部分,可抑制脱氧核糖鸟苷酸中胸苷酸合成酶转化,抑制DNA合成[16].而伊立替康水溶性较好,经机体代谢后,其与活性代谢物7-乙基-10羟基喜树碱可结合于DNA拓扑异构酶Ⅰ形成复合物,最终促使肿瘤细胞凋亡,达到治疗目的[17].同时,在静止及增生肿瘤细胞内拓扑异构酶Ⅰ含量增高,因此伊立替康对迅速生长及相对缓慢的肿瘤细胞杀伤效果均较好[18].

表4 2组血清miR-200a、miR-190表达比较(mean±SD)

表5 2组血清TGF-α、IGF-Ⅱ水平比较(mean±SD,ng/mL)
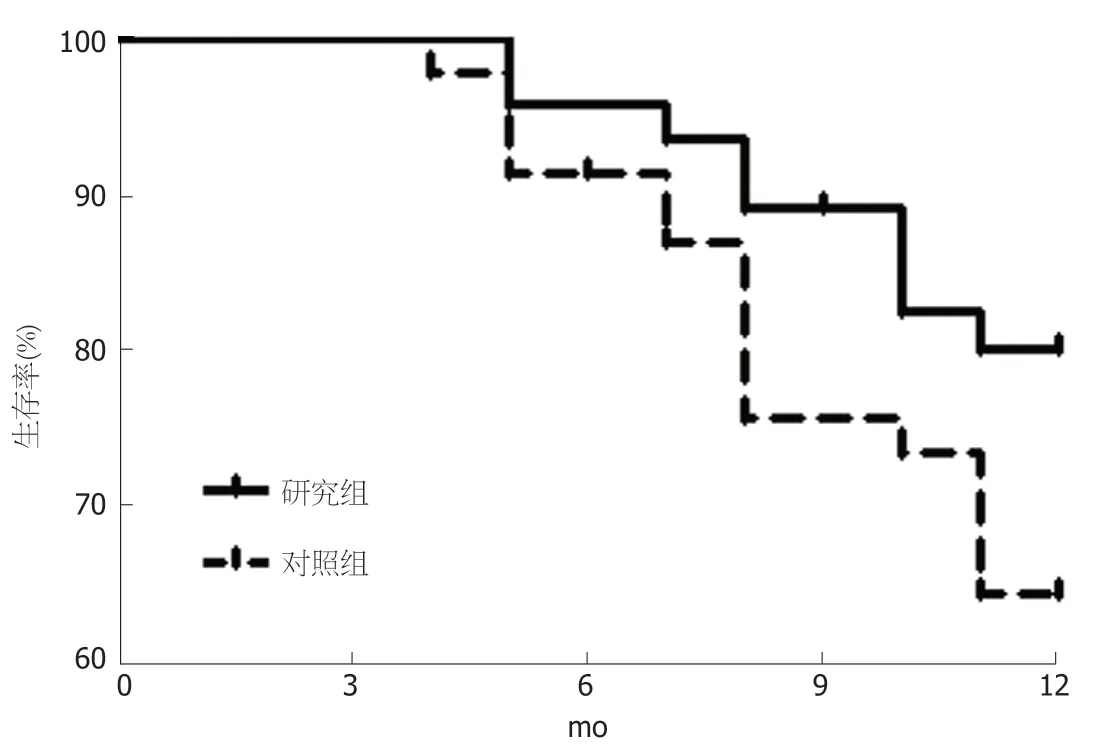
图1 2组生存情况.
近年来,miRNA成为肿瘤研究热点,其可经信使RNA降解或沉默蛋白翻译,在细胞凋亡、增殖和肿瘤发生等过程中发挥治疗作用,且miRNA失调涉及肿瘤分化及增殖、侵袭、迁移、凋亡等[19].miR-200a、miR-190可于脑脊液、尿液、血液内检出,具有较高稳定性,可作为血清肿瘤标志物,其中miR-190可降低VEGF表达,阻止肿瘤新生血管生成,从而抑制肿瘤生长,且可降低CRC细胞内DPC4基因表达,产生负向调控,发挥抑癌基因作用; 而miR-200a为miR-200家族重要成员,其能对癌细胞侵袭、增殖、转移发挥重要作用[20].此外,IGF-Ⅱ为多肽类生长因子,其结构与胰岛素具有一定相似性,可特异性结合于受体,抑制细胞中信号传导,避免肿瘤细胞凋亡,且能促进细胞有丝分裂,可有效促使肿瘤细胞分化及增殖; TGF-α为表皮生长因子(EGF)家族成员,其能发挥类似EGF的生理学活性,即活化原癌基因与转录因子,加快细胞膜信号传导,并参与肿瘤细胞分化、增殖,且TGF-α能强化肿瘤细胞活动,活化致癌通路,触发上皮间质转化,促进病灶转移、浸润[21].本研究对上述指标水平治疗前后变化情况进行统计分析发现,治疗后研究组血清miR-200a、miR-190表达高于对照组,血清TGF-α、IGF-Ⅱ水平低于对照组,进一步证实FOLFOX化疗方案联合伊立替康在CRC中具有较高应用价值,可降低血清TGF-α、IGF-Ⅱ水平,上调miR-200a、miR-190表达,且其可能为该联合治疗方案能改善CRC治疗效果的重要机制之一.另由本研究结果还可得知,治疗后研究组生存率高于对照组,但无显著差异,可能与样本量较少具有关联性,因此本研究存在一定不足,仍需临床进一步证实.

表6 2组毒副反应发生率比较[n (%)]
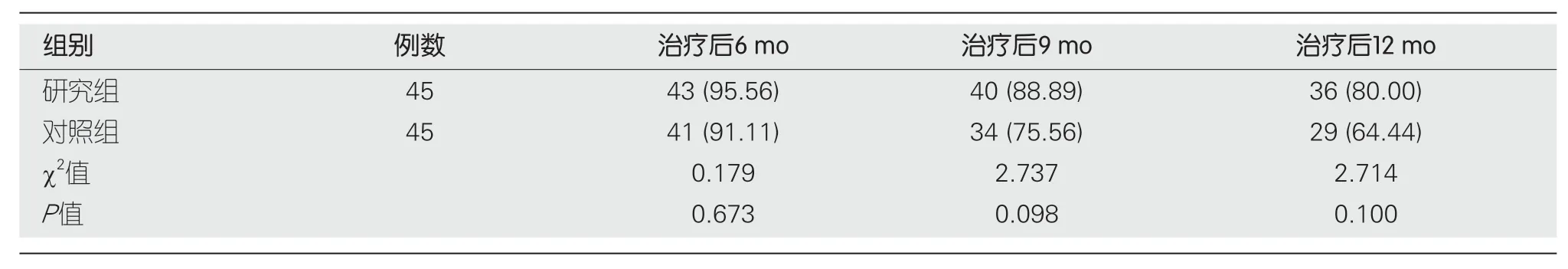
表7 2组生存率比较[n (%)]
4 结论
综上所述,联合采取FOLFOX化疗方案及伊立替康治疗CRC,可下调血清肿瘤标志物及TGF-α、IGF-Ⅱ水平,增高miR-200a、miR-190表达,且不会增加毒副反应发生风险.
文章亮点
实验背景
结直肠癌在消化道恶性肿瘤中发病率较高,传统的化疗方案FOLFOX的治愈周期长,复发率较高,同时靶向药物治疗成本高,受基因变异影响较大,不适宜大多数患者.化疗药物的联合治疗方案探索目前成为研究的热点,药物之间起到互补的作用,增强治疗的效果.
实验动机
中晚期的结直肠癌患者离不开化疗药物和靶向药物的治疗.由于靶向药物的局限性,无法广泛普及应用,化疗仍是主要的治疗手段.传统的化疗手段虽然比较经典,但是依然存在较高的复发率,伊立替康可以促进肿瘤细胞的凋亡,抑制其生长,与经典的化疗手段FOLFOX相结合对清除和抑制细胞具有共进互补的作用.为传统的化疗提供新的治疗方案.
实验目标
本研究的主要目标是探讨伊立替康辅助FOLFOX化疗方案在结直肠癌中应用价值.实现了仅依靠传统治疗方式的改善,为延长结肠癌患者生存期以及生活质量具有进一步的意义.
实验方法
本研究主要采用伊立替康辅助疗法与FOLFOX化疗方案的对比,通过检测、观察、数据分析等研究方法,对比说明辅助化疗相对于FOLFOX化疗方案在结直肠癌治疗中的优势.
实验结果
在肿瘤控制率、毒副反应发生率和12个月生存率等指标中,2组之间并无统计学意义上的差异.但是治疗后,研究组血清CEA、CA125、CA199、CA72-4、TGF-α、IGF-Ⅱ水平低于对照组,同时miR-200a、miR-190表达高于对照组.
实验结论
联合采取FOLFOX化疗方案及伊立替康治疗结直肠癌,可下调血清肿瘤标志物及TGF-α、IGF-Ⅱ水平,增高miR-200a、miR-190表达,且不会增加毒副反应发生风险.
展望前景
本研究中除了血清中的几个灵敏的指标有差异外,生存率和肿瘤控制率并无显著差异,分析原因可能与样本量较少和生存时间较短有关,因此本研究将有待于进一步扩大样本量,延长回访的时间,来进行更加深入的验证.
