慢病毒sh-SIRT1 载体对乳腺癌细胞增殖、迁移和侵袭的影响
2021-04-08李新,田蜜,王程
李 新,田 蜜,王 程
(1.荆门市第二人民医院甲乳外科,湖北 荆门 448000;2.荆门市公安局法医鉴定中心,湖北 荆门 448000)
乳腺癌(breast cancer)是女性最常见的恶性肿瘤,严重影响女性身心健康[1-3]。据统计[4,5],世界乳腺癌发病率呈上升趋势,我国乳腺癌发病率的增长速度高于世界平均增长速度。近年来随着分子靶向治疗在乳腺癌中的作用越来越受到研究者重视,基因靶向治疗已逐渐成为乳腺癌研究热点[6,7]。沉默信息调节因子1(SIRT1)是Sirtuin 家族的第一个成员,参与肿瘤等多种疾病的发生,影响疾病的发展和耐药性[8-10]。研究表明[11],siRNA-SIRT1 干扰宫颈癌细胞SIRT1 的表达,可抑制宫颈癌细胞的迁移能力;另有研究发现[12],顺铂联合siRNA-SIRT1 可降低宫颈癌细胞耐药基因的表达水平,从而提高宫颈癌细胞对顺铂的敏感性。因此,本研究通过构建SIRT1 基因的shRNA 慢性病毒载体,观察SIRT1 在乳腺癌细胞中的表达变化,探讨SIRT1 在乳腺癌中的作用及机制,现报道如下。
1 资料与方法
1.1 一般资料 收集2017 年1 月~2019 年12 月荆门市第二人民医院确诊的80 例乳腺癌患者的癌组织及癌旁正常组织。纳入标准:符合乳腺癌的诊断标准[13];排除标准:精神病患者;患有其他肿瘤;有手术、化疗、放疗或抗生素治疗史的患者及不配合治疗者。
1.2 方法
1.2.1 细胞培养和转染 乳腺癌细胞株[MDA-MB-2 31(BNCC337893)、SK-BR-3(BNCC100524)]和人正常乳腺细胞[MCF10A(BNCC100439)]均从Bena 培养库中购买,在37 ℃5%CO2的细胞培养箱中培养细胞。乳腺癌细胞系的培养基体系为1640 培养基(Hyclone 公司)+10%胎牛血清溶液(Gibco 公司)+1%青霉素/链霉素溶液(100X,Solarbio 公司),MCF-10A 细胞系的培养体系为DMEM 培养基(Hyclone公司)+10%胎牛血清溶液(Gibco 公司)+1%青霉素/链霉素溶液(100X,Solarbio 公司)。随后实验将在细胞培养密度达到80%~90%后进行,转染前1 d,采用无血清培养基代替完全培养基,转染时将1×105细胞/孔的细胞接种到6 孔板上。用Lipofectamine 2000 转染试剂盒(Invitrogen,USA)转染细胞株,转染4~6 h 后,换成新鲜培完全培养基。在乳腺癌细胞系中表达sh-SIRT1 后,观察乳腺癌细胞增殖、迁移和侵袭的影响。
1.2.2 慢性病毒空载体的包装及病毒滴度的测定 从Gen -Bank 中查找 SIRT1 基因的序列(NM 001033578.2),给人类SIRT1 基因设计一个特殊的sh-RNA 序列,阴性对照(NC)作为对照。利用北京Berry 基因组学构建SIRT1 基因的shRNA 慢性病毒表达载体,并采用克隆PCR 法筛选重组克隆进行比对鉴定。将绿色荧光蛋白(GFP)与慢性病毒包装质粒共转染MDA-MB-231 和SK-BR-3 细胞。转染1 d后,改变培养基,培养2 d 后,收集慢性病毒浓缩液感染的MDA-MB-231 和SK-BR-3 细胞,荧光显微镜下观察GFP 表达,评价病毒感染效率。另采用含10% FBS、100 U/ml 青霉素和100 U/ml 链霉素的DMEM 培养基,用常规液体交换法传代感染SIRT1-shRNA 慢性病毒的SK-BR-3 和MDA-MB-231 细胞。将细胞移植到6 孔板中,每孔2×105个细胞。第2 天,当细胞生长密度达到50%左右时,在细胞培养液(10% FBS、4 μg/ml 多胺)中感染相应滴度的病毒溶液。
1.2.3 定量聚合酶链反应(qPCR)采用Trizol 纯化组织或细胞的总RNA。用总外显子RNA 和蛋白质分离试剂盒(货号4478545,Invitrogen)纯化外显子总RNA。用紫外分光光度计在260~280 nm 处检测总RNA 的浓度和纯度,选择OD260/OD280>1.8 进行qPCR 检测。采用Fast-King 一步反转录荧光定量试剂盒(北京天根公司,产品目录号FP314)和ABIPRISM 7000(美国应用生物系统公司)对总RNA 进行反转录、PCR 扩增和荧光定量。SIRT1 和mRNA引物由上海桑根生物科技有限公司设计合成。反应体系严格按照试剂盒说明书(50 μl)进行:上下游引物1.25 μl,探针1.0 μl,RNA 模板10 μg,50×ROX 参比染料ROX 5 μl,50 μl 总反应体系中加入无RNase dd H2O。反应过程:50 ℃反转录30 min;95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸1 min,40 个循环。结果用ABI 棱镜7000仪器进行分析,观察SIRT1 在乳腺癌组织或细胞系中的基因表达水平。采用类似的方法[14],用qPCR 的方法检测乳腺癌组织和癌旁组织中SIRT1 的表达,癌组织中SIRT1 的表达大于癌旁组织的平均值一倍以上视为高表达,其余认为是低表达,内参基因为GAPDH。
1.2.4 免疫印迹 收集细胞裂解液,以1,2000 r/min离心15 min。取上清液,SDS-PAGE 电泳分离蛋白。将蛋白质转移到NC 膜上,在室温下放置1 h(用5%脱脂牛奶溶液封闭)。加入SIRT1、α-catenin、PTEN、E -cadherin、N -cadherin、β -catenin、Vimentin 和GAPDH 等抗体,放置在4 ℃下过夜。用PBST 溶液清洗NC 膜3 次,加入相应二抗(HRP 交联),室温孵育1 h。最后,用PBST 溶液清洗NC 膜,并用增强化学发光法进行可视化处理。内参蛋白为GAPDH,待测蛋白的相对表达水平=待测条带的灰度值/GAPDH 条带的灰度值,观察SIRT1 蛋白及ECT 相关蛋白在乳腺癌组织或细胞系中的表达水平。
1.2.5 细胞迁移和侵袭 采用胰蛋白酶酶解法制备细胞悬液。将细胞接种于2×104细胞/孔的移行上腔(含200 μl 10%胎牛血清+1% DMEM 培养基),并将DMEM 培养基(含10%胎牛血清,总体积500 μl)加入下腔。细胞培养24 h 后,取上腔液,擦去腔壁细胞。用4%的多聚甲醛固定细胞20 min。0.1%结晶紫染色10 min,PBS 缓冲液洗涤。在200 倍显微镜下采集细胞迁移图像。随机选取5 个视野计算细胞数,取平均值作为细胞数,实验重复3 次。在上述步骤上,用8%的基质胶铺贴用于侵袭实验,每孔细胞数增加到5×104个,观察sh-SIRT1 在乳腺癌细胞中的转移能力。
1.2.6 MTT 法检测细胞活性 用胰蛋白酶酶解法对细胞进行消化,将细胞离心除去酶液,加入新鲜培养基,吹制细胞悬液。取4 个96 孔板,按每孔5×103孔/100 μl 的规格接种细胞,每组3 孔。每24 h 取一孔板,加入5 mg/ml MTT 溶液10 μl/孔,继续培养1 h,取出培养基,用酶标仪在570 nm 处测定OD 值。实验重复3 次,观察细胞活性-时间曲线,分析sh-SIRT1 在乳腺癌细胞中的增殖能力。
1.3 统计学方法 数据采用SPSS 20.0 统计软件进行处理。计数资料以(n)表示,采用χ2检验;计量资料以()表示,组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05 表示差异有统计学意义。
2 结果
2.1 SIRT1 在乳腺癌中的表达情况 SIRT1 在乳腺癌中呈高度表达,癌旁组织中呈低表达;与人乳腺上皮细胞(MCF-10A)相比,乳腺癌细胞系(MDA-MB-231、SK-BR-3)中SIRT1 的基因表达增加,见图1。
2.2 SIRT1 表达与临床特征的关系 不同年龄、吸烟行为、酗酒行为间SIRT1 表达比较,差异无统计学意义(P>0.05);不同T 分期、N 分期、M 分期间SIRT1表达比较,差异有统计学意义(P<0.05),见表1。

图1 SIRT1 在乳腺癌中的表达情况
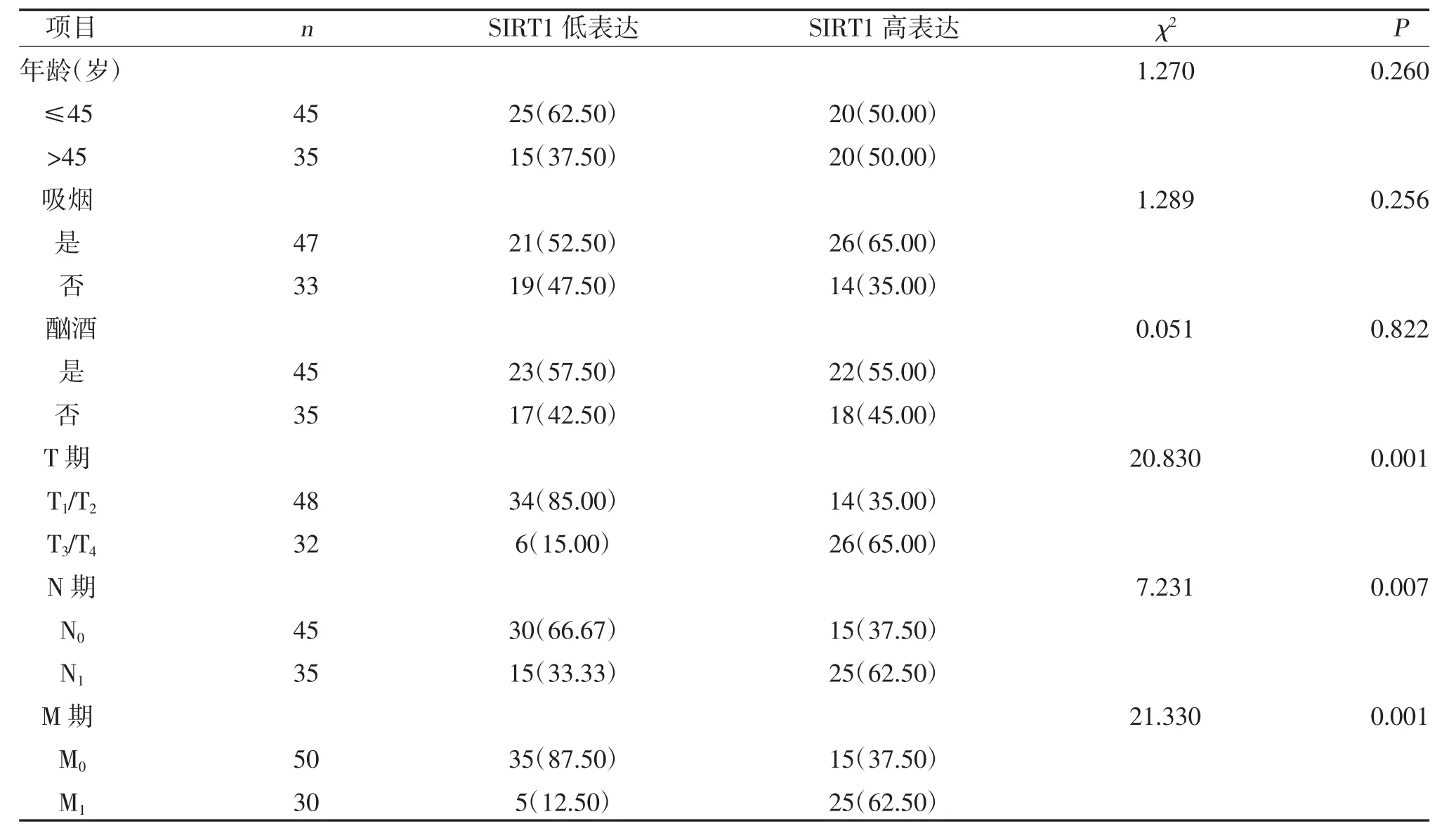
表1 SIRT1 表达与临床特征的关系[n(%)]
2.3 构建慢病毒载体sh-SIRT1 细胞系 在MDAMB-231 细胞系和SK-BR-3 细胞系中构建了sh-SIRT1 的慢病毒表达体系;qPCR 和Western Blot 检测发现,构建的两个细胞系中SIRT1 基因水平和蛋白水平表达均明显下降,见图2。

图2 构建sh-SIRT1 的慢病毒表达细胞系
2.4 sh-SIRT1 对乳腺癌细胞的增殖、迁移和侵袭的影响 MTT 法检测显示,在MDA-MB-231 细胞和SK-BR-3 细胞中sh-SIRT1 可抑制乳腺癌细胞的增殖(图3)。Transwell 法检测显示,在MDA-MB-231细胞中sh-SIRT1 可抑制乳腺癌细胞的迁移和侵袭(图4)。
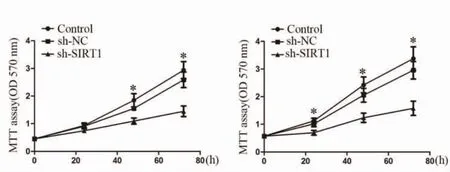
图3 sh-SIRT1对乳腺癌细胞的增殖、迁移和侵袭的影响
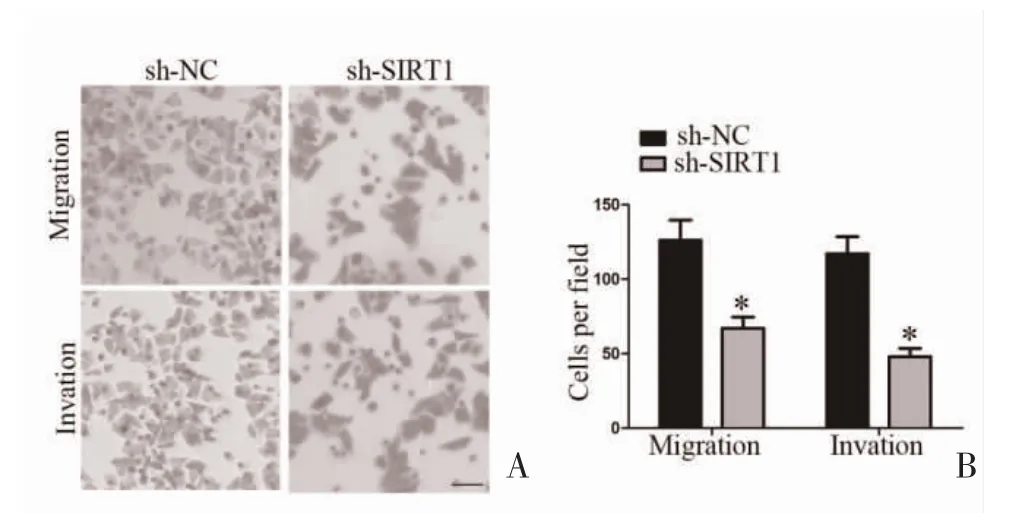
图4 sh-SIRT1 对MDA-MB-231 细胞迁移和侵袭的影响
2.5 sh-SIRT1 对乳腺癌细胞EMT 过程的影响Western Blot 检测显示,sh-SIRT1 可抑制α-catenin、PTEN 和E-cadherin 表达下调(图5A),促进N-cadherin、β-catenin 和Vimentin 表达上调(图5B)。
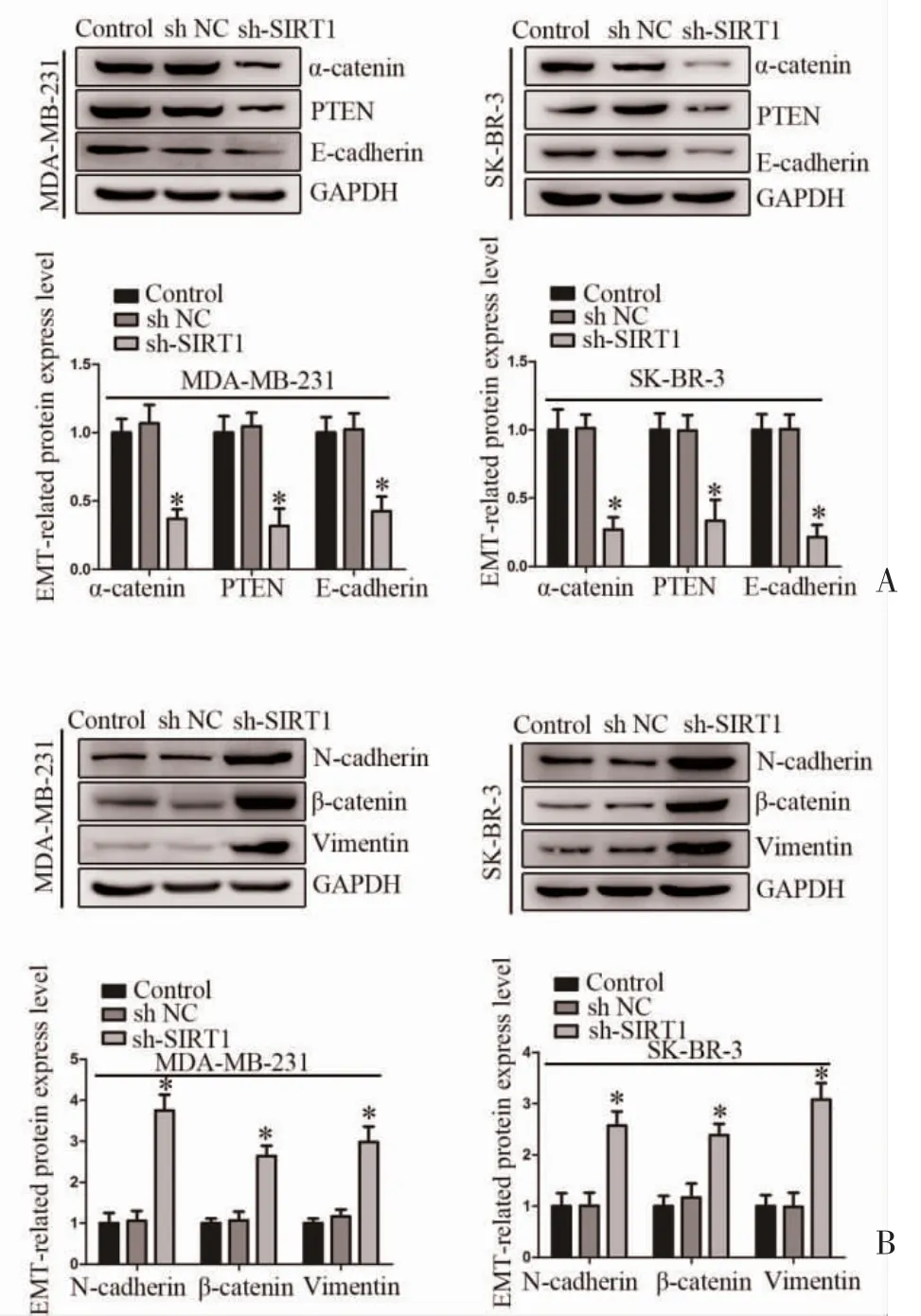
图5 sh-SIRT1 对乳腺癌细胞EMT 的影响
3 讨论
慢性病毒载体是目前最适合体内基因转化甚至基因治疗的载体工具[15,16]。研究表明[17],慢性病毒载体是在免疫缺陷病毒的基础上发展起来的一种基因治疗载体,属于自杀病毒。慢性病毒载体能产生表达shRNA 的高滴度病毒,诱导基因表达的稳定功能沉默,成为沉默细胞基因,其介导的RNA 干扰技术对基因治疗的发展具有重要意义[18,19]。
本研究结果发现,SIRT1 基因在乳腺癌组织中呈高表达,在乳腺癌细胞系SK-BR-3 和MDA-MB-231 中也呈高表达,表明SIRT1 在乳腺癌中上调。此外,通过对80 例乳腺癌患者临床特征进行分析,结果发现SIRT1 在T3/T4、N1和M1中高表达,而与年龄、吸烟和酗酒无相关关系,这也提示SIRT1 参与了乳腺癌的转移进展过程。此外,本研究成功构建了慢病毒载体sh-SIRT1 细胞系,并发现sh-SIRT1 可以抑制乳腺癌细胞的增殖、迁移和侵袭,这与SIRT1在乳腺癌的发病与转移中具有高表达相一致。SIRT1 是一个组蛋白脱乙酰化酶家族,参与不同细胞中各种蛋白质的乙酰化修饰[20]。有研究表明[21],SIRT1 通过调节谷氨酰胺代谢,抑制细胞生长、增殖和转化,从而发挥其促癌作用。另有研究表明,SIRT1 通过乙酰化细胞核中的靶蛋白改变细胞活性并影响其细胞内功能[22],恶性肿瘤的侵袭转移与SIRT1 表达的上调密切相关,SIRT1 下调会抑制肝癌和卵巢癌细胞的生长[23],与胰腺癌[24]、肝癌[25]和肺癌[26]等均密切相关。Wu SH 等[27]研究表明,shRNA 慢性病毒载体对CCR3 基因表达的抑制作用可以有效地减少肥大细胞在局部组织中的迁移、浸润和脱颗粒,减轻变应性鼻炎小鼠的炎症反应。本研究通过建立shRNA 慢病毒载体进一步补充了SIRT1 对乳腺癌细胞的生物学功能。同时,通过shRNA 慢病毒载体干扰SK-BR-3 和MDAMB-231 细胞中SIRT1 的表达,观察了sh-SIRT1 对乳腺癌细胞EMT 过程的影响,结果表明EMT 相关蛋白α-catenin、PTEN 和E-cadherin 在乳腺癌细胞中出现表达下调,N-cadherin、β-catenin 和Vimentin 出现表达上调,这为SIRT1 参与乳腺癌的发生发展及转移提供了依据。研究报道[28,29],SIRT1 的mRNA 和蛋白水平降低,从而抑制EMT 并影响EMT 相关分子,包括PTEN 和E-cadherin。Qi HF 等[30]通过双荧光素酶报告基因检测证实了SIRT1 是miR-448 的直接靶点,激活SIRT1 将逆转miR-448 模拟物诱导的非小细胞肺癌细胞EMT 生长抑制能力,并起到破坏作用。以上结果表明,慢病毒sh-SIRT1 干扰SIRT1 表达,αcatenin、PTEN、E-cadherin 等细胞间聚集的粘附分子表达水平上调,最终抑制乳腺癌细胞EMT 的增殖。慢病毒sh-SIRT1 干扰SIRT1,会抑制乳腺癌细胞的增殖、迁移和侵袭。然而,本研究中SIRT1 慢病毒载体与乳腺癌细胞增殖的关系只是初步研究,在未来的实验设计中SIRT1 所涉及的信号通路可以作为SIRT1 致癌网络的补充。
综上所述,SIRT1 在乳腺癌细胞中高表达,慢病毒sh-SIRT1 载体可抑制乳腺癌细胞的增殖、迁移和侵袭。因此,SIRT1 基因shRNA 慢病毒载体在乳腺癌靶向治疗中具有潜在的应用价值。
