剖宫产术后子宫瘢痕妊娠宫腔镜治疗结局的影响因素分析
2021-04-08刘航
刘 航
(成都西区医院 妇科, 四川 成都 614000)
剖宫产术后子宫瘢痕妊娠(cesarean scar pregnancy,CSP)指孕早期(<12周)妊娠囊着床或部分着床于前次子宫剖宫产瘢痕处,是异位妊娠的一种特殊类型[1]。由于子宫瘢痕处组织薄弱,收缩能力差,因此极易发生子宫破裂、大出血,是剖宫产术后潜在的严重并发症之一[2]。
近年来,随着我国二胎政策的开放,CSP的发病率呈逐年上升趋势。据不完全统计,截止到2019年,我国的CSP发病率达5/10 000[3],占所有异位妊娠的6.1%。CPS在临床上确诊后,原则上需终止妊娠,且避免期待治疗和盲目刮宫。目前,CSP的治疗方式主要有药物、宫腔镜下子宫瘢痕妊娠切除、腹腔镜下子宫瘢痕妊娠切除、传统开腹子宫瘢痕妊娠切除等。相对于其他治疗方式,宫腔镜下子宫瘢痕妊娠切除能够直视子宫瘢痕妊娠周围组织,可以准确的剥离孕囊,降低了子宫穿孔和大出血的风险,最大限度地保留了患者的生育功能[4]。但是,目前宫腔镜治疗CSP失败的病例时有发生。对此,本研究拟对我院采用宫腔镜治疗CSP的病例进行回顾性分析,以期筛选出CSP宫腔镜治疗结局的影响因素,为临床治疗提供参考。
1 资料与方法
1.1 对象
选取2015年1月~2019年12月于我院妇产科采用宫腔镜治疗的CSP患者204例。纳入标准:①符合CSP诊断标准[5],即具有剖腹产史,已停经,尿β-人绒毛膜促性腺激素(human chorionic gonadotropin,β-hCG)呈阳性,经超声检查宫腔内及宫颈管未见妊娠囊,子宫下段剖宫产切口处可见孕囊附着,子宫前壁瘢痕处子宫肌层连续性中断、变薄,血流显像提示包块或低速血流信号,且CSP分型为Ⅰ型或Ⅱ型;②患者术前知情多种治疗方式,经比较后优先选择宫腔镜术者;③生命体征平稳,血流动力学稳定者;④确诊CSP后,未接受其它方式治疗者。排除标准:①患有心、肝、肾等严重疾病者;②存在血小板<100×109/L、凝血酶原时间>16 s等凝血功能指标异常者。
宫腔镜治疗CSP失败的标准:①术中宫腔镜不能完全切除病灶组织,或出血>200 mL,止血困难,或子宫穿孔等情况下中转其它方式治疗者;②术后血β-hCG复升者;③术后超声复查提示残留者。
1.2 方法
收集所有CSP患者的年龄、妊娠次数、剖宫产次数、流产次数、孕周、距离上次剖宫产时间、术前β-hCG水平、孕囊直径、子宫瘢痕处肌层厚度、子宫动脉收缩期峰值血流速度(peak systolic velocity,PSV)、子宫动脉血管阻力指数(resistance index,RI)等资料。根据宫腔镜术治疗的结局,将入选的204例患者分为手术成功组(n=173)和手术失败组(n=31)。
1.3 统计学处理
采用SPSS 21.0处理数据。计量资料以均数±标准差表示,组间比较采用独立样本t检验,计数资料以n(%)表示,组间比较采用卡方检验。采用受试者工作曲线(receiver operator characteristic curve,ROC)确定指标的临界分类点。采用二分类Logistic回归分析CSP宫腔镜术治疗结局的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 宫腔镜治疗CSP患者的一般资料
本研究纳入的204例患者中,年龄28~41岁,均为单胎妊娠;104例妊娠2次,100例妊娠3次;148例有1次剖宫产史,56例有2次剖宫产史;此次发病距离上次剖宫产时间为1.2~8.7年;孕周为40~74 d,术前β-hCG为33 258.73~56 829.81 mIU/mL,孕囊直径2.64~4.63 cm,子宫瘢痕处肌层厚度0.21~0.42 cm,子宫动脉PSV 34.26~85.53 cm/s,子宫动脉RI 0.27~0.54。204例患者中,CSP Ⅰ型128例,占62.75%,Ⅱ型76例,占37.25%。
2.2 CSP宫腔镜治疗结局的单因素分析
CSP宫腔镜治疗成功组与失败组的年龄、妊娠次数比较,差异无统计学意义(P>0.05)。与手术失败组相比,成功组的剖宫产次数更少、孕周更短、术前β-hCG、孕囊直径和子宫动脉PSV均更低,距离上次剖宫产时间更长、子宫瘢痕处肌层更厚、子宫动脉RI更高,差异均具有统计学意义(均P<0.05),见表1。
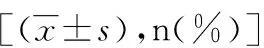
表1 CSP宫腔镜治疗结局的单因素分析
2.3 孕周、β-hCG、孕囊直径、子宫瘢痕处肌层厚度、子宫动脉PSV和子宫动脉RI的临界分类点
由于孕周、β-hCG、孕囊直径、子宫瘢痕处肌层厚度、子宫动脉PSV和子宫动脉RI均为连续变量,故分别绘制ROC曲线,以确定其临界分类点。孕周的临界分类点为53 d(AUC 95%CI:0.899~0.983),β-hCG为38 228.90 mIU/mL(AUC 95%CI:0.564~0.672),孕囊直径为3.3 cm(AUC 95%CI:0.693~0.917),子宫瘢痕处肌层厚度为0.29 cm(AUC 95%CI:0.666~0.897),子宫动脉PSV为57.3 cm/s(AUC 95%CI:0.909~0.995),子宫动脉RI为0.385(AUC 95%CI:0.864~0.970),见表2。

表2 孕周、β-hCG、孕囊直径、子宫瘢痕处肌层厚度、子宫动脉PSV和子宫动脉RI的临界分类点
2.4 CSP宫腔镜治疗结局影响因素的二分类Logistic回归分析
将CSP宫腔镜治疗的结局作为因变量(0=成功,1=失败),将表1中P<0.2的影响因素(年龄、剖宫产史、距离上次剖宫产时间、孕周、术前β-hCG、孕囊直径、子宫瘢痕处肌层厚度、子宫动脉PSV、子宫动脉RI)作为自变量进行二分类Logistic回归分析(强制纳入法)。所有自变量均设置为分类变量,其中孕周、术前β-hCG、孕囊直径、子宫瘢痕处肌层厚度、子宫动脉PSV、子宫动脉RI依据临界点分类,自变量赋值见表3。

表3 自变量赋值表
结果显示,Logistic回归模型能够将79.0%的观测正确分类(见表4)。其中,剖宫产史(2次)、孕周>53 d、术前β-hCG>38 228.90 mIU/mL、孕囊直径>3.3 cm、子宫动脉PSV>57.3 cm/s、子宫动脉RI≤0.385是CSP宫腔镜治疗失败的危险因素(均P<0.05);距离上次剖宫产时间≥5年、子宫瘢痕处肌层厚度>0.29 cm是CSP宫腔镜治疗成功的有利因素(均P<0.05)。
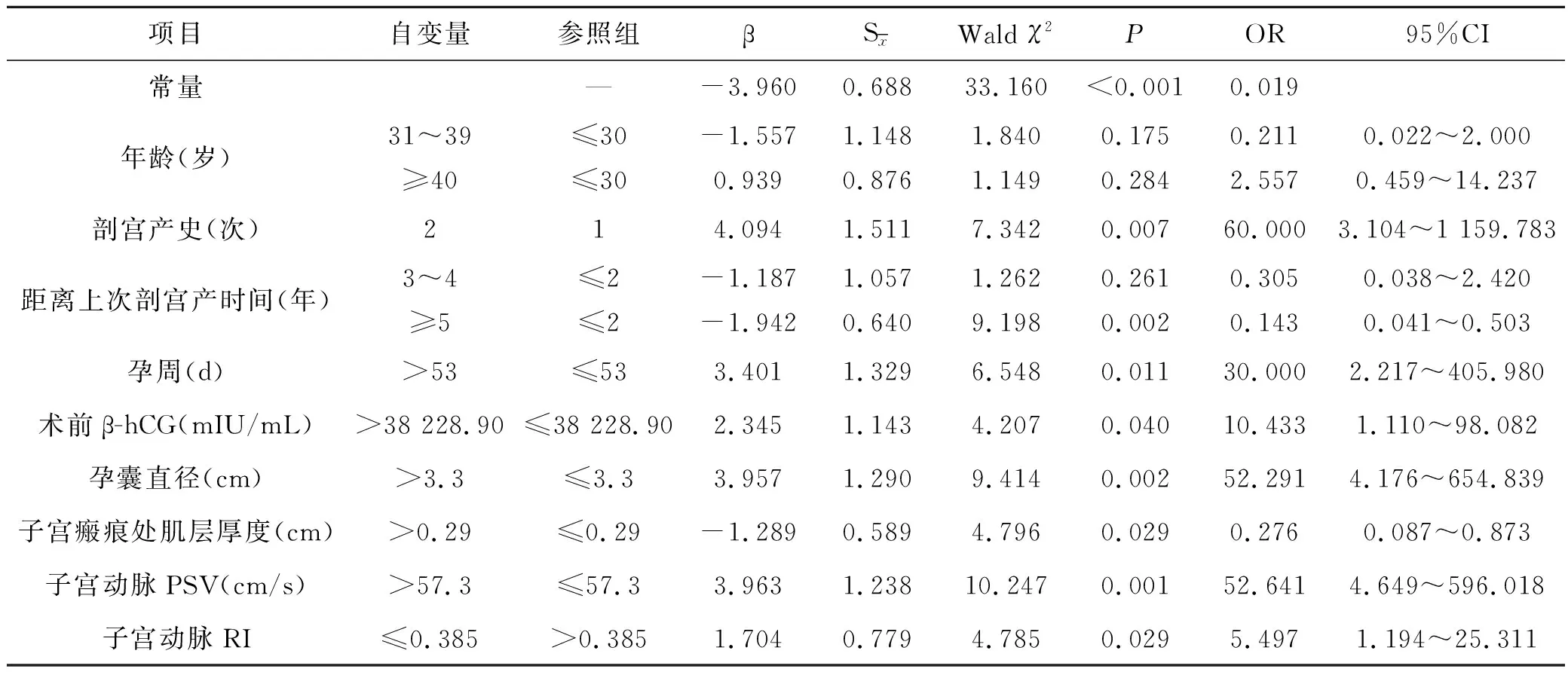
表4 CSP宫腔镜治疗结局影响因素的二分类Logistic回归分析
3 讨论
CSP作为一种特殊的异位妊娠,是一种能导致子宫破裂、大出血、丧失生育力,甚至死亡等高风险的疾病。目前认为CSP与剖宫产后子宫瘢痕恢复欠佳、宫腔内的微环境有关[6, 7]。虽然宫腔镜治疗CSP的创伤小、恢复快,但失败病例仍时有发生。对此,分析CSP宫腔镜治疗结局的影响因素,对提高宫腔镜治疗CSP的成功率具有积极意义。本研究利用单因素分析得出可能影响CSP宫腔镜治疗结局的相关因素,并利用ROC曲线分别确定相关因素的最佳临界值,提高了研究结果的可靠性。
本研究显示,剖宫产史(2次)、孕周>53 d、术前β-hCG>38 228.90 mIU/mL、孕囊直径>3.3 cm、子宫动脉PSV>57.3 cm/s、子宫动脉RI≤0.385是宫腔镜治疗CSP失败的危险因素;距离上次剖宫产时间≥5年、子宫瘢痕处肌层厚度>0.29 cm是宫腔镜治疗CSP成功的有利因素。剖宫产次数越多,瘢痕憩室形成的概率越大[8],且多次剖宫产后,憩室壁残余肌层厚度越薄[9, 10],导致宫腔镜无法修复子宫局部缺陷,甚至可能使子宫瘢痕处肌层更薄,从而导致手术失败。孕周时间越长(>53 d),滋养细胞在子宫瘢痕处深着床的可能性更大,使得孕囊周围形成丰富的新生血管,导致宫腔镜电切环不易完全清除瘢痕深处的滋养细胞,增加了手术大出血和手术失败的风险。β-hCG作为一种糖蛋白激素,β-hCG水平越高,滋养细胞的活性和数量越高[11]。PSV、RI客观上也反映了子宫瘢痕的血流丰富程度[12],瘢痕周围的血供丰富,充分清除滋养细胞的难度更大,导致宫腔镜术中出血的风险高,易造成手术失败。孕囊直径越大,覆盖瘢痕的面积越大,滋养细胞周围的新生血管侵及瘢痕肌层更深入,更易形成动静脉瘘[13],大大增加了术中出血的风险。子宫瘢痕处肌层收缩能力差,是子宫中最薄弱之处,也最易被滋养细胞侵及或穿透。距离上次剖宫产时间越长,子宫瘢痕处肌层更厚,避免了滋养细胞侵入子宫瘢痕的细胞外基质,宫腔镜术时更能彻底清扫滋养细胞,从而提高了宫腔镜治疗CSP的成功率。
综上所述,剖宫产史、孕周、β-hCG、孕囊直径、子宫动脉PSV、子宫动脉RI是CSP宫腔镜治疗结局的影响因素。临床诊疗工作中,可以根据上述指标对于CSP患者是否适宜选择宫腔镜治疗进行预测,具有一定的临床指导意义。然而本研究作为回顾性研究,样本量偏少,仍需大样本、多中心的研究进一步验证。
