藏药独一味抗类风湿关节炎的作用及其药效物质基础研究
2021-04-07张燕飞陈瑞鑫袁茂华杨枝中黄婷陈素先蒋运斌
张燕飞 陈瑞鑫 袁茂华 杨枝中 黄婷 陈素先 蒋运斌
摘 要 目的:研究藏藥独一味抗类风湿关节炎(RA)的作用及其药效物质基础。方法:将56只SD大鼠随机分为正常对照组(0.5%羧甲基纤维素钠溶液),模型组(0.5%羧甲基纤维素钠溶液),甲氨蝶呤组(阳性对照组,3 mg/kg),独一味水提液低、中、高剂量组(0.5、1、2 g/kg,以生药量计)和独一味总黄酮组(200 mg/kg,以黄酮提取物计),每组8只。除正常对照组外,其余各组大鼠均于右后足垫注射弗氏完全佐剂(FCA)复制佐剂性关节炎模型。注射FCA次日,各组大鼠灌胃相应药物,每天给药1次(仅甲氨蝶呤组每3天给药1次),连续给药30天。给药第15、30天时,分别测定大鼠左后足的足肿胀度,计算其关节炎指数。第30天给药结束后,采用酶联免疫吸附法测定各组大鼠血清中肿瘤坏死因子α(TNF-α)、 白细胞介素1β(IL-1β)、IL-6、IL-10水平,计算其胸腺指数、脾指数,并采用苏木精-伊红染色法观察各组大鼠踝关节的病理学变化。结果:与正常对照组比较,模型组大鼠给药第15、30天时的足肿胀度、关节炎指数以及给药第30天时的脾指数和血清中TNF-α、IL-1β、IL-6水平均显著升高(P<0.01);给药第30天时的胸腺指数、IL-10水平均显著降低(P<0.01);踝关节可见明显的滑膜细胞增生、浸润关节腔等病理学改变。与模型组比较,各给药组大鼠给药第15、30天时的足肿胀度、关节炎指数以及给药第30天时的脾指数和血清中TNF-α、IL-1β、IL-6水平均显著降低(P<0.01);给药第30天时的胸腺指数和血清中IL-10水平均显著升高(P<0.01);关节炎病理学变化明显改善。与独一味水提液高剂量组比较,独一味总黄酮组大鼠给药第15天时的足肿胀度以及给药第15、30天时的关节炎指数、胸腺指数、脾指数、炎症细胞因子水平、踝关节病理学变化等差异均无统计学意义(P>0.05)。结论:藏药独一味具有良好的抗RA作用,总黄酮可能是其药效物质基础。
关键词 独一味;类风湿关节炎;佐剂性关节炎;药效物质基础;总黄酮;大鼠
中图分类号 R285 文献标志码 A 文章编号 1001-0408(2021)05-0578-06
ABSTRACT OBJECTIVE:To study the effects and active ingredients of Tibetan medicine Lamiophlomis rotata against rheumatoid arthritis (RA). METHODS: Fifty-six SD rats were randomly divided into normal control group (0.5% sodium carboxymethylcellulose),model group (0.5% sodium carboxymethylcellulose), methotrexate group (positive control group,3 mg/kg), L. rotata water extract low-dose, medium-dose and high-dose groups (0.5,1, 2 g/kg,by crude drug), L. rotata total flavonoid group (200 mg/kg,by flavonoid extat), with 8 rats in each group. Except for normal control group, other groups were given Freunds complete adjuvant (FCA) on the rats right hind footpad to induce adjuvant-induced arthritis model. The next day after injection of FCA, rats in all groups were given relevant medicine intragastrically, once a day (once every 3 days for methotrexate group) for 30 days. At 15th and 30th day of administration,the degree of paw swelling of left hind foot was measured, and the arthritis index, spleen index were calculated. At the end of 30th day of administration, the levels of TNF-α, IL-1β, IL-6 and IL-10 in rat serum were determined by ELISA assay,the thymus index and spleen index were calculated, the pathological changes of the ankle joints were observed by HE staining. RESULTS: Compared with normal control group,degree of paw swelling,arthritis index at 15th and 30th day of administration as well as the spleen index and the levels of TNF-α,IL-1β,IL-6 in serum at 30th day of administration were significantly increased in model group (P<0.01); while the thymus index and IL-10 level at 30th day of administration were significantly decreased(P<0.01); synovial cell proliferation and infiltration of articular cavity were observed in ankle joint. Compared with model group,degree of paw swelling,arthritis index at 15th and 30th day of administration as well as the spleen index and the levels of TNF-α,IL-1β,IL-6 in serum at 30th day of administration were significantly decreased in each medicine group (P<0.01); while the thymus index and IL-10 level at 30th day of administration were significantly increased (P<0.01);the pathological changes of arthritis were significantly improved. Compared with L. rotata water extract high-dose group, there were no significant differences in degree of paw swelling at 15th day of administration as well as the arthritis index,spleen index ,levels of inflammatory cytokines and pathological changes of ankle joint in L. rotata total flavonoid group (P>0.05). CONCLUSIONS:Tibetan medicine L. rotata shows well anti-RA activity,and total flavonoids may be the active ingredients of its efficacy.
KEYWORDS Lamiophlomis rotata; Rheumatoid arthritis; Adjuvant-induced arthritis; Active ingredients; Total flavonoids; Rat
类风湿关节炎(Rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,病因尚不清楚,其发病机制可能与免疫紊乱、环境、遗传易感等因素相关[1],其特征是滑膜炎症和增生、自身抗体产生(如类风湿因子和抗瓜氨酸化蛋白抗体)、软骨和骨破坏以及全身性症状(包括心血管、肺、骨骼和心理疾病等)[2]。RA是一种慢性疾病,可造成患者生活质量、生理功能和心理功能等的下降,对个人和社会都造成了沉重负担[3]。而研究显示,中医药在改善RA症状、延缓RA骨破坏等方面发挥着重要作用[4]。
独一味系藏族习用药材,为唇形科植物独一味Lamiophlomis rotata (Benth.) Kudo的干燥地上部分。2020年版《中国药典》(一部)中记载,独一味具有活血止血、祛风止痛的功效,用于跌打损伤、外伤出血、风湿痹痛等[5]。目前关于独一味的研究主要集中在其活血止血的物质基础及作用机制上[6-8],而对其祛风止痛功效的研究较少。独一味祛风止痛的功效主要用于治疗风湿痹痛相关疾病,而风湿痹痛又是RA的典型特征[9]。王丽娟等[10]以足肿胀、关节炎指数、胸腺指数、肾上腺指数、足前列腺素含量为评价指标,证实了独一味能明显抑制佐剂性关节炎(AA)模型大鼠原发性和继发性病变;临床研究也表明,独一味对RA患者具有较好的临床疗效和安全性[11]。但目前还未见基于中医药整体观的独一味抗RA的药效物质基础研究报道。本课题组前期采用网络药理学技术对独一味抗RA的药效物质基础进行了预测,发现独一味黄酮类成分可能是其潜在活性成分群[12]。鉴于此,本研究基于能体现RA发病机制的大鼠AA模型,以更丰富的评价指标对独一味水提液和总黄酮的抗RA作用进行考察,为阐明独一味抗RA的药效物质基礎及其临床应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有Elx800型酶标仪(美国Bio Tek公司)、DFC310 FX型生物显微镜(德国Leica公司)、MNT-150型游标卡尺(上海美耐特实业有限公司)、EL240型分析天平(瑞士Mettler Toledo公司)和Elix型超纯水仪(美国Millipore公司)等。
1.2 主要药品与试剂
独一味药材于2018年收集于青海玉树县,经重庆三峡医药高等专科学校药学院马羚副教授鉴定为唇形科植物独一味L. rotata (Benth.) Kudo的干燥地上部分,药材标本(编号duyiwei2018.12)保存于西南大学药学院·中医药学院。弗氏完全佐剂(FCA,批号7027)购自美国Chondrex公司;甲氨蝶呤片(批号036190309,规格2.5 mg/片)购自上海上药信谊药厂有限公司;肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、IL-6、IL-10酶联免疫吸附(ELISA)检测试剂盒(批号分别为TAE-569r、TAE-370r、TAE-385r、TAE-371r)均购自天津安诺瑞康生物技术有限公司;苏木精-伊红(HE)染色试剂盒(批号C0105S)购自上海碧云天生物技术有限公司;羧甲基纤维素钠(CMC-Na)购自成都市科龙化工试剂厂;其余试剂均为分析纯,水为超纯水。
1.3 动物
本研究所用动物为健康雄性SD大鼠,共56只,5~6周龄,体质量120~140 g,购自重庆恩斯维尔生物科技有限公司[动物生产许可证号:SCXK(湘)2016-0002)]。饲养期间大鼠自由进食和饮水,予自然光照。饲养室环境温度为(22±2) ℃,相对湿度为40%~70%。大鼠适应性喂养4天后进行实验。本实验方案符合西南大学实验动物伦理审查委员会对动物伦理的要求。
2 方法
2.1 独一味水提液和总黄酮的制备
将独一味药材剪碎至0.5~2 cm长短,加5倍量(mL/g,下同)水浸泡1.5 h后,再加12倍量水煎煮提取1.5 h,过滤,收集滤液;滤渣再加12倍量水煎煮提取1.5 h,过滤,收集滤液。合并2次滤液,以80 ℃旋转蒸发仪减压浓缩至质量浓度为0.5 g/mL(以生药量计),作为母液。以0.5%CMC-Na溶液稀释母液,分别得到质量浓度为0.05、0.1、0.2 g/mL的独一味水提液(以生药量计),备用。
参考贾正平等[6]的方法制备独一味总黄酮:取适量质量浓度为0.5 g/mL的独一味水提液于烧杯中,加5倍体积水,充分搅拌后,上样于已处理好的聚酰胺色谱柱;先以水洗脱至无色,然后用70%乙醇溶液洗脱色谱柱,并收集70%乙醇洗脱液,减压浓缩,即得独一味总黄酮,得率为9.91%。根据2020年版《中国药典》(一部)独一味片中总黄酮含量测定方法[5]进行测定,结果所制独一味总黄酮样品的纯度以芦丁计为63.86%。
2.2 分组、造模与给药
将56只大鼠随机分为正常对照组,模型组,甲氨蝶呤组(阳性对照组),独一味水提液低、中、高剂量组和独一味总黄酮组,每组8只。造模前先用游标卡尺测定各组大鼠的左后足掌厚度,记为第0天的足掌厚度。除正常对照组外,其余各组大鼠均于右后足垫注射FCA 0.05 mL复制AA模型[13];正常对照组大鼠注射等体积生理盐水。注射FCA次日,阳性对照组大鼠灌胃甲氨蝶呤(3 mg/kg[14],以0.5%CMC-Na溶液为溶剂制成混悬液);独一味水提液低、中、高剂量组大鼠分别灌胃独一味水提液[0.5、1、2 g/kg(以生药量计),剂量参考2020年版《中国药典》(一部)中独一味片的临床使用剂量进行换算后制定[5]];独一味总黄酮组大鼠灌胃总黄酮提取物(200 mg/kg,以0.5%CMC-Na溶液为溶剂制成混悬液,剂量相当于独一味水提液高剂量组中黄酮类成分的量);正常对照组和模型组大鼠灌胃等体积0.5% CMC-Na溶液。仅甲氨蝶呤组大鼠每3天给药1次,其余各组大鼠均每天给药1次,给药体积均为10 mL/kg,连续给药30天。
2.3 大鼠一般情况观察
给药第15天时,观察各组大鼠的精神、活动状态和饮食、体毛色泽及关节红肿情况,并测定其体质量。根据大鼠未注射FCA的另外3只肢体的关节红肿情况判断是否造模成功[15]。
2.4 大鼠足肿胀度的测定
分别于第15、30天给药4 h后,采用游标卡尺测定各组大鼠左后足掌的厚度(mm),并计算其足肿胀度(足肿胀度=第15天或第30天的左后足掌厚度/第0天的左后足掌厚度)。
2.5 大鼠关节炎指数的测定
第15、30天给药4 h后,按5级评分法对大鼠未注射FCA的其余3只肢体的病变程度进行评分[15]:无红肿,0分;足小趾关节红肿,1分;趾关节和足趾均肿胀,2分;踝关节以下的足爪均肿胀,3分;包括踝关节在内的全部足爪红肿,4分。3只肢体评分之和即为关节炎指数。
2.6 大鼠炎症细胞因子水平的测定
第30天给药后,大鼠禁食不禁水12 h,测定大鼠体质量,观察大鼠左后足掌肿胀情况并拍照。然后腹腔注射3.5%水合氯醛(10 mL/kg)将大鼠麻醉,腹主动脉采血,在4 ℃下放置过夜,然后在4 ℃下以3 000 r/min离心10 min,取上層血清。按相应ELISA检测试剂盒说明书方法操作,分别检测血清中致炎细胞因子(TNF-α、IL- 1β、IL-6)和抗炎细胞因子(IL-10)的水平。
2.7 大鼠胸腺指数和脾指数的测定
大鼠腹主动脉采血后,立即剥离其胸腺和脾脏,用滤纸轻轻擦拭干净,称质量,计算胸腺指数和脾指数:胸腺指数=胸腺质量(mg)/体质量(g);脾指数=脾质量(mg)/体质量(g)。
2.8 大鼠踝关节病理学变化的观察
取大鼠左踝关节,以4%多聚甲醛固定,再经过脱钙、脱水、常规石蜡包埋、切片(厚度4~5 μm),行常规HE染色后,在显微镜下观察大鼠踝关节的病理学变化(包括炎症反应、滑膜增生、软骨破坏等)。
2.9 统计学方法
采用SPSS 21.0软件进行数据分析。计量资料以x±s表示,同组间不同给药时间的比较采用配对t检验;多组间比较采用单因素方差分析,方差齐者组间两两比较采用LSD法,方差不齐者组间两两比较采用Dunnetts T3法。P<0.05表示差异具有统计学意义。
3 结果
3.1 独一味水提液和总黄酮对AA模型大鼠一般情况的影响
给药第15天时,与正常对照组比较,模型组大鼠表现出精神倦怠、活动减少、食欲下降、被毛失去光泽、体质量减轻等症状,且未注射FCA的其余3只肢体均出现不同程度的关节红肿,表明造模成功。上述现象在各给药组大鼠中均有所改善。
3.2 独一味水提液和总黄酮对AA模型大鼠足肿胀度的影响
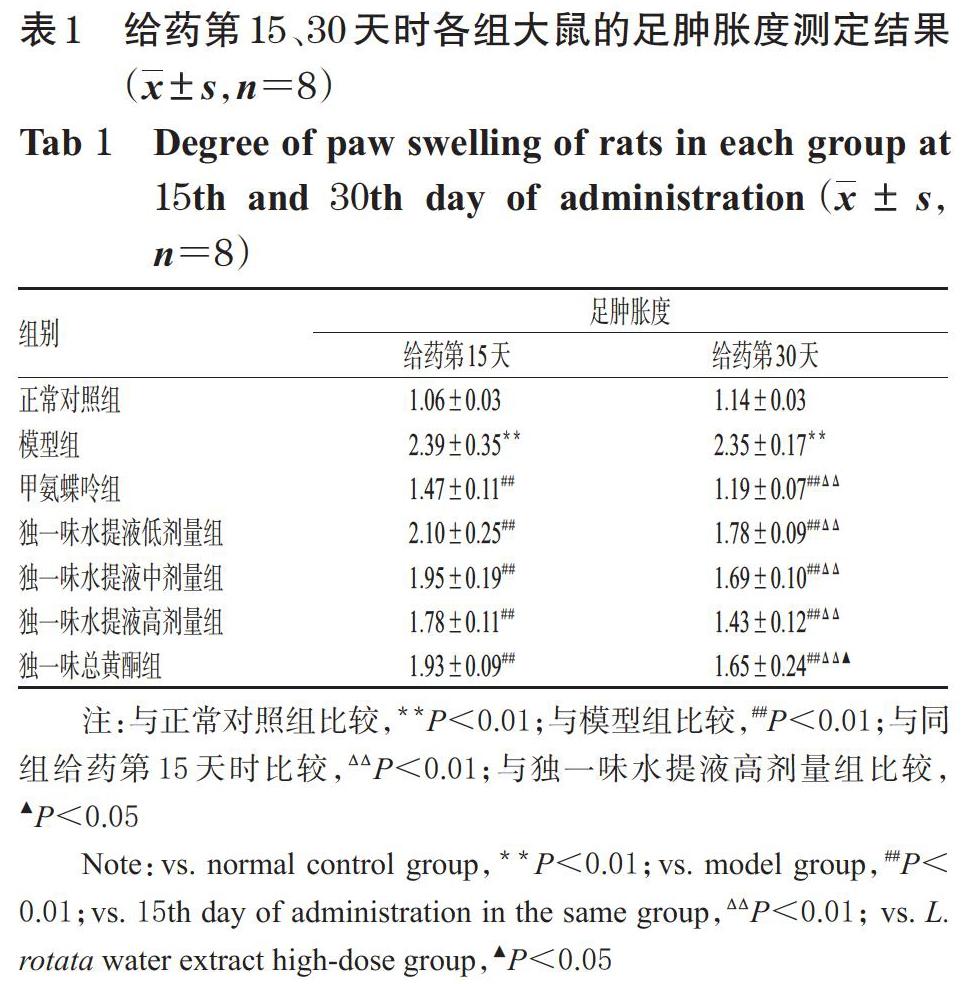
与正常对照组比较,模型组大鼠给药第15、30天时的足肿胀度均显著升高(P<0.01)。与模型组比较,各给药大鼠给药第15、30天时的足肿胀度均显著降低(P<0.01)。与同组给药第15天时比较,各给药组大鼠给药第30天时的足肿胀度均显著降低(P<0.01),而模型组差异无统计学意义(P>0.05)。与独一味水提液高剂量组比较,独一味总黄酮组大鼠给药第15天时的足肿胀度差异无统计学意义(P>0.05),但给药第30天时的足肿胀度显著升高(P<0.05)。给药第15、30天时各组大鼠的足肿胀度测定结果见表1。
3.3 独一味水提液和总黄酮对AA模型大鼠关节炎指数的影响
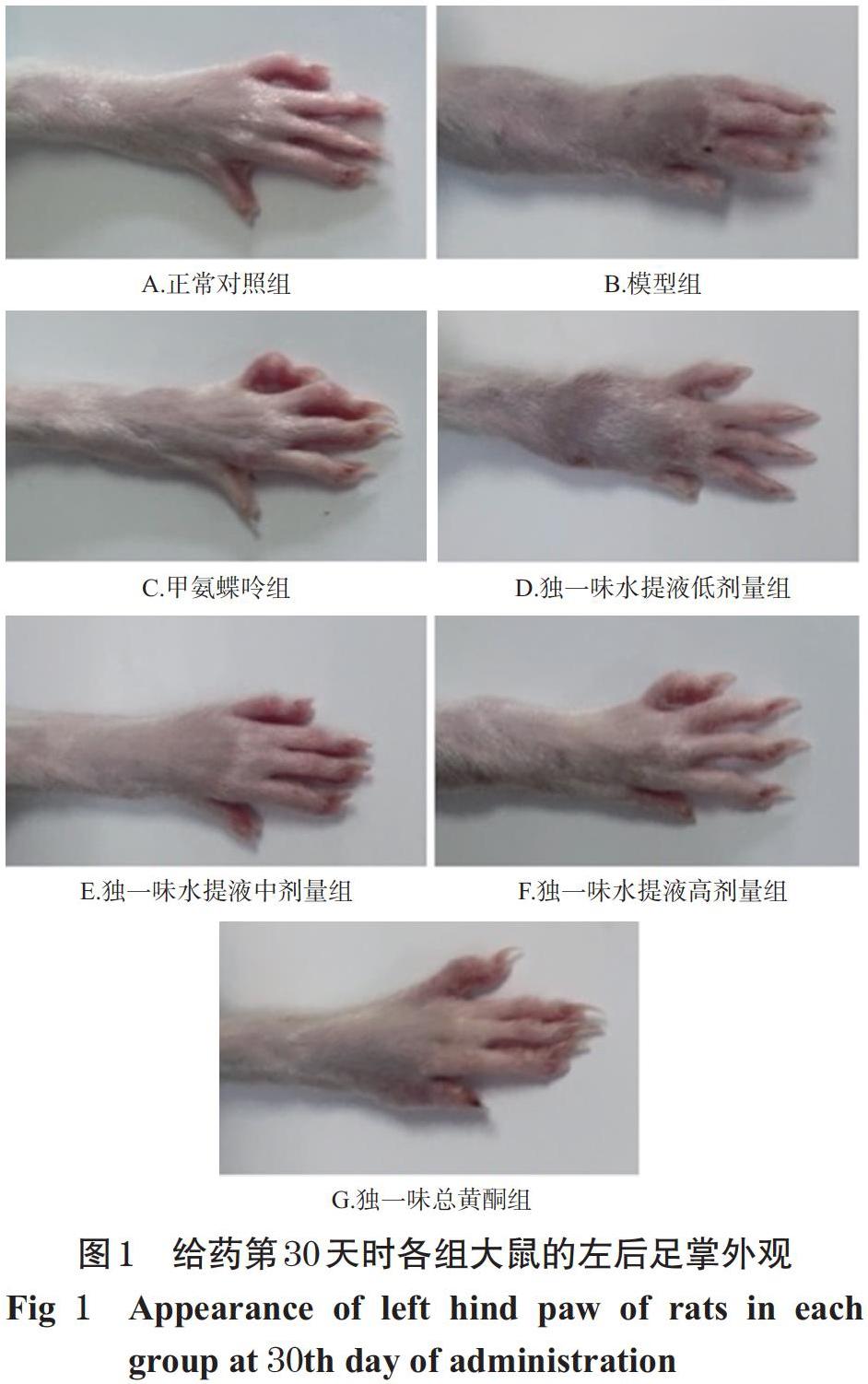
与正常对照组比较,模型组大鼠给药第15、30天时的关节炎指数均显著升高(P<0.01)。与模型组比较,各给药组大鼠给药第15、30天时的关节炎指数均显著降低(P<0.01)。与同组给药第15天时比较,各给药组大鼠给药第30天时的关节炎指数均显著降低(P<0.05或P<0.01),而模型组差异无统计学意义(P>0.05)。与独一味水提液高剂量组比较,独一味总黄酮组大鼠给药第15、30天时的关节炎指数差异均无统计学意义(P>0.05)。给药第30天时各组大鼠的左后足掌见图1,给药第15、30天时各组大鼠的关节炎指数测定结果见表2。
3.4 独一味水提液和总黄酮对AA模型大鼠血清中炎症因子水平的影响
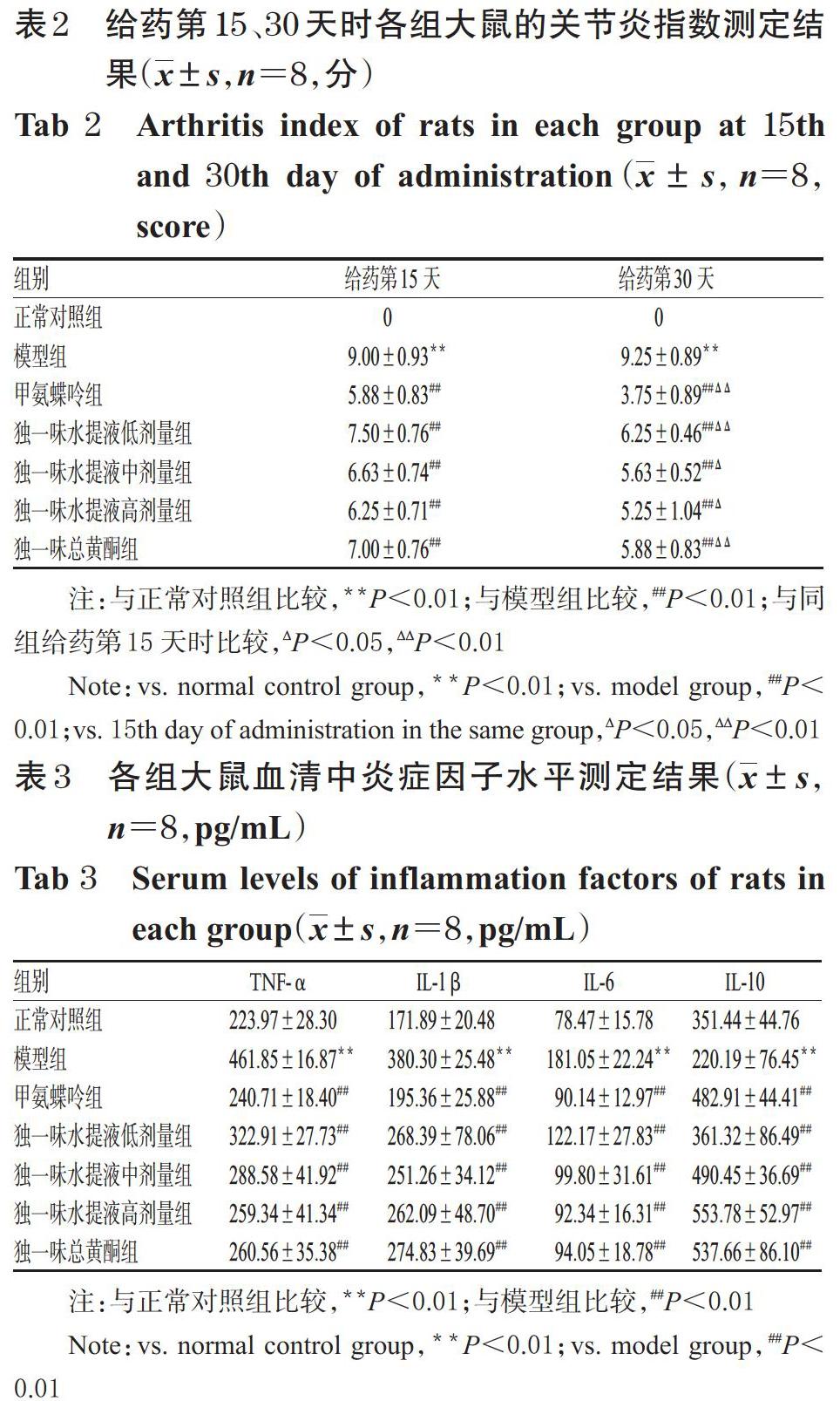
与正常对照组比较,模型组大鼠血清中TNF-α、IL-1β、IL-6水平均显著升高(P<0.01),IL-10水平显著降低(P<0.01)。与模型组比较,各给药组大鼠血清中TNF-α、IL-1β、IL-6水平均显著降低(P<0.01),IL-10水平均显著升高(P<0.01)。各组大鼠血清中TNF-α、 IL-1β、IL-6和IL-10水平测定结果见表3。
3.5 独一味水提液和总黄酮对AA模型大鼠胸腺指数、脾指数的影响
与正常对照组比较,模型组大鼠胸腺指数显著降低(P<0.01),脾指数显著升高(P<0.01)。与模型组比较,各给药组大鼠的胸腺指数均显著升高(P<0.01),脾指数均显著降低(P<0.01)。各组大鼠胸腺指数、脾指数测定结果见表4。
3.6 独一味水提液和总黄酮对AA模型大鼠踝关节病理学变化的影响
正常对照组大鼠踝关节滑膜细胞结构完整、排列整齐,细胞下为疏松结缔组织,无炎症细胞浸润。与正常对照组比较,模型组大鼠踝关节组织可见明显的滑膜细胞增生、浸润关节腔,滑膜细胞下的结缔组织因胶原纤维增生而变得紧密,间质可见明显的炎症细胞浸润。与模型组比较,各给药组大鼠上述症状均不同程度地好转,滑膜细胞向关节腔的浸润、间质的炎症细胞浸润均不同程度地减轻。各组大鼠踝关节病理学变化显微图见图2。
4 讨论
AA是一种经典的免疫炎症模型,其发病机制和病理表现与人体RA相似,目前已被广泛用于抗RA药物研发的基础研究中[16-17]。甲氨蝶呤是在临床上用于治疗RA的首选药物之一,其在开发治疗RA药物的基础研究中常被用作阳性药物[13,18]。故本研究以甲氨蝶呤为阳性对照药物,采用AA大鼠模型来研究独一味水提液和总黄酮的抗RA作用。在RA中,致炎细胞因子和抗炎细胞因子之间的不平衡会诱导自身免疫、慢性炎症的发生,并由此引起关节损伤[19]。TNF-α、IL-1β、IL-6是常见的致炎细胞因子,IL-10是常见的抗炎细胞因子,这些细胞因子广泛参与了RA的发病进程[19-20]。相关研究发现,在RA患者的血清中TNF-α水平显著升高,其与RA患者的炎症和关节破坏直接相关[21]。TNF-α可通过多方面因素介导RA的发生与发展,如刺激B淋巴细胞、T淋巴细胞和自然杀伤细胞的增殖和分化,诱导产生其他促炎细胞因子(如IL-1、IL-6),促进滑膜细胞上调溶血素、胶原酶、前列腺素、粒细胞单核细胞集落刺激因子的分泌,通过成纤维细胞刺激黏附分子(如细胞内黏附分子1)的表达等[22]。IL-1β可通过增加滑膜成纤维细胞的细胞因子、趋化因子、诱导型一氧化氮合酶等的释放,介导RA的发生与发展[23];IL-6可通过作用于嗜中性粒细胞而引起炎症和关节的破坏,从而参与到RA的发生与发展中[24]。而IL-10可通过多个途径阻滞RA的发生与发展,如减少TNF-α、IL-1β、IL-6的形成和抑制TNF-α诱导的滑膜成纤维细胞产生前列腺素等[25]。因此,降低TNF-α、IL-1β、IL-6水平,升高IL-10的水平,对阻滞RA的发生与发展至关重要。
胸腺、脾是机体中非常重要的免疫器官。其中,胸腺主要参与细胞免疫,脾主要参与体液免疫,胸腺质量和脾质量与免疫细胞数量及免疫功能直接相关,故胸腺指数、脾指数可在一定程度上反映机体的免疫功能状态[26]。而RA是一种自身免疫性疾病,发病后可使机体的胸腺指数、脾指数偏离正常状态[27]。
本研究结果显示,与正常对照组比较,模型组大鼠的足肿胀度、关节炎指数、脾指数以及血清中TNF-α、IL-1β、IL-6水平均显著升高,胸腺指数和血清中IL-10水平均显著降低,踝关节组织可见明显的病理学改变(如炎症反应、滑膜增生等),均提示造模成功。与模型组比较,甲氨蝶呤组和独一味各给药组大鼠的足肿胀度、关节炎指数、胸腺指数、脾指数、炎症细胞因子水平、踝关节病理学变化等均显著改善;且通过各给药组大鼠给药第15、30天时的足肿胀度、关节炎指数的比较可以发现,各给药组大鼠上述指标水平均随着给药时间的延长而显著降低,而模型组大鼠的上述指标水平并未随着实验时间的推移发生显著变化。综合以上结果可知,独一味水提液、总黄酮均具有良好的抗RA的作用。进一步通过与独一味水提液高剂量组比较发现,独一味总黄酮组大鼠在给药第15天时的足肿胀度以及在给药第15、30天时的关节炎指数、胸腺指数、脾指数、炎症细胞因子水平、踝关节病理学变化等差异均不显著。以上结果提示,总黄酮可能是独一味抗RA的主要药效成分群,这与本课题组前期基于网络药理学的独一味抗RA的药效物质基础预测结果一致[12]。
综上,藏药独一味具有良好的抗RA作用,总黄酮可能是其药效物质基础。但其确切的药效物质基础及其作用机制等尚需进一步研究。
参考文献
[ 1 ] 韩海燕,沈敬华.类风湿关节炎发病机制的研究进展[J].世界最新医学信息文摘,2019,19(93):66-67、69.
[ 2 ] MCINNES IB,SCHETT G. The pathogenesis of rheumatoid arthritis[J]. N Engl J Med,2011,365(23):2205-2219.
[ 3 ] CROSS M,SMITH E,HOY D,et al. The global burden of rheumatoid arthritis:estimates from the global burden of disease 2010 study[J]. Ann Rheum Dis,2014,73(7):1316-1322.
[ 4 ] 李延婷,姜泉,巩勋,等.类风湿关节炎患者中医药治疗现状调查分析[J].中医杂志,2020,61(8):676-680.
[ 5 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:274、1367.
[ 6 ] 贾正平,李茂星,张汝学,等.独一味止血有效部位的实验研究[J].解放军药学学报,2005,21(4):272-274.
[ 7 ] LI M,ZHANG R,JIA Z,et al. Isolation and identification of hemostatic ingredients from Lamiophlomis rotata (Benth.) Kudo[J]. Phytother Res,2009,23(6):816-822.
[ 8 ] FAN PC,MA HP,HAO Y,et al. A new anti-fibrinolytic hemostatic compound 8-O-acetyl shanzhiside methylester extracted from Lamiophlomis rotata[J]. J Ethnopharmacol,2016,187:232-238.
[ 9 ] 趙越,晏菁遥,黄闰月,等.近十年治疗类风湿关节炎文献的中医证候分布与遣方用药规律分析[J].中华中医药学刊,2019,37(9):2168-2177.
[10] 王丽娟,王勇,杨婕,等.独一味抗大鼠佐剂性关节炎防治作用的实验研究[J].中国中医基础医学杂志,2013,19(7):763-766.
[11] 叶飞,杨洪彬,徐永旭.独一味胶囊治疗类风湿关节炎69例的临床研究[J].世界中医药,2007,2(6):339-340.
[12] JIANG Y,ZHONG M,LONG F,et al. Network pharmacology-based prediction of active ingredients and mechanisms of Lamiophlomis rotata (Benth.) Kudo against rheumatoid arthritis[J]. Front Pharmacol,2019,10:1-9.
[13] 蔡悦,刘晓龙,郭静,等.甘草附子汤治疗佐剂性关节炎模型小鼠的抗滑膜血管生成机制研究[J].中国药房,2019,30(12):1618-1623.
[14] 张雪萍,蔡广知,安娜,等.两头尖醇提物抗佐剂性关节炎作用的研究[J].中药药理与临床,2016,32(2):131-134.
[15] 张雯,贡磊,周玲玲,等.不同比例甘草配伍祖师麻抗大鼠佐剂性关节炎的实验研究[J].中草药,2014,45(10):1418-1426.
[16] ZHANG H,YIN L,LU M,et al. Evodiamine attenuates adjuvant-induced arthritis in rats by inhibiting synovial inflammation and restoring the Th17/Treg balance[J]. J Pharm Pharmacol,2020,72(6):798-806.
[17] 李宏全,邱建东,杨丽华.黄芪杂多糖对佐剂性关节炎大鼠促炎因子分泌及关节滑膜细胞凋亡的调节作用[J].药学学报,2009,44(7):731-736.
[18] 甘雨舟,李茹.甲氨蝶呤治疗类风湿关节炎的跌宕历程[J].中华风湿病学杂志,2018,22(1):34-35.
[19] MCINNES IB,BUCKLEY CD,ISAACS JD. Cytokines in rheumatoid arthritis:shaping the immunological landscape[J]. Nat Rev Rheumatol,2016,12(1):63-68.
[20] ALAM J,JANTAN I,BUKHARI SNA. Rheumatoid arthritis:recent advances on its etiology,role of cytokines and pharmacotherapy[J]. Biomed Pharmacother,2017,92:615-633.
[21] EDREES AF,MISRA SN,ABDOU NI. Anti-tumor necrosis factor (TNF) therapy in rheumatoid arthritis:correlation of TNF-alpha serum level with clinical response and benefit from changing dose or frequency of infliximab infusions[J]. Clin Exp Rheumatol,2005,23(4):469-474.
[22] VASANTHI P,NALINI G,RAJASEKHAR G. Role of tumor necrosis factor-alpha in rheumatoid arthritis:a review[J]. APLAR J Rheumatol,2007,10(4):270-274.
[23] MCINNES IB,SCHETT G. Cytokines in the pathogenesis of rheumatoid arthritis[J]. Nat Rev Immunol,2007,7(6):429-442.
[24] DAYER JM,CHOY E. Therapeutic targets in rheumatoid arthritis:the interleukin-6 receptor[J]. Rheumatology(Oxford),2010,49(1):15-24.
[25] MATEEN S,ZAFAR A,MOIN S,et al. Understanding the role of cytokines in the pathogenesis of rheumatoid arthritis[J]. Clin Chim Acta,2016,455:161-171.
[26] 侯婧霞,丁厚偉,朱星宇,等.不同加工工艺山药药效对比研究[J].中药材,2019,42(1):74-77.
[27] 杜成成,谭余庆,沈建英,等.双氢青蒿素对两种类风湿关节炎模型的影响及机制[J].中国实验方剂学杂志,2019,25(10):48-56.
(收稿日期:2020-10-29 修回日期:2021-01-26)
(编辑:林 静)
