EPA、DHA改善神经系统的几种间接机制研究进展
2021-04-07张德勇许晓路
张德勇 许晓路
(浙江树人大学生物与环境工程学院,杭州 310015)
ω-3多不饱和脂肪酸(ω-3 PUFA)在促进神经系统健康方面的功效已经被反复证实,其中研究最多的两种分子是二十碳五烯酸(Ecosapentaenoic acid,EPA)和二十二碳六烯酸(Docosahexaenoic acid,DHA)。它们还被尝试应用于治疗阿尔茨海默病(Alzheimer disease,AD)、帕金森病(Parkinson′s disease,PD)等神经退行性疾病的治疗,且确实能发挥一定的疗效[1,2]。但对于EPA、DHA保护神经系统的分子机制,目前所知有限。简单来说,其机制涉及到直接机制和间接机制两个方面。
直接机制方面,主要体现在DHA、EPA(尤其是DHA)本身就是神经细胞的重要组成成分。DHA是脑中最主要的ω-3 PUFA,占脑PUFA的40%。因此,DHA本身对细胞膜的酰基链顺序、膜流动性、相行为、压缩、渗透性、融合、触发器和蛋白质活性等诸多物理特性有直接的影响,还可驱动胆固醇耗尽区的生成。但是值得注意的是,从含量占比看,EPA的重要性似乎远不如DHA,EPA在脑中的含量通常比DHA低250~300倍。二者在脑磷脂中的结合部位也不同,DHA主要结合到磷脂酰乙醇胺(PE)和磷脂酰丝氨酸(PS),而EPA更倾向于结合到磷脂酰肌醇(PI)[3]。但是越来越多的研究显示,EPA、DHA对神经系统的保护作用更多是通过各种复杂的间接机制来发挥作用的,包括调控神经干细胞分化、调控突触蛋白表达、抗氧化应激、调节炎症平衡等,而且很多时候还是先转化成一些衍生物再发挥作用的。本文对近年来在这些间接机制方面的研究做一个简要回顾。
1 EPA、DHA促进神经干细胞分化的机制
有大量体内、体外实验显示ω-3 PUFA能促进神经干细胞向神经元的分化,但早期的研究未意识到对不同种类的ω-3 PUFA也需要进一步精细区分。对比DHA和EPA的效应,1 μmol/L的DHA和EPA均促进了神经干细胞的分化,且促进程度比较接近。然而,二者在机制方面,所针对的细胞周期相关转录因子却似乎有所不同。EPA显著提高了Hes1的含量,而DHA却降低了其含量。Hes1是一种抑制型转录因子,它抑制神经干细胞的分化,促进其增殖。此外,限制EPA导致了Hes6升高,后者与Hes1形成正反馈回路,促进神经元分化[4]。Mandhair等[5]研究表明EPA和DHA对神经发生的影响机制是不完全一致的,在其研究中,10 mol/L的EPA显著促进了神经元增殖,而10 mol/L的DHA则抑制了其增殖,但是抑制神经元增殖可以理解为与促进其分化具备同等作用[5]。EPA和DHA在调节神经干细胞命运中的发挥的作用可能是基于在它们通过协作,维系bHLH (basic helix-loop-helix) 转录因子使其处于适当的表达水平。
添加EPA和DHA被观察到对神经干细胞的发育具有调节作用,但目前尚不清楚其机制是否基于EPA、DHA的直接作用。研究显示,一些衍生物可能参与了这个过程,如DHA-EA(N-二十二碳六烯醇乙醇胺,又称突触胺)能通过激活“PKA/cAMP反应元件结合蛋白”而诱导神经干细胞分化[6]。此外,DHA氧化后的衍生物NPD1也被证明能促进胚胎干细胞的神经分化[7]。
2 EPA、DHA促进突触生成、改善突触传递的机制
DHA对大鼠嗜铬细胞瘤-12(PC-12)细胞突起生成的长度和复杂性、大鼠胚胎海马的原代培养、大鼠胚胎皮层神经元等均有促进效应。除了促进神经突起的生长外,DHA还促进了大鼠海马神经元的突触形成[8]。Robson等直接比较了DHA、EPA对幼年(出生后第3天和第9天)、成年(2—4个月)和老年(18—20个月)大鼠的初级感觉神经元的轴突促进效应。EPA、DHA在发育期都能促进神经突起的生长;但对于老龄大鼠,则只有DHA能产生正向作用[9]。
DHA、EPA的这些效应可能与突触蛋白的表达有密切关联。用DHA处理后,突触蛋白如突触素、突触前密度蛋白95等的表达水平有所增加,这些蛋白是有助于改善突触传递功能的[10,11]。Cao等[12]研究也证实DHA能促进大鼠海马神经元的突触蛋白和谷氨酸受体的表达。在大鼠生长期,DHA长期缺乏可导致突触蛋白以及NMDA受体、AMPA受体表达量的降低。怀孕期母鼠ω-3 PUFA的缺乏可导致子鼠海马NMDA受体的亚单位NR1、NR2A和NR2B表达量的下降。
PUFA的某些衍生物可能也参与了促进突触发生的机制。例如DHA-EA (N-二十二碳六烯醇酰胺,又称突触酰胺、突触胺)能促进神经元突触的形成。在GPR110 KO小鼠大脑中的突触蛋白表达和突触数量可显著降低,消除了DHA-EA还诱导神经源性分化和神经突增生,表明了DHA-EA/GPR110 信号可能为神经发生和突触形成的重要机制。DHA-EA还能促进蛋白激酶A底物的磷酸化,从而激活cAMP反应元件结合蛋白(CREB)信号通路,而CREB在突触形成方面具有重要的调节作用。
3 EPA、DHA的抗氧化应激效应
神经系统中的DHA可以清除自由基、避免脂蛋白的过氧化、抑制氧化应激,缓解炎症反应和脑神经细胞凋亡。氧化应激开始时,未酯化的DHA经磷脂酶A2游离出来,代谢成二十烷类,其中的神经保护素protectin D1是氧化应激反应中引起凋亡的产物和COX2的抑制剂[13]。
4 EPA、DHA对炎症的调节作用
PUFA 从细胞膜磷脂池中游离出来后可代谢生成百余种脂类炎症调节介质。一般而言,源于ω-6 PUFA的衍生物往往具有促炎症效应,而源于ω-3 PUFA的衍生物则往往具有抗炎作用(但是仍有某些分子呈现微弱的促炎效应),加上二者的代谢存在对酶系的竞争,因此可以视为二者从两个相反的方面共同协调机体的炎症平衡。由于ω-6 PUFA不在本文讨论范围,在此仅仅讨论一下源于EPA、DHA这两种ω-3 PUFA的脂质炎症调节介质。在治疗神经退行性疾病的研究中多项研究显示,这些炎症介质的调节作用也是EPA、DHA发挥保护神经作用的重要机制。如图1、图2及表1所示,游离的EPA、DHA在环氧合酶(Cyclooxygenase,COX)、脂氧合酶(Lipoxygenase,LOX)和细胞色素P450混合功能氧化酶(CYP450)三种酶系的催化下,可以转化成一系列的炎症介质分子,包括前列腺素(PG)、白三烯(LT)、消退素(Rv)、神经保护素(NPD)、环氧二十碳四烯酸(EEQs)、环氧二十碳五烯酸(EDPs)、亲电脂肪酸氧合衍生物(EFOX)、maresins(MaR)等。

图2 DHA几类衍生物的代谢生成途径[8]
4.1 前列腺素
如图1、表1所示,EPA可代谢生成某些3系列的前列腺素(PG),但3系列的PG总体而言,对炎症的调节效应较为微弱,其中某些类别如PGG3、PGH3尤其短暂,会快速转化成下游的各种其他种类的PG分子。就炎症调节效应而言,3系列的PG发挥的是促炎症效应,但是活性微弱,远不如2系列的PG(由ARA代谢而来)。如PGE2对COX-2 基因表达以及IL-6 生成的诱导作用非常显著,而PGE3的作用就非常微弱。值得注意的是,3系列的PG仍属于促炎症介质,与消退素等其他介质分子相反,这使得EPA、DHA的衍生物对炎症的调节效应其实是呈现出了双向调节效应,只不过总体以消退效应为主。再从整体角度看,EPA还与ARA等其他脂肪酸竞争了酶,降低了其他促炎介质的产生,又间接发挥了缓解炎症的效应,因此其调节效应是多样化的。

表1 由EPA、DHA衍生的几种炎症介质分子
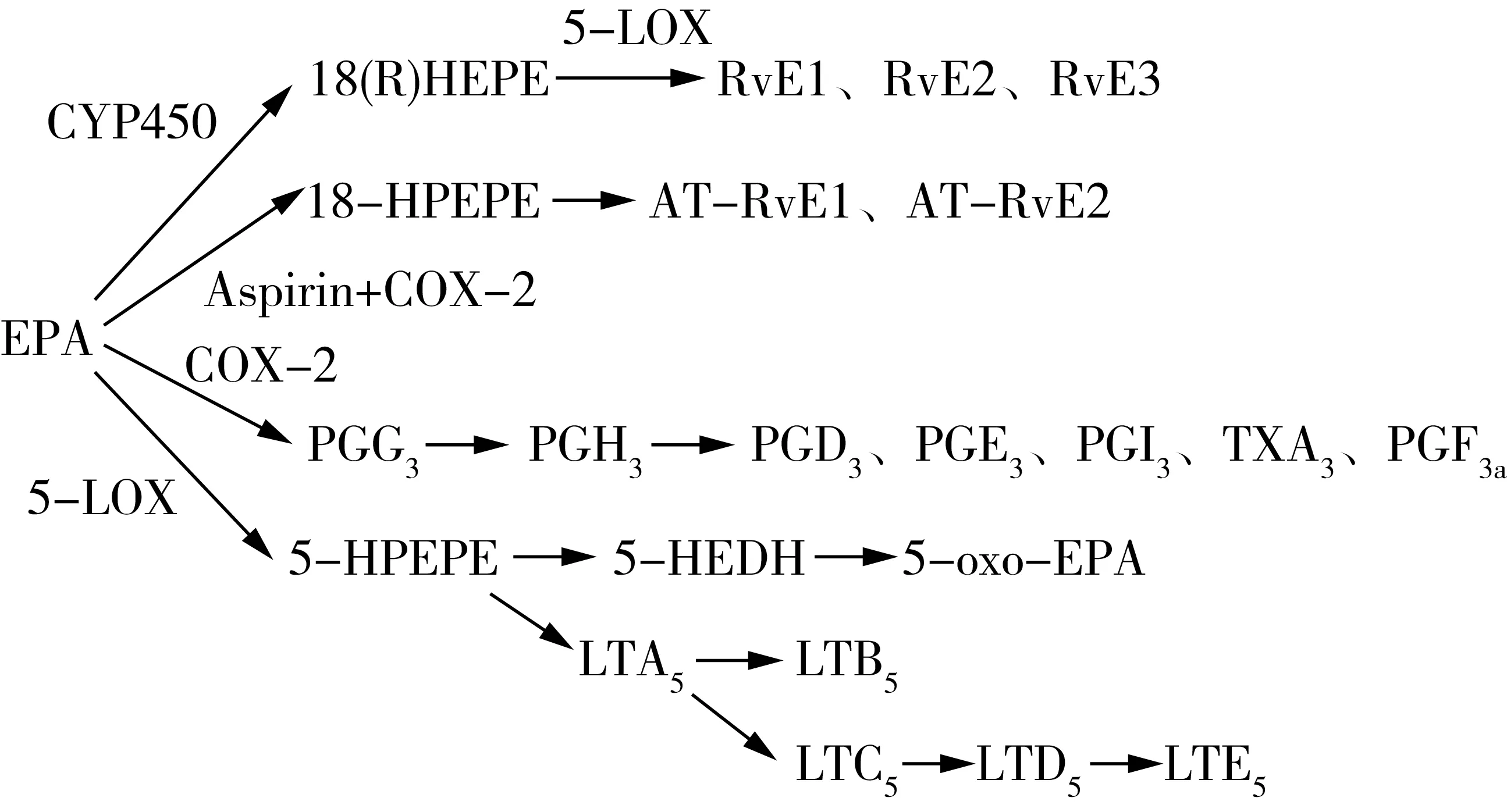
图1 EPA几类衍生物的代谢生成途径[8]
4.2 白三烯
EPA经5-LOX 途径生成5 系列的白三烯(LT),具有一定的促炎效应。但是与前列腺素的情况差不多,5系列的LT对炎症的促进性的调节作用也是较为微弱的,远不像其他系列的LT那么显著。例如4系列的LT有明显的促炎症效应,LTB4对中性粒细胞的趋化作用较LTB5高出10~100 倍,高水平的LTB4被认为是脑动脉硬化所致进展性缺血性脑卒中的危险因素之一[14]。当然,从更宏观的角度看,机体代谢生成5系列LT与生成其他系列的LT本身是存在酶的竞争关系的,从这个角度看,生成3系列LT本身缓解了其他更强烈的促炎LT的生成,又对炎症起到一定的缓解效应,因此其效应应该从多个角度来综合看待。
4.3 消退素
消退素(Resolvin,Rv)包括源于EPA的RvE系列(RvE1、RvE2)和源于DHA的RvD系列(RvD1、RvD2、RvD3、RvD4、RvD5 和RvD6),它们由一般是由LOX酶或酰基化的COX-2酶催化而生成[15]。消退素可通过多个方面发挥强大的抗炎活性,其中最主要的包括调节炎症细胞的趋化性和吞噬能力,以及控制多种促炎症介质(如前列腺素PG、白三烯LT等)的表达和活性[12-15]。近年来对消退素信号途径和受体的研究取得较大进展。现有研究主要集中在RvE1、RvE2、RvD1、RvD2、RvD3和RvD5几种消退素的信号途径,发现它们的受体属于跨膜G蛋白偶联受体(GPCRs),并通过这一途径发挥消退效应。共发现4种消退素受体分子:D消退素受体1(DRV1/GPR32)、D消退素受体2(DRV2/GPR18)、脂蛋白和甲酰肽受体2(ALX/FPR2)和趋化因子样受体1(CMKLR1,亦称ERV1/ChemR23)[16]。
RvE1与ERV1/ChemR23结合后可激活下游通路,产生的结果包括中性粒细胞凋亡被促进、巨噬细胞介导的吞噬作用增强、炎症细胞NF-κB信号传导被抑制、促炎细胞因子的产生减少[17,18]。与RvE1相比,RvE2介导的促消退效应更倾向于针对中性粒细胞。然而,RvE1和RvE2是否共享同样的受体和信号途径尚不清楚[16,17]。RvD系列消退素能结合DRV1/GPR32、DRV2/GPR18和ALX/FPR2,但对3种不同的受体分子的亲和力大小并非一成不变的。RvD1通过ALX/FPR2和DRV1/GPR32传输信号,RvD2通过DRV2/GPR18途径传输信号,RvD3通过ALX/FPR2和DRV1/GPR32传输信号,RvD5通过DRV1/GPR32传输信号[16]。ALX/FPR2途径的激活产生的结果是抑制p38丝裂原活化蛋白激酶(MAPK)的磷酸化,抵消中性粒细胞和巨噬细胞迁移和产生促炎症介质的能力[18]。DRV1/GPR32信号不仅促进巨噬细胞介导的吞噬作用和巨噬细胞向预分解表型的极化,而且还通过阻止T细胞向Th1和Th17表型分化和促进调节性T细胞的生成来调节适应性免疫应答。另外,RvD2-DRV2/GPR18轴除了参与调节中性粒细胞浸润能力和巨噬细胞介导的吞噬功能外,似乎在调节小胶质细胞功能方面发挥着关键作用[16]。
RvE1特异性结合孤儿受体ERV1/ChemR23和BLT1(一个白三烯B4受体),而RvD1特异性结合DRV1/GPR32和ALX(一个脂蛋白A4受体)。这种特异性可能决定了源于EPA和源于DHA的SPM发挥各自独特的效应。值得注意的是,同一种消退素受体也可以因环境变化、激动剂的存在等原因而激活不同的下游信号通路。而且除了消退素等促消退介质,一些促炎介质也可能激活消退素受体,但导致的生物反应传导却可能是不同、甚至完全反向的。例如,chemerin和lipoxin A4可分别作为ERV1/ChemR23和ALX/FPR2的促炎配体[16]。此外,一些消退素也可能与其他受体结合,超出其特定的GPCRs,从而促进多途径的促分解作用。例如,RvE1可作为白三烯B受体1(BLT1)的部分激动剂,抑制白三烯诱导的白细胞促炎信号[19]。因此,消退素及其受体在参与炎症平衡方面除了主要的促分解效应,还有许多复杂微妙的不同效应存在,还有许多疑问有待进一步研究。
4.4 保护素
在DHA的衍生物中,还有一类神经保护素protectins。就保护神经系统的角度而言,其中最值得关注的是神经保护蛋白D1(NPD1,10R-17S-二羟基-二十二碳六烯酸),NPD1可因氧化应激、癫痫、脑缺血-再灌注以及有神经营养素存在等情况下迅速生成,往往在神经损伤反应中启动大量合成,对脑损伤、暴露于β淀粉样肽的大脑有保护作用,被看好未来能应用于许多神经相关疾病的治疗[20]。关于NPD1在衰老和阿尔茨海默病(AD)大脑中的脑细胞存活和修复中的作用方面也取得了较大进展,如戴颂阳发现其通过抑制GSK-3β活性在AD病人中发挥神经保护作用,抑制GSK-3β活性后可以降低Aβ42的表达、降低Tau蛋白过度异常磷酸化水平、降低细胞凋亡率、改善自噬活性等诸多神经保护作用[21]。
至于EPA衍生的SPMs,尚未发现有明确的神经保护素或类似分子,其神经保护作用情况尚有待进一步探索。
4.5 Maresins
Maresins(MaR)是近年来新发现的一种炎症因子,尚无统一的翻译名称,本文采用英文原名。Maresins是由巨噬细胞中的DHA在12-LOX酶的催化下生成。目前发现的maresins主要包括3 种,即maresin1、maresin2、maresin-LS,其中maresin-LS又可分为maresin-L1 和maresin-L2。它们分别在炎症消退阶段由内源性DHA 通过脂加氧酶、可溶性环氧化物水解酶和细胞色素P450 等一系列酶促反应合成的一类含多羟和多不饱和共轭双键分子,其碳链长度均为22C,包含6个双键。根据其羟基的位置及构象、双键位置及构象的不同而命名不同[22]。
Maresin1 可通过限制中性粒细胞浸润、增强巨噬细胞吞噬凋亡中性粒细胞及坏死细胞、抑制促炎介质的产生、抑制核因子κB (nuclear factor κB,NF-κB) 的活性、促进调节性T 细胞的从头合成、提高细胞内cAMP水平,使炎症消退,并且能发挥减缓炎性疼痛、促进组织再生等效应。Maresin1 对巨噬细胞的影响,除了抑制其产生促炎性介质,还能导致细胞表型由经典活化型转变为炎症消退型,从而促进凋亡细胞的吞噬作用、加速炎症消退。Maresins的炎症调节效应在全身各处能发挥广泛的作用,其中也包括在神经系统中,可能是其保护神经系统的机制之一。在各种急、慢性炎症引起人体组织的红肿热痛、组织损伤时,瞬时受体电位香草酸亚型1(Transient receptor potential family vanilloid subtype 1,TRPV1)表达于初级感觉神经元并在介导疼痛和受伤后痛觉过敏中起重要作用。在小鼠上的一项研究通过在小鼠足底注射辣椒素引起炎性疼痛时注射Maresin1,发现Maresin1 能剂量依赖性地抑制发生在神经元的TRPV1电流,阻断辣椒素诱导的内向电流,从而减轻小鼠炎症性疼痛[22]。另外还有研究显示,maresin1能减轻小鼠腹腔注射化疗剂长春新碱(Vincristine, Oncovin,VCR)引起的化疗后神经性疼痛[22]。在涡虫(一种身体受伤后能够快速再生的低等无脊椎生物)上面的研究发现,当人工切除其前部并暴露于促消退介质分子中时,此时maresin1 的生物合成被迅速激活,并显著刺激了组织的再生,而且其效应呈现剂量依赖性[22]。这些结果表明,maresin1 为促进器官组织再生及减轻炎性疼痛提供了新的代谢途径
4.6 亲电脂肪酸氧合衍生物(EFOX)
亲电脂肪酸氧合衍生物(EFOX)是一类由COX-2和5-LOX合成的、源自EPA和DHA的新型脂类抗炎介质分子,包括5-oxo-EPA和7-oxo-DHA[23]。EFOXs被证明具有广泛的抗氧化作用和抗炎作用,包括作为核转录因子的激动剂、过氧化物酶体增殖物激活受体γ(PPARγ),激活Nrf2依赖的抗氧化反应,抑制细胞因子的产生和诱导的NO活化巨噬细胞中的表达。有研究显示,连续4个月每天补充1g EPA和0.4g DHA显著增加了5-oxo-EPA和7-oxo-DHA的形成,与源于DHA的消退素的产生趋势相似,显示了它们遵循统一途径;而且,COX-2的阿司匹林乙酰化也显著增加了EFOXs的产生,进一步显示出其合成途径。尽管EFOX的研究尚且较为有限,每种EFOS分子各自的效应尚待精确区分,但上述发现至少表明,在EPA、DHA发挥抗炎和促炎症消退作用方面,不能忽视这些新发现的介质所起到的贡献[8]。
4.7 酰胺类衍生物的抗炎作用
DHA-EA、EPA-EA分别是DHA和EPA酰胺衍生物,在分化脂肪细胞中的研究显示,补充DHA-EA可减少促炎性细胞因子白细胞介素6(IL-6)、单核细胞趋化蛋白1(MCP-1)等的产生[24]。在大脑小胶质细胞中,DHA-EA和EPA-EA还可以被进一步环氧化变成环氧二十碳五烯酸-乙醇酰胺(19,20-EDP-EA)、环氧二十碳四烯酸-乙醇酰胺(17,18-EEQ-EA)。McDougle等在小胶质细胞上证实了19,20-EDP-EA 和17,18-EEQ-EA均可抑制促炎生物标记物IL-6 及NO的产生,同时促进了抗炎细胞因子白细胞介素10(IL-10)的生成,表明它们参与了炎症调控,发挥抑制炎症的效应[25,26]。
5 EPA、DHA对微管蛋白的调节效应
Serrano-Garcia等研究发现DHA还可以通过调节微管蛋白发挥神经保护作用。微管蛋白是细胞骨架中的微管的主要结构单元,对神经元的生长、形态、运输和极性等起着至关重要的作用。该研究发现鱼藤酮可使α-微管蛋白降低,而用DHA预处理则可降低鱼藤酮对微管蛋白的不良影响,发挥保护作用[27]。
6 展望
虽然PUFA早就被发现有益于神经系统的健康,但早期对其作用机制的认识较为笼统,既未意识到需要精确区分不同种类的PUFA分子所具有的不同效应,也未意识到其各类代谢衍生物在促进神经系统健康中的具体参与程度。如上所述,近年来的研究在锁定了EPA、DHA等具体PUFA分子之后,进一步加大了对其代谢衍生物的关注、研究。尤其是神经保护素、消退素、Maresins等对神经系统健康起到重要调节作用的分子更是成为了近年来的研究热点。这些研究有助于揭示PUFA在保护神经系统健康方面以往被忽略的一些重要的间接机制,也有助于将来更精确、更科学地将PUFA或其某些衍生物应用于治疗AD、PD等神经退行性疾病。
