香樟精油抑制灰绿曲霉的活性与机理研究
2021-04-07陈可欣骆郑航顾玉婷胡振阳都立辉
陈可欣 骆郑航 李 玲 顾玉婷 袁 康 胡振阳 都立辉
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏省粮油品质控制及深加工技术重点实验室,南京 210023)
我国是粮食生产大国,然而每年有近3%的粮食因霉菌污染而浪费[1]。霉菌是影响粮食安全储藏的重要因素之一,粮食受到霉菌侵染后,会霉烂腐败而产生霉、酸、腐臭等难闻气味,不仅降低了粮食品质,给我国农业造成巨大的经济损失,还会给消费者的健康安全带来隐患[2,3]。
化学农药因其毒性较大,污染环境等弊端受到消费者排斥[4]。而与传统化学农药相比,植物源农药的有效成分是天然产物,使用后易分解为无毒物质,对人体危害小,对环境无污染,有较好的应用前景[5]。
随着人们健康与环保意识增强,天然植物精油在食品行业中的应用已经成为近年来的研究热点。植物精油 (essential oils) 是植物不同组织中一类次生物质,由分子量较小的简单化合物组成,是一类易挥发、有强烈的芳香气味的油状液体[6]。香樟精油是从香樟叶 (Cinamomumcamphora)中提取的活性物质,主要成分为α-松油醇、β-松油醇、樟脑烯、柠檬烃和丁香油酚等[7,8]。植物精油中的活性物质通过不同方式发挥作用,因而起到广谱的抑菌效果[9]。香樟精油已广泛应用于香精香料、精细化学品合成、药物合成、日用化工等领域,相关研究及开发利用等工作由来已久[10]。现有的相关研究主要围绕植物精油的抑菌机理、抑菌成分及检测技术进行,并已取得一定成果,但香樟精油应用于储粮霉菌的研究较少,因此有必要对香樟精油作用于储粮霉菌如灰绿曲霉的抑菌效果进一步研究[11,12]。
基于香樟精油在食品中微生物抑制领域的应用,本试验主要测定了香樟精油对灰绿曲霉的最小抑制浓度,研究不同浓度的香樟精油的抑菌活性,探讨香樟精油抑制灰绿曲霉的抑菌机理,为香樟精油对灰绿曲霉的控制提供理论参考。
1 材料与方法
1.1 材料与试剂
灰绿曲霉、马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA)、马铃薯葡萄糖肉汤(Potato Dextrose Broth,PDB)、香樟精油;其余试剂均为分析纯。
1.2 仪器与设备
Synergy H1酶标仪,BSC-250隔水式恒温培养箱,TM3000扫描电镜,傅里叶红外光谱,流式细胞仪BD FACSVerse,紫外分光光度计。
1.3 方法
1.3.1 菌株培养
配置新鲜的PDA培养基,接种灰绿曲霉,28 ℃恒温培养3 d,挑取长势良好的霉菌接种于新鲜的PDA培养基上,相同条件,重复三次。将培育好的霉菌接种于PDB培养基中,28 ℃恒温培育3~5 d。将菌液与已灭菌的30%的甘油以体积比1∶1混合均匀,-70 ℃保存。使用菌种时,菌液解冻活化,取1%菌液接种于PDB培养基中,28 ℃恒温培养3 d,备用[13]。
孢子液的制备:在PDA培养基上接种灰绿曲霉,28 ℃恒温培养3 d,用无菌水反复冲洗菌落表面,洗下孢子,用无菌纱布滤去菌丝,制得孢子悬浮液。充分振荡混匀后,用血球计数板在显微镜下观察计数。保存在4 ℃冰箱中,备用。
1.3.2 香樟精油对灰绿曲霉的最小抑菌浓度的测定
将适量香樟精油溶于5%的Tween-80水溶液中,得到初始浓度为16 μL/mL的精油溶液,通过二倍稀释法得到精油浓度为8、4、2、1、0.5、0.25 μL/mL的体系。将计数后的菌液,取适量离心,并用不同浓度的精油溶液重悬,使得霉菌孢子浓度为105CFU/mL,以不加菌液的培养基作为阳性对照,以不加精油的菌液作为阴性对照。28 ℃恒温培养,分别于0、12、24、36、48、60、72 h和84 h时检测不同浓度精油处理后霉菌的OD600值(在波长600 nm处测定样品的光密度Optical density,OD600),与阳性对照组OD600值相近的最小精油浓度为香樟精油对灰绿曲霉的最小抑菌浓度[14]。
1.3.3 香樟精油对灰绿曲霉最小杀菌浓度的测定
按上述方法,配制浓度为8、4、2、1、0.5 μL/mL的香樟精油,并调节灰绿曲霉孢子浓度为105CFU/mL,未经精油处理的菌液作为空白对照,于恒温振荡箱中28 ℃培养24 h,取50 μL经精油处理的灰绿曲霉孢子液滴加在PDA培养基上,于恒温培养箱中28 ℃培养5 d,观察其生长情况,拍照记录。
1.3.4 香樟精油抑制菌丝生长活性的测定
按上述方法,将灰绿曲霉孢子悬浮液按5×105CFU/mL的浓度分别接种于含有0.5、1、2 μL/mL不同浓度香樟精油的PDB培养基中,以精油未处理组样品为对照组。于恒温振荡箱中28 ℃培养3 d后,收集菌丝体,于烘箱中60 ℃干燥至恒重,称重其干基[15];与对照组对比,计算菌丝生长的抑制率。公式如下:
菌丝抑制率=(WC-WS)/WC×100%
式中:WC为对照中的平均菌丝干重;WS为含有香樟精油的培养基中的平均菌丝干重。
1.3.5 香樟精油对孢子萌发的影响
将灰绿曲霉分别接种于PDA培养基上,于28 ℃静置培养,待其生长成熟后,用无菌水冲洗平板中菌丝,经纱布过滤制得霉菌孢子悬浮液;离心收集孢子,分别用含有0、0.5、1、2 μL/mL浓度的香樟精油PDB培养液重悬霉菌孢子,使孢子的最终浓度为105CFU/mL,置于28 ℃恒温孵育,并分别在6、9、12 h时在显微镜下观察,当孢子萌芽的长度比孢子直径长时,即判定为孢子萌发,计算霉菌孢子萌发率。
1.3.6 香樟精油对灰绿曲霉质膜中麦角固醇含量的影响
霉菌麦角固醇含量的测定方法如下:将霉菌孢子悬浮液按5×105CFU/mL的浓度接种于含0、0.5、1、2 μL/mL浓度香樟精油的PDB培养基中,28 ℃培养5 d,无菌水冲洗菌丝体,并在滤纸上过滤收集,置于25%的KOH醇溶液中,在85 ℃下孵育4 h,加入2 mL无菌水和5 mL正庚烷后振荡2 min后,将正庚烷层收集,并用UV-1700在230 nm至300 nm之间扫描。正庚烷层中麦角固醇(在282 nm)和麦角固醇的中间产物(脱氢麦角固醇在230 nm和282 nm)的存在导致了特征曲线。未经精油处理的样品为对照。麦角固醇含量的计算公式如下:
脱氢麦角固醇=(A230/518)/菌丝湿重
麦角固醇=(A282/290)/菌丝湿重-脱氢麦角固醇
式中:A230为230 nm处吸收峰的吸光度;A282为282 nm处吸收峰的吸光度。
1.3.7 扫描电子显微镜观察香樟精油处理对灰绿曲霉形态的影响
按上述方法培养,取适量灰绿曲霉孢子液分别加入0、0.5、1、2 μL/mL浓度的香樟精油,将样品于28 ℃培养24 h。取出孢子液离心(3 000 r/min,10 min),用磷酸盐缓冲溶液(PBS)重悬两次,加入戊二醛溶液于4 ℃固定4 h。用不同浓度的酒精溶液(30%、50%、70%、90%、100%)梯度脱水,叔丁醇置换酒精,喷金后用扫描电子显微镜观察[16]。
1.3.8 香樟精油处理对灰绿曲霉线粒体ATP酶活性的影响
根据上述方法收集 0、0.5、1、2 μL/mL浓度香樟精油处理的灰绿曲霉菌丝体,重悬于10 mL含有50 mmol/L Tris,2 mmol/L EDTA(乙二胺四乙酸),1 mmol/LPMSF(苯基甲磺酰氟)的缓冲液中后,将上清液转移到新的离心管中,以10 000 g离心30 min后用2%的葡萄糖溶液破坏细胞获得线粒体,并以2 000 g离心5 min,然后以10 000 g离心30 min。将10%的线粒体重悬于缓冲液中并储存于4 ℃备用。使用ATP酶试剂盒(A016-1-1)检测香樟精油处理霉菌中的线粒体ATP酶活性。
1.3.9 傅里叶红外光谱对香樟精油处理灰绿曲霉菌丝体的测定
按上述方法培养,将生长成熟的灰绿曲霉,分别用0、0.5、1、2 μL/mL浓度的香樟精油处理,所有样品均置于28 ℃培养24 h。离心(3 000 r/min,10 min),用PBS重悬2次,30 ℃烘干。烘干后的样品与光谱纯溴化钾按比例混匀,反复研磨制备成透明的薄膜压入颗粒中。将薄片放在红外光谱仪中进行红外光谱检测[17-19]。
1.3.10 流式细胞仪检测香樟精油作用后灰绿曲霉细胞的死亡情况
按上述方法培养,取适量灰绿曲霉孢子液离心(9 000 r/min,3 min),除去上清液,分别加入0、0.5、1、2 μL/mL浓度的香樟精油,振荡混合,所有样品均置于28 ℃培养24 h后离心,用PBS溶液冲洗,重悬两次,过膜。加入1 μg/mL PI(Propidium Iodide)染液,于35 ℃避光保存30 min[20]。用流式细胞仪进行检测。
1.3.11 实验数据处理
本文中所有实验均平行三次。运用SPSS 23.0软件统计对试验结果单因素方差分析(ANOVA)和邓肯方差分析(P<0.05),采用Origin 2018软件处理并绘制图表。
2 结果与分析
2.1 香樟精油对灰绿曲霉的最小抑菌浓度(MIC)测定
通过MIC和MFC定性和定量评估香樟精油的抑菌活性,由图1可以看出,不同浓度的香樟精油对灰绿曲霉具有良好的抑制效果。当香樟精油浓度达到1 μL/mL时,灰绿曲霉呈现出与阳性对照类似的生长趋势且为1 μL/mL,香樟精油处理后的菌体在600 nm下的吸光度与阴性对照相比无显著性差异(P>0.05),表明灰绿曲霉的MIC为1 μL/mL。
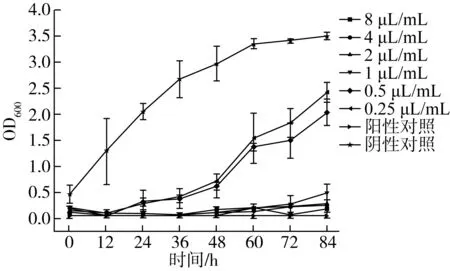
图1 不同浓度香樟精油对灰绿曲霉的生长抑制作用
2.2 香樟精油对灰绿曲霉最小杀菌浓度测定
灰绿曲霉孢子经不同体积浓度的香樟精油溶液处理后,孢子活力发生改变,在PDA培养基上的菌丝生长呈浓度依赖性抑制状态。当香樟精油的体积浓度为8倍MIC(8 μL/mL)及以上时,灰绿曲霉孢子在PDA培养基上不生长,由此可推测灰绿曲霉的最小杀菌浓度为8 μL/mL。
2.3 香樟精油抑制灰绿曲霉菌丝生长
随香樟精油浓度的增加,灰绿曲霉的菌丝生长受到不同程度的抑制。如表1所示,经过不同浓度(0、0.5、1和2 μL/mL)香樟精油处理3 d后其菌丝干重分别为0.47、0.26、0.16、0.09 g。与对照组比较,在0.5、1和2 μL/mL浓度精油对灰绿曲霉菌丝生长抑制率分别为23.32%、33.16%、66.58%、74.80%,经0.5 μL/mL及以上浓度香樟精油处理后的菌丝干重呈现显著性差异(P<0.05)。

表1 灰绿曲霉经不同浓度香樟精油处理的菌丝干重、麦角固醇及ATP酶活性变化
2.4 香樟精油抑制灰绿曲霉孢子萌发
如图2所示,空白组灰绿曲霉的孢子萌发率在6、9、12 h时分别为43.33%、77.33%和96%,未受精油处理的灰绿曲霉孢子在12 h内几乎全部萌发。而不同浓度精油处理组(0.5、1、2 μL/mL)的霉菌孢子在6 h几乎不萌发,1 μL/mL精油处理组的孢子萌发率在12 h时仅为27.33%,孢子萌发率受抑制效果显著(P<0.05)。由此可见,当灰绿曲霉孢子浓度为105CFU/mL时,0.5 μL/mL及以上浓度的香樟精油可有效抑制灰绿曲霉孢子萌发生长为菌丝体。

注:不同小写字母表示不同处理之间差异达0.05显著水平。图2 不同浓度香樟精油对灰绿曲霉孢子萌发的影响
2.5 香樟精油抑制灰绿曲霉质膜中麦角固醇的生成
麦角固醇是霉菌细胞膜的主要成分之一,麦角固醇含量是评价霉菌膜完整性的重要指标之一。如表1所示,灰绿曲霉经0、0.5、1、2 μL/mL浓度香樟精油处理后,灰绿曲霉质膜中麦角固醇含量分别为814.41、220.10、155.06、131.90 μg/g。因此,当香樟精油浓度达0.5 μL/mL及以上时,质膜中麦角固醇含量显著降低(P<0.05),霉菌细胞膜的组分发生了变化。麦角固醇含量的降低,往往伴随着细胞整体性被破坏和霉菌细胞膜通透性的改变。
2.6 扫描电镜检测香樟精油处理对灰绿曲霉菌体形态的影响
由图3可知,空白对照组中灰绿曲霉的孢子形态完整,圆润饱满,表面平滑。而用0.5 μL/mL体积浓度的香樟精油处理后,灰绿曲霉表面变得不平整,产生褶皱与凹陷,表明灰绿曲霉的细胞膜受到一定损伤;当浓度增加到1 μL/mL和2 μL/mL时,菌丝体形体遭严重破坏,扭曲变形。由此推测香樟精油导致菌丝体内含物流出[21]。

图3 扫描电镜观察不同浓度香樟精油处理后灰绿曲霉形态
2.7 香樟精油抑制灰绿曲霉ATP酶的活性
ATP酶可催化ATP分解为ADP和磷酸根离子,并在此过程中释放能量,为细胞供能。如表1所示,经过不同浓度(0、0.5、1、2 μL/mL)香樟精油处理3天后其菌丝体ATP酶活性分别为1.08、0.88、0.55和0.47 U/mgprot。随香樟精油浓度的增加,灰绿曲霉线粒体ATP酶活性降低。与对照组比较,0.5、1、2 μL/mL浓度香樟精油处理对灰绿曲霉ATP酶活性的抑制率分别为18.11%、48.76%和56.83%。结果显示,与对照组相比,处理组的线粒体ATP酶活性显著降低(P<0.05)且各处理组间差异显著(P<0.05),表明0.5 μL/mL及以上浓度的香樟精油可显著抑制灰绿曲霉的线粒体ATP酶活性(P<0.05)。ATP酶活性的降低可能会导致细胞内供能不足,使霉菌生长代谢紊乱从而干扰霉菌正常生理活动。
2.8 红外光谱检测香樟精油处理对灰绿曲霉组成成分的影响
利用红外光谱(FTIR)测定灰绿曲霉在香樟精油的作用下官能团变化情况,进一步了解其结构性质的改变。结合图表分析可以看出,3 400 cm-1谱峰相对强度有所减小,说明灰绿曲霉结构中羟基减少[25];2 910 cm-1谱峰相对强度减小,说明甲基(—CH3)和亚甲基(—CH2)含量减小;1 650 cm-1谱峰强度有所减小,表明有机羧酸含量减小[26];1 530 cm-1吸收峰强度减小,说明脂肪族化合物、木质素以及碳水化合物的量减小。1 380 cm-1处吸收峰强度减小,表明氨基含量减小;1 250 cm-1谱峰减弱表明C—O、Si—O减小;1 050 cm-1谱峰强度减弱,表明纤维素有少量的降解[27]。因此,随着香樟精油浓度升高,对灰绿曲霉作用增大,灰绿曲霉的组成物质逐渐被消耗,样品的光谱信息也随之改变。
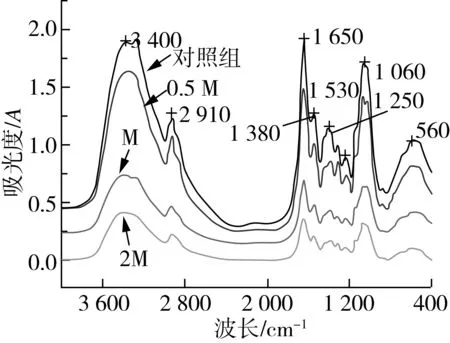
图4 红外光谱观察经不同浓度香樟精油处理后灰绿曲霉的表征变化

表2 ATR-FTIR光谱区的功能团特性[22-24]
2.9 流式细胞仪测定香樟精油对灰绿曲霉细胞膜完整性的影响
非通透性PI染液,不能穿透活细胞的细胞膜,只能穿过受损的细胞膜并对细胞核染色[28]。因此可用PI作为染液用流式细胞仪分析香樟精油对灰绿曲霉的膜完整性的影响[29,30]。由图5可知,随着香樟精油体积浓度提高,染色细胞增加,膜完整性破坏的程度也随之呈依赖性升高[31]。经过0.5倍MIC(0.5 μL/mL)的香樟精油处理后,灰绿曲霉的死亡细胞明显增长,推测是由于正常菌体细胞的细胞壁和细胞膜的完整性发生变化,引起自身溶解和死亡所致[32,33]。
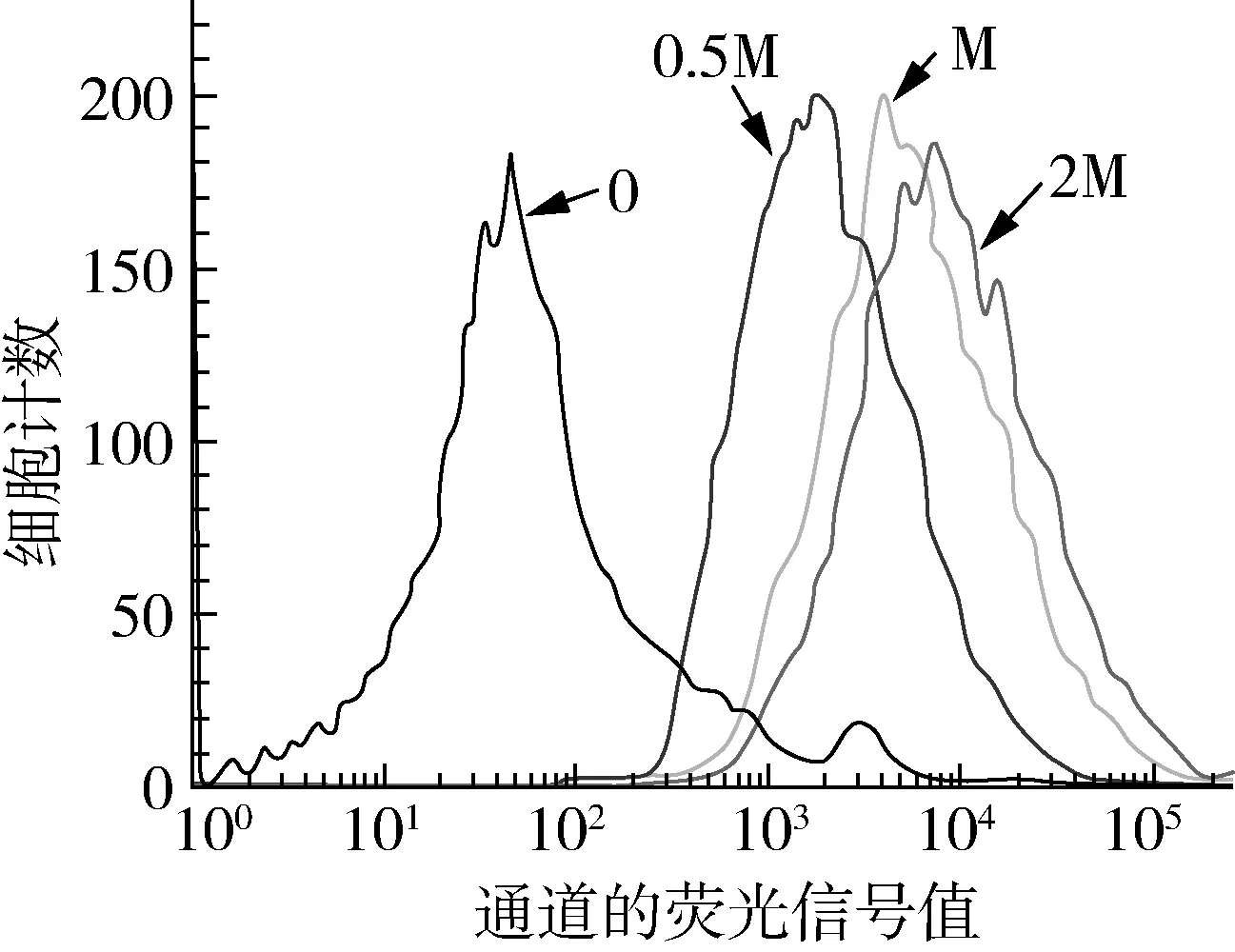
图5 流式细胞仪测定香樟精油对灰绿曲霉细胞膜完整性的影响
3 结论
本研究通过最小抑菌浓度、最小杀菌浓度、孢子萌发和菌丝干重对香樟精油的抑菌能力进行检测;通过麦角固醇含量、扫描电镜检测、线粒体ATP酶活性、红外光谱和流式细胞术等实验对香樟精油抑制灰绿曲霉的机理进行了探索。结果发现香樟精油对灰绿曲霉有很好的抑菌效果,其最低抑菌浓度为1 μL/mL,最低杀菌浓度为8 μL/mL,菌丝生长受到抑制。经0.5 μL/mL及更高浓度的香樟精油处理,灰绿曲霉菌落数显著减少,灰绿曲霉孢子表面产生褶皱与凹陷,且与对照组相比差异明显;随香樟精油浓度提升,孢子萌发率显著降低,孢子的凋亡情况也显著增强,精油体积浓度越高,香樟精油抑制灰绿曲霉的效果越显著。香樟精油处理后,灰绿曲霉细胞变形,霉菌表面明显受损。且精油浓度越高,霉菌受到的损伤越严重,精油处理会改变霉菌细胞的完整性与膜渗透性。因此,香樟精油抑制灰绿曲霉的作用方式主要是降低质膜中麦角固醇的含量,使细胞膜通透性增加,改变细胞膜内外平衡;使线粒体ATP酶活性降低,破坏其表面结构,最终达到抑菌效果。
综上,香樟精油作为抑菌剂,可有效抑制灰绿曲霉,为精油作为天然抑菌剂应用于粮食储藏提供了理论依据。后续可进一步对香樟精油作用于不同类型的储粮菌种以及复合精油的作用进行深入研究。
