高尿酸血症研究进展
2021-04-07孙泽锐王宣军
孙泽锐,王宣军,盛 军
(1.云南农业大学 普洱茶教育部重点实验室,云南 昆明 650201;2.云南农业大学 食品科学技术学院,云南 昆明 650201 3.云南农业大学 理学院,云南 昆明 650201;)
进入21世纪以来,我国社会经济水平不断提高,饮食也日益多样化.随着脂肪和嘌呤含量高的食物摄入增加,许多疾病的发生率也不断上升,高尿酸血症(hyperuricemia, HUA)便是其中之一.
在进化过程中,灵长类动物编码尿酸酶的基因发生了假基因化,导致人类自身无法转化尿酸,因而尿酸是人类嘌呤代谢的最终产物[1].正常的尿酸浓度对于人体是无害的,但现代社会的高能量、高嘌呤饮食习惯很容易打破体内的尿酸平衡,使得越来越多人的尿酸浓度超标而患HUA.HUA可导致弱水溶性尿酸盐饱和而以尿酸单钠晶体的形式析出,其偶尔出现在肾小管中导致肾结石,最常发生的是在关节滑膜液中累积引发痛风,而痛风是成年人最常见的关节炎类型[2].除此之外,HUA还与心血管疾病(CVD)、2型糖尿病(T2DM)、慢性肾病(CKD)等许多代谢性疾病有着紧密的联系[3].高尿酸血症的遗传率很高,约70%[4],这预示了高尿酸血症和痛风在基因遗传上的风险.在相关研究中,高尿酸血症增加了高血压的发病率[5],无症状的HUA将患高血压、慢性肾病和肥胖的风险提高了2~3倍[6].
相关流行病学研究表明,全球高尿酸血症的患病率为5%~25%[7],是继糖尿病之后的又一常见代谢性疾病.虽然我国缺乏权威性大规模流行病学调查资料,但据近几年来我国各地HUA患病率的研究和报道,目前大陆地区的HUA患者人数估计已达2亿[8],中老年男性与绝经后女性是其高发人群,而近年来HUA发病的年轻化趋势显著加剧,防控形势严峻.对此,本文综述了近几年来的高尿酸血症相关文献,以为高尿酸血症的后续研究提供一定的理论依据.
1 尿酸和HUA
1.1 尿酸与尿酸平衡
尿酸(UA),又称2,6,8-三羟嘌呤,是一种相对分子量为168的杂环羰基化合物.UA是一种弱酸,在血液中的酸度系数(pKa)约为5.8,尿液中的pKa约为5.35,其主要以尿酸阴离子存在于pH值为7.40的生理血液中[9],是一种强力的活性氧与过氧亚硝酸盐清除剂和抗氧化剂.UA主要在肝脏、肠道和其他组织如肌肉、肾脏和血管内膜中合成,是来源于动物的外源性嘌呤的最终产物[9-10].活的细胞也可以将它们的核酸、腺嘌呤和鸟嘌呤降解成尿酸.其合成流程是:首先,去氨基和去磷酸化作用转化腺嘌呤和鸟嘌呤生成肌苷和鸟苷;接着,嘌呤核苷磷酸化酶将肌苷和鸟苷分别转化为次黄嘌呤和鸟嘌呤;然后,次黄嘌呤和鸟嘌呤都通过黄嘌呤氧化酶转化为黄嘌呤;最后,黄嘌呤氧化酶又催化黄嘌呤进一步氧化为尿酸.
正常条件下,UA的合成与排泄是处于动态平衡的,且大多数日常尿酸的处理是通过肾脏进行的.UA在进入肠道后被肠道细菌代谢,这一过程称为肠道解尿酸,这占了UA消除的25%左右,剩余的75%主要靠肾脏排泄[11].循环中的尿酸盐大部分是游离的,蛋白结合率低于5%,因此大多数尿酸盐很容易被肾小球过滤,然而高达90%的尿酸盐随后可能被重吸收[12].多种尿酸盐转运蛋白在肾小管重吸收和尿酸盐分泌中起作用,从而帮助调节体内尿酸平衡,并将其水平维持在一定范围内.目前,确认的UA主要转运蛋白有葡萄糖转运体9(GLUT9)、尿酸转运蛋白1(URAT1)、有机阴离子转运体(OAT)、ABC转运蛋白G家族成员2(ABCG2)[11-12].尿酸酶可将尿酸代谢为高溶性的5-羟基尿酸盐,再进一步降解为尿囊酸和氨,易于排出.然而,包括人类在内的一些灵长类动物已经丧失了尿酸酶合成的功能,合成尿酸酶的mRNA可以在人类肝脏中检测到,但却提前出现终止密码子,因此该编码基因为假基因[9,12].
1.2 HUA的定义和诊断标准
HUA是指空腹状态下血液中尿酸盐的浓度高于正常饱和值(不同日的2次检测结果),其又分为有症状和无症状2种情况.大多数患有HUA的个体没有痛风之类的相关病症,这种仅有高尿酸浓度的现象被称作无症状高尿酸血症.无症状HUA会极大提高其他代谢疾病的患病率,而有症状HUA常与各种疾病合并在一起,特别是痛风.只有少部分HUA会发展为痛风,而痛风患者则一定会经历过HUA阶段.
诊断HUA的物理检测标准是,女性血液中尿酸盐浓度>6.0 mg/dL(>360 mol/L),男性>7.0 mg/dL(>415 mol/L),儿童和青少年>5.5 mg/dL(>330 mol/L)[8].
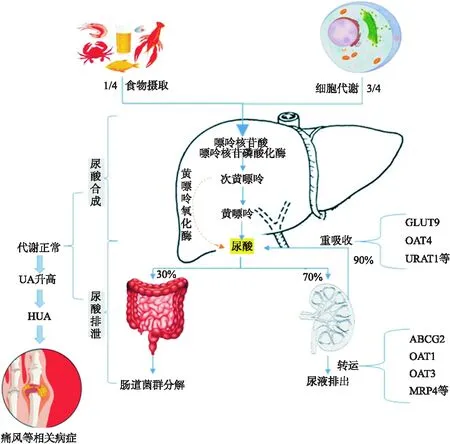
图1 尿酸代谢过程
1.3 HUA的机制
1.3.1 尿酸生成过多
如图1所示,人体内尿酸七成以上是由机体代谢生成的,其余部分是源于食物摄入[9].所以,尿酸合成过多是患HUA的主要原因之一.其有以下2种机制:①摄入富含嘌呤的食物,例如肉汤、海鲜、啤酒等,因为嘌呤是尿酸的前体物质,所以这类食物的摄入会增加人体内尿酸负荷而使HUA患者的病情加重;②合成代谢异常,占发病患者近20%[13],磷酸核糖焦磷酸合成酶(RPS)、黄嘌呤氧化酶(XOD)等UA合成中间代谢酶的浓度升高或活性增强会间接或直接地增加尿酸生成量.此外,果糖的摄入会增加嘌呤核苷酸的降解,而磷酸腺苷也可能进入嘌呤核苷酸降解途径,导致血清尿酸盐集中增加[14].
1.3.2 尿酸排泄减少
肾脏是尿酸的主要排泄器官,人体每天产生大约 800 mg 尿酸,其中2/3以上是从肾脏排出的[9,15].因此,肾脏在排泄体内尿酸、维持体内尿酸代谢平衡中起着非常重要的作用,其过程主要涉及到肾小球的滤过和肾小管的重吸收等作用.尿酸盐的肾排泄能力不足是导致血尿酸水平过高的一个重要原因,其是由多种转运体调节控制的.例如,有机阴离子转运蛋白URAT1、OAT1、OAT3及OAT4是尿酸排泄的重要转运蛋白.尿酸被OAT1和OAT3从血液中转运到肾小管,又通过URAT1与OAT4重新吸收到肾小管细胞中,以换取二羧酸[15].显然,阴离子转运蛋白的表达变化会影响尿酸的吸收和重吸收,从而使尿酸排泄减少,影响血尿酸浓度.ABCG2功能障碍导致的肠內尿酸盐代谢不足及肾脏尿酸排泄超负荷也是引起HUA的一个重要因素.
1.4 HUA的流行病学研究
流行病学数据表明,美国成年人的HUA患病率高达21.4%[16],而且随着时间的推移,这一数字还在继续增大.在美国人中,非裔的患病率比其他种族的人稍高(25.7%对22.1%)[16].意大利的数据表明,在2005年至2009年期间,以尿酸值 6.0 mg/dL (360 mol/L)为界,患病率有所上升(从8.5%至11.9%)[17].台湾土著人口有着全世界高尿酸血症最高的患病率,为41.4%[18].导致HUA患病率增加的因素包括上述饮食模式和代谢物质的改变、预期寿命的延长、肥胖率的增加以及利尿剂等药物的长期使用.吕雪霞等[8]在调查健康体检人群中随机抽样分析得到,其HUA患病率为11.67%,其中男性为15.31%;女性为4.81%.魏晓珠等[19]在深圳沿海地区 2 753 人的研究中发现,HUA患病率为15.44%,其中男性为18.27%,女性为11.55%,处于国内较高水平.相关患病数据显示,性别和年龄的增长也是HUA的重要影响因素,男性比女性更容易患高尿酸血症[8,19].Masanari等[20]的流行病学研究发现,血清尿酸水平还与高血压、心房纤维化等疾病的发生有关.
1.5 HUA的中医理论
HUA在中医传统书籍中无明确的命名,历代医家将其归为“痛风”“历节”“虎咬风”等范畴[7],其病位主要在脾肾.目前中医界广泛认为HUA的病因是禀赋不足、七情内伤、外感六淫、饮食不节[21];其病机[22]为脏腑亏虚,湿、痰、瘀阻血脉,酿生浊毒而致,属本虚标实之证,本虚为脾虚、肾虚、脾肾亏虚、肝肾阴虚,标实为湿浊、湿痰、痰瘀、瘀血阻滞.
2 HUA与相关疾病的关系
尿酸是人体嘌呤代谢的最终产物,大部分的尿酸(>70%)通过肾脏排出.一旦尿酸浓度超出生理范围,就会引起多种病理反应,如氧化应激、细胞凋亡和炎症.就人体血液而言,饱和尿酸盐的浓度约为 400 μmol/L[21],所以从理论上我们可以推测,当尿酸盐浓度超过 415 μmol/L 时会析出晶体,积累在血管壁、肾小管、关节面等部位,从而直接或间接引起代谢综合征、内皮功能障碍、肾功能障碍等一系列相关病症[23],其中关联最密切的是痛风和肾结石.
2.1 HUA与痛风
HUA可导致尿酸盐过饱和而析出尿酸钠晶体,所以HUA是痛风发生的先决条件[9],血尿酸盐浓度与痛风发病之间存在明显的浓度依赖关系.Lisa K等[24]的数据分析证实了HUA的程度与痛风发生风险之间的关系.其中,血液尿酸水平小于 6 mg/dL 的人群,15年累积发病率为1.1%;浓度为8~8.9 mg/dL 的人群,15年累积发病率为16.3%,浓度大于 10 mg/dL 的人群,15年累积发病率为49%,这表明血尿酸浓度是痛风发生的一个强的非线性因素.
2.2 HUA与肾病
尿酸分泌增加、肾尿酸排泄受损或两者结合都可导致HUA产生,而HUA会增加急性肾损伤的风险,损害球囊内毛细血管细胞的收缩性[25],并可能通过TLR4上调炎性小体NLRP3和炎症因子IL-1β的含量而导致肾小管上皮细胞受损[26].HUA通过内皮细胞损伤、激活NLRP3炎症小体、刺激TLR诱导炎症因子和血管平滑肌增生,被证明是2型糖尿病和慢性肾病的一个重要因素[27].此外,尿酸可在肾脏内积聚,导致结石的形成.尿酸结石在所有肾结石中占10%,是泌尿系统结石病的第二大来源,仅次于草酸钙结石和磷酸钙结石.尿酸盐结晶及结石形成的最重要原因是尿液pH值降低,这是由于体内尿酸过多造成的,与HUA息息相关[9,25].虽然慢性肾病与HUA的联系紧密,但尚不清楚降低血尿酸值是否就一定能减缓慢性肾病的进展.
2.3 HUA与2型糖尿病
HUA也是2型糖尿病(T2DM)的诱发因子之一,通常先于胰岛素抵抗和2型糖尿病而发生[28].研究发现,四分之一的糖尿病病例可归因于血尿酸水平过高[29],因而HUA与胰岛素抵抗和T2DM关系紧密,血尿酸水平是中老年人患糖尿病的1个强力因素.此外,血尿酸水平的升高与T2DM患者蛋白尿与视网膜病变的病况加重也有关联[30].糖脂代谢过程中,胰岛素抵抗可以增加血尿酸的生成,同时使肾小管对尿酸的重吸收作用加强,而高血脂、高胰岛素也让肝脏的脂肪酸合成增加,生成更多的嘌呤,最终又导致血尿酸水平上升,这些相互的因果关系使得病症加深.
2.4 HUA与高血压
Lee等[31]的研究发现,HUA可预测65岁以上女性的高血压,但在男性中未发现这种关联.在60岁之内的男性中,HUA增加了大约30%的高血压患病风险.而对于40岁以下的女性,这个风险增加了2.6倍.一项对501名儿童和青少年(6岁至18岁)进行的风险评估发现,血液尿酸水平平均每增加 1 mg/dL(60mol/L),其患高血压的风险比正常的儿童增加50%以上[32].由此可见,HUA与各年龄段的高血压发生和发展有着密切的关系.HUA可以通过降低NO浓度等方式引发高血压,而高血压也会使得尿酸排泄减少,从而加重HUA.
2.5 HUA与内皮功能障碍
黄嘌呤氧化酶(XOD)催化嘌呤代谢生成尿酸(UA),而在嘌呤代谢过程中伴随UA生成的同时会产生包括活性氧在内的超氧化物.超氧化物与一氧化氮(NO)反应使内皮功能恶化,导致NO生物利用度降低、过氧亚硝酸盐等活性氧化剂的生成增加.临床研究表明[33],对于有心血管危险的患者,使用XOD抑制剂可以恢复其内皮功能障碍.因此,黄嘌呤氧化酶可能是治疗内皮功能障碍的一个靶点.虽然有实验研究发现[34],尿酸可通过增加氧化应激和炎症引起内皮功能障碍,但体内尿酸对内皮功能的实际生物学影响尚未完全阐明.所以,尿酸本身是否是人类内皮功能障碍的一个独立的因果因素还没有完全确定,而HUA是否会引起内皮功能障碍也尚在研究中.
3 HUA的动物模型
由于鼠类动物繁殖快、价格低、好管理等各种优势,实验常用大鼠或小鼠进行HUA动物模型的建立.但鼠类动物自身可以合成尿酸酶,故常选择氧嗪酸钾等尿酸酶抑制剂参与造模[35].动物实验流程如图2所示,常用造模方法[36]:急性HUA小鼠模型,分别于腹腔和皮下注射次黄嘌呤和氧嗪酸钾;慢性HUA大鼠模型通过灌胃造模,每天先灌胃腺嘌呤溶液,约 2 h 后再灌胃乙胺丁醇盐酸盐.
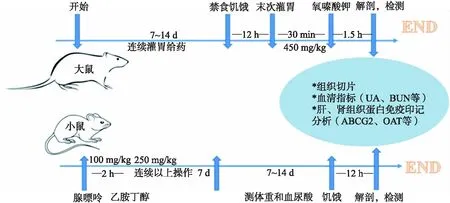
图2 高尿酸血症动物模型实验
4 HUA的药物治疗研究进展
目前,抗HUA药物主要有3类[37],分别是XOD抑制剂(别嘌呤醇、非布索坦等)、URAT1抑制剂(苯溴马隆、丙磺舒、磺吡酮等)、尿酸氧化酶类似物(拉布立酶、培戈洛酶等),如表1所示.

表1 常见降尿酸药的类型和毒副作用

续表1
由于HUA的发生机制,其治疗主要有减少尿酸生成和增加尿酸排泄2个途径.但无论是否考虑HUA的机制,黄嘌呤氧化酶抑制剂(XOIs)的使用最为广泛,其中别嘌呤醇和非布索坦被认为是治疗普通痛风患者的一线药物[38].HUA的无症状患者也经常开这些药来降低血尿酸浓度,从而缓和或改善心血管疾病、肾脏功能及炎症,尽管这种做法在已发表的有关研究和建议中是存在异议和不确定性的.
4.1 减少尿酸生成
4.1.1 别嘌呤醇和非布索坦
减少尿酸合成的药物主要作用靶点是XOD,XOD抑制被认为是抗HUA的一线治疗方案,其常用抑制剂是别嘌呤醇和非布索坦,被广泛应用于患者治疗与科学研究中.由于别嘌呤醇在体内迅速代谢成氧嘌呤醇,并主要由肾脏排泄.因此,随着肾功能恶化,其消除率下降.相比之下,非布索坦主要由肝脏代谢,其消除对肾脏功能的依赖性较小.在临床试验中,与固定或有剂量限制(最大200~300 mg/d)的别嘌呤醇相比,非布索坦具有更好的降低尿酸盐水平作用[39].但是对于大多数患有痛风的个体来说,为达到目标尿酸盐浓度,别嘌呤醇每天剂量最高为 900 mg[38].许多变量会影响达到血尿酸盐浓度目标所需的别嘌呤醇剂量,包括血尿酸盐最初浓度,体重,肾功能和ABCG2基因型.
这2种药物都存在潜在的严重副作用.对于别嘌呤醇而言,最大的担忧是罕见但可能致命的别嘌呤醇超敏综合征(AHS).AHS通常发生在别嘌呤醇治疗后的头几个月,目前已发现了几种诱发因素,包括别嘌呤醇的起始剂量较高、等位基因HLA-B×5801变异,肾功能损伤、利尿剂的使用等.HLA-B×5801与别嘌呤醇引起的严重皮肤病密切相关,该病症在亚洲人尤其是中国人群中更为常见[40].欧洲和美国的风湿病学会均建议别嘌呤醇的最大起始剂量为 100 mg/d,对于中度及重度肾功能损害的患者为 50 mg/d,否则其患病风险要高出11倍[41].更严重的是,别嘌呤醇和硫唑嘌呤之间的相互作用可能会导致致命的血液毒性[39].虽然非布索坦相对别嘌呤醇更为安全,但据美国食药监局(FDA)的临床调查显示,非布索坦的心血管事件发生率比安慰剂更高[41].
4.1.2 新型XOIs
Topiroxstat(托匹司他)是一种非嘌呤类的XOIs,可显著降低接受血液透析的高尿酸血症患者的血尿酸水平,并可保护糖尿病引发肾病患者的肾功能[42].Topiroxstat的降尿酸作用要比别嘌呤醇强且更安全,不影响心血管系统.Ulodesine是一种作用于嘌呤代谢上游的降尿酸新药,正处于临床试验阶段,可与别嘌醇联合使用,效果较好.降尿酸肽是一类正处于研究开发阶段的XOIs,其在HUA中具有良好的应用前景,但具体机理和适用范围还需要进一步研究[43].
4.2 增加尿酸排泄
促进尿酸排泄的药物作用靶点是一系列的转运蛋白,例如在重吸收过程作用的URAT1、OAT4、GLUT9,主导排泄的OAT1、OAT3、ABCG2等.
4.2.1 丙磺舒、苯溴马隆、磺吡酮
研究表明,通过抑制重吸收尿酸转运蛋白来降低血尿酸是可行的,但许多传统药物的副作用大大限制了它们的使用.例如,丙磺舒在降低血清尿酸盐方面有一定的效果,但与XOIs相比使用起来不方便,通常需要每天服用.因为丙磺舒会增加尿酸的排泄量,进而会增加肾结石的风险,所以其不能用于肾小球滤过率GFR<50 ml/min 的患者和尿石症患者[44],此外,丙磺舒又和较多药物有不良的相互作用,因此通常以其他治疗方式为首选.苯溴马隆是一种更强效的降尿酸剂,但由于担心肝毒性,目前尚未广泛应用.同样,由于广泛的药物相互作用和相关的不良后果,磺吡酮已从美国市场停止销售.
4.2.2 其他新型药物
Lesinurad是1种新型的URAT1和OAT4抑制剂[45],不良表现是肾毒性风险高,且呈剂量依赖性,安全风险较高;Verinurad是1种URAT1抑制剂[46],目前正在开发中,用于治疗痛风和无症状高尿酸血症.在单药治疗中,它与肾衰竭和肌酐水平升高有关;曲尼司特(Tranilast)是1种抗炎药,它通过与重吸收尿酸转运蛋白URAT1、GLUT9、OAT4和OAT10的相互作用而呈现促进尿酸排泄的性质[47];作为新型URAT1抑制剂的RDEA-3170(RDEA-684)和URC-102(UR-1102)已进行了相关临床研究,不久将会投入使用.
4.3 尿酸氧化分解
尿酸氧化酶(UOX,也称为尿酸酶)是作用于的嘌呤代谢的重要酶,其可以使尿酸转化成尿囊素与过氧化氢.UOX广泛存在于活生物体中,但为人体所缺乏,由于已经确定了许多微生物的UOX基因序列,所以常利用微生物生产相关制剂,以进行HUA和痛风的生物治疗.
4.3.1 一代尿酸酶
Sanofi Winthrop公司生产的Uricozyme是尿酸酶一代制剂[48],此酶是直接由黑曲霉或黄曲霉发酵而得的非重组酶.一代制剂的优点是起效速度快、疗效显著、可保护肾功能.其毒理学实验发现,一些超敏反应也常伴随给药发生,不过几小时后便可消除.又因为Uricozyme失活快,须每天补充且具有免疫原性,所以不适合长期使用[47].
4.3.2 重组尿酸酶
酵母菌培养液中提取的拉布立酶(Rasburicase)是一种重组的第2代尿酸酶制剂,其降UA作用迅速,效果强于别嘌呤醇[49].聚乙二醇重组尿酸酶Pegloticase(培戈洛酶)被认为是一个第三线降尿酸的选择,这是适用于严重患者的有效治疗方案[50].培戈洛酶已在美国和欧盟批准上市.与其他生物疗法一样,培戈洛酶可能与输液反应相关,并且抗体的形成会导致过敏和输液反应风险增加.
4.4 辅助药物
常用辅助治疗药物主要是控制急性炎症的抗炎药物[47,49],有Colchicine(秋水仙碱)、Anakinra(阿那白滞素)、Rilonacept(利纳西普)、Canakinumab(康奈单抗)等.这类辅助药物能有效减轻急性痛风性关节炎等HUA并发症,但同时不良反应也较多,副作用巨大,需要谨慎使用.
4.5 中医药治疗HUA概况
4.5.1 中医单药
据中药相关药理研究,单味中药也有助于降低尿酸.如大黄、车前子、木瓜、玄参、金钱草等是具有抑制黄嘌呤氧化酶的活性作用的中药材;而土茯苓、当归、白芍、生薏仁、地龙等中药则可以减少尿酸的合成;至于促进尿酸排泄上,有秦皮、泽泻、栀子、滑石等利尿的中药.在治疗HUA的处方中,大多数都含有这些单一药物,并且在临床上已证明单一药物也可有效减少尿酸[21].
4.5.2 中医复方
中医复方治疗方法又分治标和治本两大类.在治标上,梁国强等[22]认为HUA病机根本是脾肾亏虚,而湿、热、痰、瘀为其标.用吴门三黄汤(黄连、黄芩、大黄等)做大鼠实验,发现该方主要借助调节尿酸转运蛋白的方式以减少尿酸.朱良春[51]常用土茯苓、苡仁、泽兰、徐长卿等,配合红花、鸡血藤、蜈蚣等通络祛瘀之品,以达泄浊解毒,经络畅通,能改善病况,有效降低尿酸.在治本上,钱先等[52]认为HUA属本虚标实,脾肾亏虚于脾运失调是其病机之本,故常以防己黄芪汤和独活寄生汤为基础进行治疗.徐红等[53]自制的芪苓颗粒(黄芪、土茯苓、丹参、薏苡仁等)的14 d大鼠灌胃实验发现,该中药配方不仅可以降尿酸,还能促进糖脂的代谢而不损害相关代谢器官.
4.5.3 中医理疗
苗兵[54]的针刺结合降尿酸方防治HUA的方法已医治HUA患者30例,研究表明其法能有效降低血脂和血尿酸.李博[55]的穴位埋线法在对于30例腹型肥胖HUA患者的治疗中效果较好,可见针刺与穴位埋线均能减小血尿酸和腹围.鲍玉晓[56]以针刺配合火罐,加上冰片外敷的方法治疗急性痛风关节炎.结果显示,相比秋水仙碱治疗,该理疗方法更能有效缓解症状.
5 总结与展望
目前已知,嘌呤摄入过多、相关代谢酶和转运蛋白的异常都会使体内尿酸失去平衡,而治疗HUA也往往从这几个异常点入手,通过药物控制尿酸的代谢和排泄,并减少嘌呤和酒精等物质的摄入.随着HUA成为高发的代谢疾病,HUA的研究将更加趋向多样化,特别是其潜在机制和治疗方法的联用,如中医理疗和药物治疗的结合,这使得未来将有更多的治疗技术与手段得以发现.相关毒理学研究可以让人们选择适当的治疗药物,而避免过强的副作用伤害.另外,许多新型药物或药食两用物质正在研究当中,其临床数据尚有不足,作用机制也暂不透彻,须进一步的深入探究与临床实验,从而为将来的应用提供科学的依据.
