黄芪多糖促进顺铂抑制卵巢癌细胞增殖的机制研究
2021-04-07李彩虹高巧玲罗幼珍
李彩虹 高巧玲 罗幼珍
(三峡大学 第一临床医学院[宜昌市中心人民医院] 妇产科, 湖北 宜昌 443003)
近20年来,卵巢癌发病率以每年0.1%的速度增长,全球每年新发约238 700 例,严重危害女性身心健康[1]。但在过去30年中卵巢癌患者预后始终没有显著提高。由于缺乏早期特异性临床表现和诊断方法,大多数患者确诊时已达晚期,患者5年存活率从诊断I期的90%降为Ⅳ期的4%,晚期患者5年生存率仍不足30%,致死率高居女性生殖系统肿瘤首位[2]。导致卵巢癌预后差的主要原因是卵巢癌细胞容易对化疗药物产生耐药性。约25%的确诊患者对铂类制剂不敏感,严重影响卵巢癌患者的化疗效果,显著降低了患者的5年生存期,同时药物副作用降低患者生存质量[3]。
近年来,采用某些中药或复方制剂达到协同化疗药物治疗的用药思路备受国内外众多学者青睐。中药因其毒副作用小、作用范围广,在肿瘤发生发展过程中发挥极为广泛的作用[4]。
黄芪多糖(astragalus polysacharide,APS)是黄芪的主要成分之一,具有益气补虚之功效。随着研究的深入,学者发现APS在调节免疫功能、抗毒性、心脏保护、促进骨髓间充质干细胞增殖和成骨分化中起着重要作用[5, 6]。近年来,其抗肿瘤作用也成为学者研究的热点。APS是否对卵巢癌的化疗产生作用,目前尚无相关报道。本实验拟通过观察APS对卵巢癌SKOV3细胞顺铂(cisplatin,DDP)化疗的影响,并探讨其可能的分子机制,以期为APS联合化疗改善卵巢癌预后提供实验依据。
1 材料与方法
1.1 细胞来源及培养
SKOV3细胞购自武汉巴菲尔生物技术有限公司。用含10%胎牛血清和1% Penicillin-Streptomycin Solution(Hyclone,美国)的MC5A培养基(Sigma,美国),置37℃、5%CO2饱和湿度培养箱内培养。
1.2 药物和试剂
DDP注射液购于江苏豪森药业有限公司(批号:Z20040813),注射用APS购于天津赛诺制药有限公司(批号:Z20040086),纯度≥95%。碘化丙啶(propidium iodide,PI)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)购买于Sigma公司。抗生素,DY14011,由Hyclone公司生产。0.25% Trypsin,购自Gibco公司(批号:15050065)。胎牛血清,购自Hyclone公司(批号:SV30087.02)。细胞凋亡检测试剂盒购自南京凯基生物(货号:KGA108)。兔抗Bax、兔抗Bcl-2、兔抗Caspase-3、小鼠抗β-Actin均购自武汉三鹰生物技术有限公司。
1.3 MTT比色法检测各组SKOV3细胞增殖情况
取对数生长期且生长状态良好的SKOV3细胞,调整细胞密度到5×104/mL,以100 μL/孔接种96孔板。根据不同药物及浓度进行分组:APS组(浓度分别为50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL、800 μg/mL、1 600 μg/mL),DDP组(浓度分别为5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、160 μg/mL),联合组(APS浓度分别为50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL、800 μg/mL、1 600 μg/mL,DDP浓度为10 μg/mL),另设对照组(有细胞含培养液和溶剂),空白组(无细胞只含培养液)。每组3个复孔,置37℃、5%CO2饱和湿度的培养箱内分别培养24 h、48 h、72 h。每孔加入10 μL MTT,37℃培养4 h,吸出培养基,加入150 μL DMSO震荡10 min,30 min内于酶标仪上568 nm处测定其吸光度(A)值用于计算细胞增殖抑制率,计算方法如下:抑制率(%)=(1-A实验组/A对照组)×100%。为评估联合用药的两药作用方法,按金氏公式求出q值进行判断:q=E(a+b)/(Ea+Eb)-Ea×Eb,其中E(a+b)为两药联合使用时的抑制率,Ea及Eb为各药单用时的抑制率。所测值意义:当q<0.85时,表示两药拮抗;q>1.15时,表示两药协同;0.85≤q≤1.15时,表示两药作用相加。以上实验重复3次。
1.4 流式细胞仪分析各组SKOV3细胞的细胞周期比例及凋亡率
细胞分为对照组、DDP组(终浓度为10 μg/mL)、APS组(终浓度为800 μg/mL)及联合组(DDP终浓度为10 μg/mL,分别联合200 μg/mL、400 μg/mL、800 μg/mL、1 600 μg/mL APS)。各组细胞经药物处理后常规培养24 h,用不含EDTA的0.25%胰酶消化收集SKOV3细胞, 1 200 rpm离心5 min,去上清后加PBS重悬,使用PBS清洗细胞2次。
采用细胞凋亡检测试剂盒(AnnexinV-APC/7-AAD)进行染色,流式细胞仪上机检测。细胞周期检测:细胞离心后弃上清,PBS清洗2次,缓慢加入预冷的80%乙醇700 μL,乙醇终浓度为70%, 4℃固定24 h以上,1 000 rpm离心5 min,预冷PBS清洗2次;加入50 μg/mL RnaseA 100 μL,37℃水浴30 min,加入50 μg/mL PI 400 μL,4℃避光染色30 min后检测。以上实验重复3次。
1.5 Western blot检测各组SKOV3细胞中Bax、Bcl-2、Caspase-3蛋白的表达
细胞根据前述分组处理24 h,收集细胞加入细胞裂解液提取细胞总蛋白。根据BCA试剂盒操作说明检测样品蛋白浓度。蛋白变性后以10% SDS-PAGE胶电泳分离Bax,以12%SDS-PAGE胶电泳分离Bcl-2、Caspase-3,再将其转移到PVDF膜,室温封闭2 h,一抗4℃孵育过夜,TBST充分洗涤PVDF膜后,加入辣根过氧化物酶标记的二抗,室温孵育2 h,ECL法显影,摄片。
1.6 RT-PCR检测各组SKOV3细胞中Bax、Bcl-2、Caspase-3的mRNA表达
细胞根据前述分组处理后,收集细胞,Trizol法提取RNA, 根据OD260/OD280比值,估测RNA质量,比值在1.8~2.0之间满足实验要求。计算样品RNA的浓度。逆转录成cDNA,行RT-PCR检测。反应条件:94℃ 4 min;94℃ 30 s,56℃ 30 s,72℃ 25 s,30个循环;72℃ 4 min,4℃ 4 min。行溶解曲线,最终数据以2-△△Ct方式进行分析。实验所用引物序列如下:
β-actin: Forward 5’-AGCGAGCATCCCCCAA-AGTT-3’,Reverse 5’-GGGCACGAAGGCTCATCATT-3’(285 bp);
Caspase-3: Forward 5’-AGAACTGGACTGTGGCATTG-3’,Reverse 5’-CTTGTCGGCATACTGTTTCA-3’(190 bp);
Bcl-2: Forward 5’-GCCTTCTTTGAGTTCGGTGG-3’,Reverse 5’-GAAATCAAACAGAGGCCGCA-3’(192 bp);
Bax: Forward 5’-GGATGCGTCCACCAAG-AAG-3’,Reverse 5’-GTTGAAGTTGCCGTCAG-AAAA-3’(163 bp)。
1.7 统计学方法
2 结果
2.1 APS和DDP对SKOV3细胞增殖的影响
经MTT法检测,DDP单药组伴随药物浓度增加及培养时间的延长,对SKOV3细胞增殖的抑制率明显增高(P<0.05),呈浓度和时间依赖性(见图1A)。单药APS组培养24 h,随药物浓度的增加对细胞增殖的抑制率增高,呈浓度时间依赖性,差异有统计学意义(F=154.99,P=0.000)。当培养时间延长至48 h和72 h时,不同浓度APS对细胞增殖抑制率的差异无统计学意义(F=2.509,P=0.089;F=1.716,P=0.205)(见图1B)。联合用药组,DDP为10 μg/mL时,随着APS浓度的增高及培养时间的延长,SKOV3细胞增殖的抑制率明显增加(P<0.05),呈显著浓度和时间依赖性(见图1C)。
与单用10 μg/mL DDP相比,10 μg/mL DDP+800 μg/mL APS的联合用药组24 h、48 h和72 h时细胞增殖抑制率均明显升高(见表1)。10 μg/mL DDP联合APS作用于SKOV3细胞24 h、48 h时,当APS浓度达到100 μg/mL后,q>1.15,两药表现出协同作用。在培养72 h时,0.85≤q≤1.15时,两药合用有相加作用(见表2)。
参照查阅文献及MTT实验检测结果,24 h时DDP半数抑制率为10±3.45 μg/mL,最终拟定后续联合用药中DDP终浓度为10 μg/mL,药物作用时间为24 h。
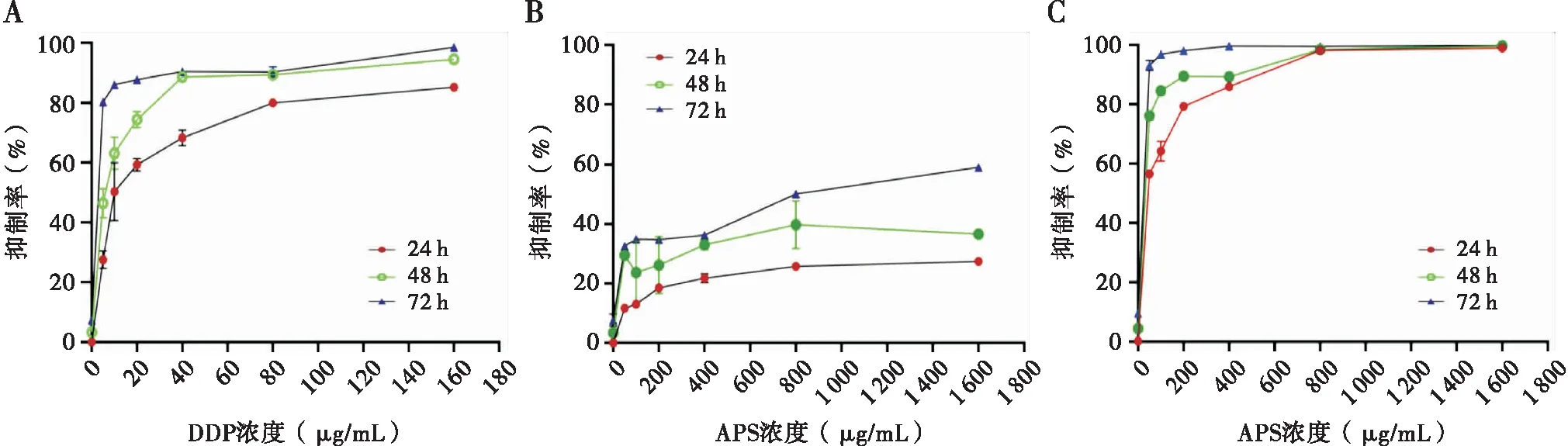
注:A:不同浓度DDP对SKOV3细胞增殖抑制率; B:不同浓度APS对SKOV3细胞增殖抑制率;C: 10 μg/mL DDP联合不同浓度APS对SKOV3细胞增殖抑制率图1 APS和DDP对SKOV3细胞增殖抑制率的影响

表1 DDP组与DDP+APS组不同时间点SKOV3细胞增殖抑制率的比较
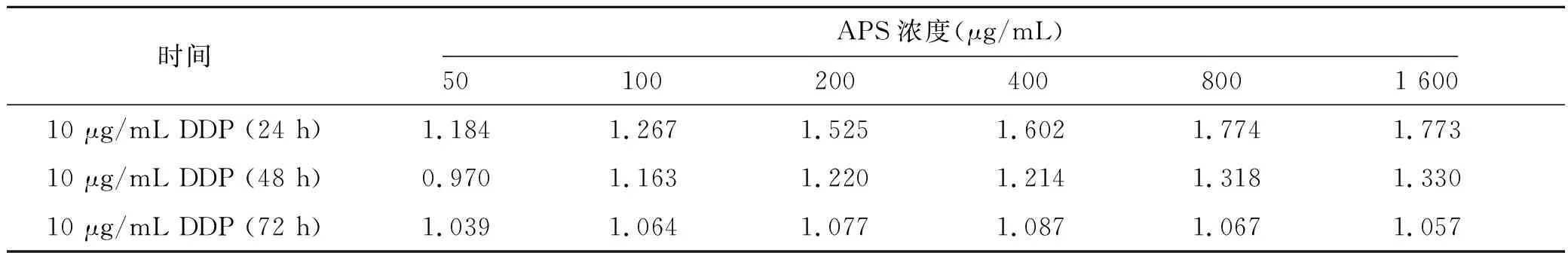
表2 10 μg/mL DDP联合不同浓度APS对SKOV3细胞增殖抑制率的q值
2.2 APS和DDP对SKOV3细胞凋亡的影响
培养24 h后,与单用10 μg/mL的DDP相比,随APS浓度的增加细胞凋亡数逐渐增高,各组间凋亡率具有统计学差异(F=71.867,P=0.000)。联合用药组中,APS浓度为200 μg/mL与400 μg/mL间(P<0.05),400 μg/mL与800 μg/mL间(P<0.01),800 μg/mL与1 600 μg/mL间(P<0.01),差异均有统计学意义(见图2)。
2.3 APS和DDP对SKOV3细胞中Bax、Bcl-2和Caspase-3蛋白表达的影响
SKOV3细胞经药物处理培养24 h后,随着APS浓度的增高,细胞中Bcl-2的表达逐渐减少,Bax、Caspase-3蛋白表达逐渐增多,Bax/Bcl-2比值逐渐升高,差异均有统计学意义(均P<0.05)(见图3)。
2.4 APS和DDP对SKOV3细胞中Bax、Bcl-2和Caspase-3 mRNA表达的影响
RT-PCR检测结果显示,随着APS浓度的增高,细胞中Bcl-2 mRNA表达逐渐降低,组间比较差异有统计学意义(均P<0.05);Bax和Caspase-3 mRNA表达随APS浓度增高逐渐增加,组间比较差异有统计学意义(均P<0.05)(见图4)。
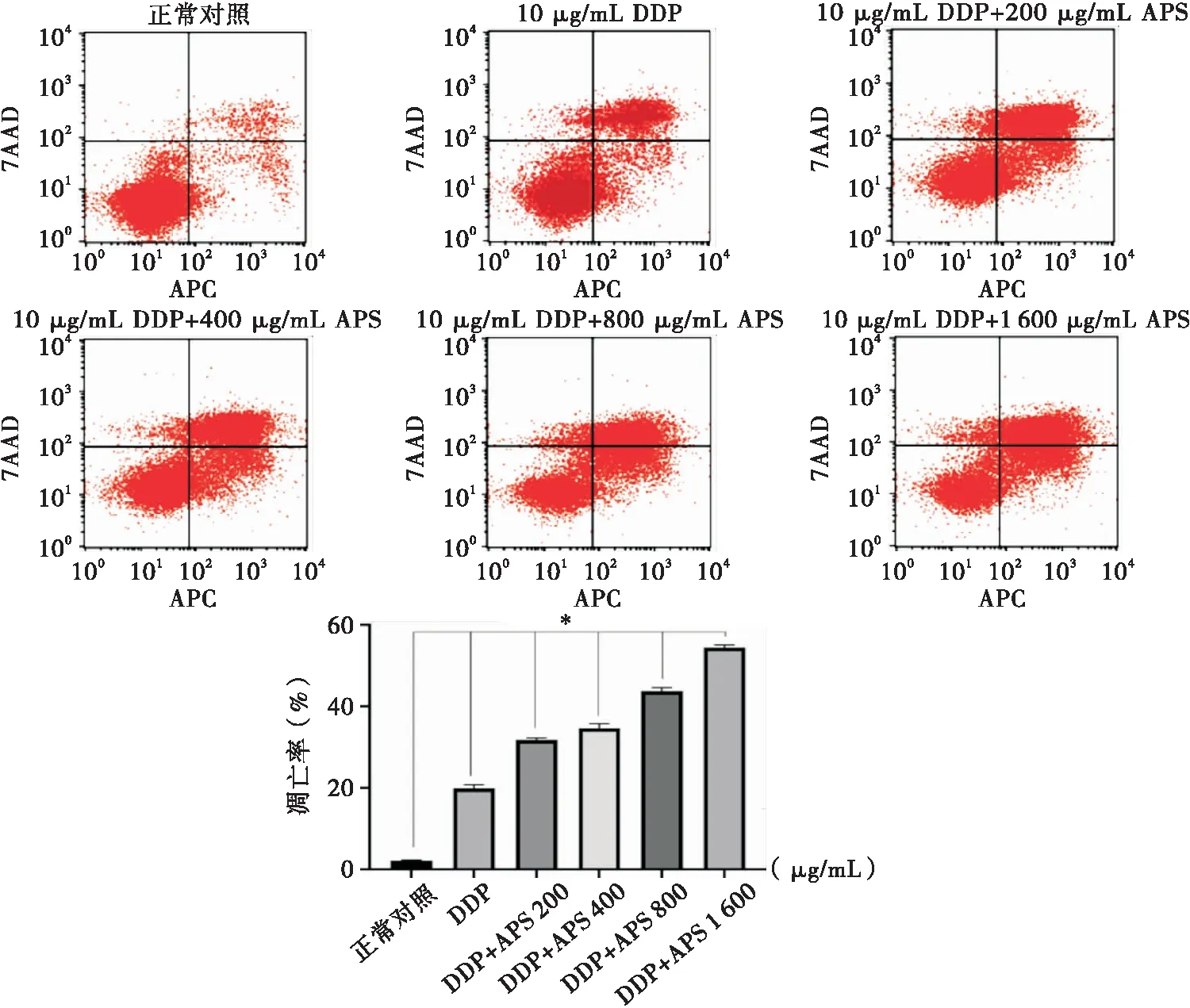
注:各组间比较,*P<0.05图2 药物作用24 h后SKOV3细胞凋亡情况

注: A:代表性蛋白条带图,1:对照组; 2:10 μg/mL DDP; 3: 800 μg/mL APS; 4:10 μg/mL DDP+200 μg/mL APS; 5:10 μg/mL DDP+400 μg/mL APS; 6:10 μg/mL DDP+800 μg/mL APS; 7:10 μg/mL DDP+1 600 μg/mL APS; B~D:以β-actin为内参,Bax、Caspase-3和Bcl-2的相对蛋白表达水平; E:Bax/Bcl-2比值变化; 与对照组相比,*P<0.05,**P<0.01图3 APS和DDP对SKOV3细胞中Bax、Bcl-2和Caspase-3蛋白表达的影响
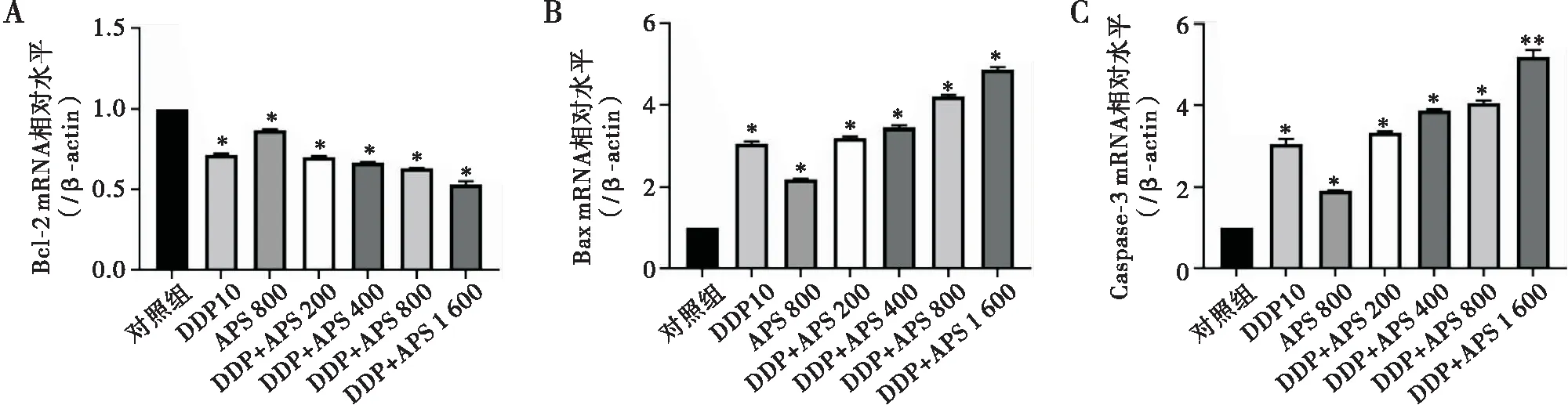
注:A~C:以β-actin为内参,Bax、Bcl-2和Caspase-3 mRNA的相对表达水平;与对照组相比,*P<0.05, **P<0.01图4 APS和DDP对SKOV3细胞中Bcl-2、Bax和Caspase-3 mRNA表达的影响
3 讨论
APS的结构特点由其分子量、单糖序列构成、糖苷结合位置结构、侧支类型及聚合程度、 以及空间结构等因素共同决定。研究表明,大多数APS为杂多糖,分子量为2.1104、4.8106、8.7103、3.6104 的单糖成分具有抗肿瘤作用[7]。
研究者发现,低浓度APS使人结肠癌细胞中增殖细胞核抗原表达降低,增殖减慢,凋亡增加,提示APS有抑制人结肠癌细胞增殖的可能[8]。也有研究发现,APS通过固有线粒体途径诱导人胃癌MGC-803细胞凋亡[9]。Yang等[10]通过对Ehrlich's腹膜癌小鼠给予APS处理后发现,APS能够增加脾脏中白细胞介素(interleukin ,IL)-2的表达和上调组织中Bax的表达,下调组织Bcl-2表达,增加CD4+T淋巴细胞比例。表明其可能的作用机制包括改善小鼠免疫功能和调控细胞凋亡相关因子,抑制Ehrlich's腹膜癌的发生发展。亦有学者对APS化疗增敏作用进行探讨。黄宏思等[11]在APS协同紫杉醇对肿瘤细胞的杀伤作用研究中发现,APS与紫杉醇联合使用具有协同抗肿瘤作用,且不同浓度的APS作用于人乳腺癌MCF-7细胞后,能显著抑制细胞增殖。APS可以使肿瘤细胞阻滞在G1期。张莹等[12]研究发现,注射用APS对耐DDP人肺腺癌细胞A549/DDP具有耐药逆转作用,能明显增加A549/DDP耐药细胞对DDP的敏感性,提高细胞死亡率。提示APS可能通过调节细胞周期或通过逆转耐药提高化疗药物的敏感性,但进一步的作用机制尚不明确。
细胞凋亡属动态平衡机制,由多基因控制的在某些病理生理状态中的程序性死亡过程。Caspase-3被称为“死亡执行蛋白酶”,死亡受体与死亡配体结合后通过“死亡效应结构域”启动Caspase级联反应,激活效应因子 Caspase-3等[13]。同时活化Bcl-2家族的促凋亡因子诱导线粒体释放细胞色素C,介导内源性凋亡途径,从而导致细胞凋亡。Bcl-2、Bax 基因是Bcl-2 家族中调节细胞凋亡最重要的调控基因[14]。在调整和执行细胞凋亡因素的任何变化均对DDP的敏感性有潜在影响,与DDP耐药和肿瘤复发相关。
本研究探讨了APS联合DDP对卵巢癌细胞株SKOV3增殖的影响,结果显示,APS能增加DDP对SKOV3细胞的促凋亡作用,提高卵巢癌细胞对DDP化疗的敏感性,二者有协同作用。联合用药组SKOV3细胞中的Bax、Caspase-3蛋白表达和基因变化随着APS浓度增高逐渐增加,Bcl-2表达逐渐减低。联合用药组中,Bax/Bcl-2比值随着APS浓度增加逐渐升高,提示细胞凋亡水平显著增加。由此推测,APS可提高卵巢癌细胞对DDP的敏感性,调节凋亡相关因子,促进肿瘤细胞凋亡,其具体的作用机制尚需进一步探讨。
