基于网络药理学方法探讨荆芥-防风配伍治疗特应性皮炎的作用机制研究
2021-04-06施建新赵珩闵仲生谭城李红敏
施建新 赵珩 闵仲生 谭城 李红敏

摘要:目的 采用网络药理学和生物信息学方法筛选荆芥-防风配伍治疗特应性皮炎的作用靶点,探讨治疗特应性皮炎作用机制。方法 利用TCMSP数据平台,以口服利用度和类药性分别筛选本配伍的有效活性成分同时预测作用靶点;从Uniprot数据库检索中药靶点所对应的人类基因,检索Genecard和OMIM数据库中特应性皮炎相对应的基因,再将疾病基因与中药预测的靶点取交集,使用在线String工具对疾病基因与中药的靶点交集进行PPI互作分析。采用Cytoscape软件构建药物-成分-靶点-疾病调控网,将药物-疾病关键靶点蛋白进行GO功能和KEGG通路富集分析。结果 IL6、AKT1、TNF等是荆芥-防风配伍治疗特应性皮炎的关键靶点,GO富集分析分析显示荆芥-防风配伍治疗特应性皮炎关键靶点设计生物过程条目多条,KEGG通路分析显示IL17及TNF信号通路是荆芥-防风配伍治疗特应性皮炎的主要机制通路。结论 荆芥-防风药对治疗特应性皮炎的机制可能与其干扰NF-κB在IL17及TNF信号通路中转录,影响炎症因子IL-6等相关。
关键词:网络药理学;荆芥-防风配伍;特应性皮炎;作用机制
中图分类号:R285 文献标志码:A 文章编号:1007-2349(2021)03-0015-07
【Abstract】Objective: To explore the mechanism of Schizonepeta-Saposhnidoviae campibility in the treatment of atopic dermatitis by using network pharmacology and bioinformatics methods to screen the targets. Methods: Based on the TCMSP data platform, the effective active ingredients of this compatibility were screened by oral availability and drug-like properties and the targets were predicted at the same time. The corresponding human gene was searched for the target of traditional Chinese medicine from the Uniprot database, and the specificity of the corresponding genes to dermatitis was searched in the Genecard and OMIM databases, and then the disease genes and the predicted targets were taken to intersect, and the intersection of the disease genes and the targets were used to perform PPI interaction analysis by the online String tool. Cytoscape software was used to construct a drug-component-target-disease regulation network, and the drug-disease key target protein was analyzed for GO function and KEGG pathway enrichment. Results: IL6, AKT1, TNF, etc. were the key targets of Schizonepeta-Saposhnidoviae campibility in the treatment of atopic dermatitis. The GO enrichment analysis showed the key targets of Schizonepeta-Saposhnidoviae campibility in the treatment of atopic dermatitis were designed with multiple biological process items. KEGG pathway analysis showed the IL17 and TNF signaling pathways were the main mechanism pathways for the treatment of atopic dermatitis with Schizonepeta-Saposhnidoviae campibility. Conclusion: The mechanism of Schizonepeta-Saposhnidoviae campibility drugs in the treatment of atopic dermatitis may be related to its interference with the transcription of NF-κB in the IL17 and TNF signaling pathways and the influence of the inflammatory factor IL-6.
【Key words】Network pharmacology;Schizonepeta-Saposhnidoviae campibility;Atopic dermatitis;Mechanism of action
特應性皮炎(atopicdermatitis,AD)是一种慢性瘙痒性且儿童发病率较高的皮肤病[1]。国外研究表明,在高收入国家中儿童AD发病率为15%~20%,成人AD发病率为1%~3%[2-3]。研究指出,AD发病的时间有可能会影响患者的临床病程和持续时间,所以2岁之前发病的患者,他们的症状改善及病程控制通常好于发病较晚的患者,但此结论仍需要进一步的调查证实[4]。
中医古籍中并未出现“特应性皮炎”的病名,的古籍中记载了一些与特应性皮炎症状相似的疾病,如“奶癣、血风疮、四弯风”等,古籍中记载的特征与特应性皮炎极为相似。荆芥防风具有解热、阵痛、影响免疫功能、抗过敏等作用,然而荆芥、防风复杂的化学成分及治疗疾病的多样化[5],临床通常难以明确荆芥防风药对治疗特应性皮炎具体作用机制,本研究采用网络药理学的方法探讨其治疗特应性皮炎的可能作用机制,探索中医药治疗AD的新方法。
1 资料与方法
1.1 荆芥、防风化学成分虚拟筛选 在 TCMSP 平台检索荆芥、防风主要活性成分的靶点蛋白,并在 Uniprot(https://www.uniprot.org/)数据库将预测出的靶点蛋白名称进行标准化,选择物种为“Homo sapiens”,转换为对应的基因名称,即得到药物的潜在作用靶点。
1.2 疾病基因靶点预测 通过Genecard网站(https://www.genecards.org/)和OMIM网站(https://omim.org/)的检索功能,搜索特应性皮炎相对应的基因,同时获取特应性皮炎基因数目。
1.3 网络合并 使用在线工具String(https://string-db.org)将AD基因与荆芥、防风靶点取交集,获取交集基因靶点很有可能是该药对活性成分治疗特应性皮炎靶点。
1.4 PPI互作分析计算核心基因和绘制Cytoscape药理网络图 将荆芥、防风与特应性皮炎取交集后的115个基因靶点进行PPI互作分析,输入Cytoscape3.7.2软件中,构建成分靶点基因PPI网络,并进行核心筛选,制成药物干预疾病的相关基因关系图。
1.5 基因富集分析 通过Bioconductor数据库查询药物与疾病的共同靶点,利用R语言将基因symbol转为基因ID,设置pvalue=0.05,qvalue=0.05对获取的基因分别进行GO富集和KEGG富集分析,进一步说明中药化合物的靶点蛋白在基因功能和信号通路中的作用。
2 结果
2.1 荆芥、防风化学成分虚拟筛选 本实验通过阈值设定OB>30%,DL>0.18,共筛选出主要候选化合物种类29种,荆芥化合物种类11种,主要包括挥发油类、单萜类及黄酮类,防风化合物种类18种,主要包括色原酮类、香豆精类、挥发油类、多炔类及多糖类,从候选化合物中共筛选出成分靶点550个,其中荆芥312个,防风238个(表1)。
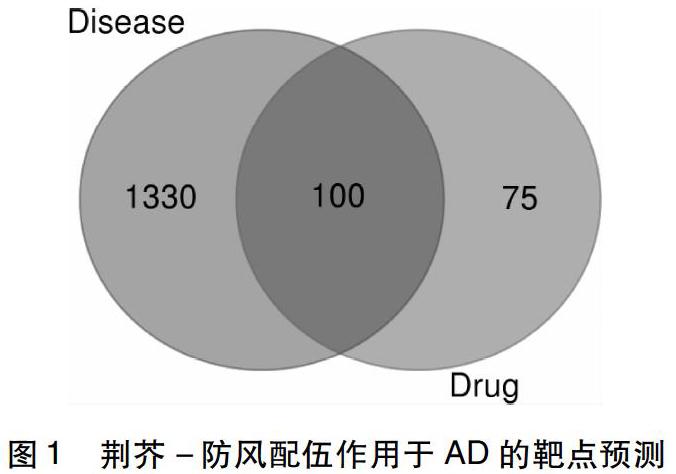
2.2 中药和疾病基因靶点预测 荆芥-防风通过Uniprot网站(https://www.uniprot.org/)检索中药靶点对应的人的基因,其中排除未找到及重复的基因,最终共获取基因175个。再通过Genecard网站(www.genecards.org)检索与AD对应的致病基因,共获取特应性皮炎基因1430個。其中,荆芥-防风所干预的特应性皮炎疾病基因为100个(图1)。
2.3 网络合并及PPI网络构建 使用String工具(string-db.org)构建成分靶点的PPI网络(图2)。通过计算每个基因的连接点数目,找出前30个PPI核心靶点,即IL6、AKT1、TNF等(图3)。
2.4 绘制Cytoscape疾病-靶点药理网络图 利用Cytoscape3.72软件,制成药物干预疾病的有效成分与相关基因关系图(图4)。
2.5 GO富集分析 利用R语言,获取基因ID,通过GO富集分析获取的100个基因,共获得129条相关的富集条目,分子功能的作用主要表现在细胞因子结合受体细胞,因子活性等方面(图5、图6)。
2.6 KEGG通路富集分析 KEGG通路富集结果分析结果(图7)显示,“荆芥-防风”药对治疗特应性皮炎的关键基因靶点富集的通路共有164条,包括IL-17信号通路路径(图8)、TNF信号通路路径(图9)等。
3 讨论
特应性皮炎(AD)病因尚未明确,目前公认其发病机制主要与皮肤屏障功能的异常、父母的遗传、自身免疫功能异常及周围环境因素相关。全球有超过20%的儿童及3%的成年人患有特应性皮炎。2019年报道上海嘉定地区儿童的AD发病率约为2.54%[6],与美国甚至欧洲等地相比,AD的在瑞典儿童中的患病率甚至能高达22.3%[7]。西医多采用抗组胺类药物,局部外用首选糖皮质激素,虽能取得一定的疗效,但各种不良反应的发生也限制了它们的使用。寻找临床疗效确切,能有效降低复发率和毒副作用较小的方法及药物,一直是各国临床皮肤科医生所关注的。
中医虽无AD这一病名,但根据其发病原因及临床表现,总结归纳后可归属于“湿疮”、“浸淫疮”、“四弯风”等范畴,这其中尤以“四弯风”与特应性皮炎最为贴切[8]。风邪袭入腠理是特应性皮炎的病因之一,病机多为先天禀赋不耐,脾肺不足并外感风湿热邪,发于疾病所致,治则多以健脾利湿,清热祛风为主。“荆芥防风”药对临床运用广泛,它们作为君药的众多复方广泛应用于皮肤科[9-10],除了具有良好的祛风止痒的功效,常常用于荨麻疹、慢性湿疹等疾病起的瘙痒及支气管炎、过敏性鼻炎等各类过敏性疾病。
本研究运用网络药理学方法探索“荆芥-防风”药对通过何种途径对特应性皮炎产生治疗效果。通过PPI蛋白互作分析,共找到100个互作关系密切的基因,IL6、AKT1、TNF等,说明这些基因参与了“荆芥-防风”药对对特应性皮炎的治疗。通过GO功能富集分析及KEGG通路富集分析来阐释作用靶点在基因功能和信号通路的作用,发现药对在生物过程富集主要表现在对有机物的反应,细胞对化学刺激的反应,细胞对有机物的反应,对含氧化合物的反应,对化学物质的反应等方面。分子功能富集主要表现在蛋白质结合,酶结合,信号受体结合,细胞因子受体结合等方面。细胞成分富集主要表现在细胞外间隙、胞外区部分、细胞外区、膜筏、细胞内细胞器腔等部分,所以本药对可以通过影响细胞因子及其受体,抑制IL6发挥治疗作用[11-12]。通过KEGG分析及文献回顾[13],“荆芥防风”药对作用于AD的机制可能体现在其有效成分干预NF-KB在IL17和TNF这2条信号通路中的转录,进而影响细胞因子的表达。在IL17通路中,药对完全调节了下游炎症因子IL1β、TNFα、IL6及IFNγ。TNF通路中也大量影响了炎症因子、转录因子等,从而达到治疗的特应性皮炎结果。
IL-17及TNF这2条信号通路可能是本药对治疗特应性皮炎的潜在通路[14-15]。既往研究已经表明IL17在多种自身免疫疾病及炎症致病因子中发挥了重要作用[16],最近研究也表明,IL17会在患儿中有明显的升高[17]。另外新生儿来源的IL-17可以预防特应性皮炎的发生,因为IL17对于皮肤的稳定和皮肤炎症具有双向调节的作用[18]。运用流式细胞术检测术提示:虽然IL17在AD和银屑病的皮损中都有表达,CD4+来源的IL17在两种疾病中的表达的没有显著差异,但CD8+来源的IL17在银屑病中表达比在AD中的表达具有明显的意义[19]。目前已经针对IL17这个通路,开发了治疗银屑病的生物制剂[20]。IL17的升高会导致AD的发生,所以针对IL17的治疗很可能是治疗AD的一个新的通路[21]。
在TNF通路中,本药对通过影响NF-KB转录,来调节转录因子JUN、Fos及炎症因子IL-6、IL1b等达到治疗特应性皮炎的结果。TLR4[22]的缺少会促进TNF-α的表达,而TNF-α可以单独或者联合Th2细胞因子降低神经酰胺的含量,从而影响皮肤屏障功能[23]。研究表明,急性AD皮损中的角质形成细胞中Th2细胞因子和肿瘤坏死因子-α可增强GITRL(Glucocorticoid-inducedTNFreceptor-relatedproteinligand)的表达。这一观察表明细胞因子调节的角质形成细胞GITRL表达与其在AD炎症反应中的作用有关[24]。
综上所述,通过对“荆芥-防风”相关靶点与化学成分的作用进行分析,通过图形的可视化发现药对在分子水平上的复杂的作用原理,展示网络药理学研究“药物-疾病-基因-靶点”的相互关系及其影响,换个新颖的角度展示中药治疗疾病原理,运用网络药理学的方法寻找“荆芥-防风”药对治疗特应性皮炎的可能的作用机制,为日后动物实验提供可能的治疗通路提供依据。但考虑到数据库不够完整,人体内其他药代动力学的影响分析不够彻底,还需要更深入的研究来探索其具体机制。
参考文献:
[1]Silverberg Jonathan I,Hanifin Jon M,Adult eczema prevalence and associations with asthma and other health and demographic factors: a US population-based study[J].J Allergy Clin Immunol,2013,132(5):1132-1138.[ZK)]
[2]Nutten Sophie,Atopic dermatitis:global epidemiology and risk factors[J].Ann Nutr Metab,2015,66(1):8-16.
[3]Kabashima Kenji,New concept of the pathogenesis of atopic dermatitis: interplay among the barrier, allergy, and pruritus as a trinity[J].J Dermatol Sci, 2013,70(1):3-11.
[4]Wananukul Siriwan,Chatproedprai Susheera,Tempark Therdpong,et al. The natural course of childhood atopic dermatitis: a retrospective cohort study[J].Asian Pac J Allergy Immunol,2015,33(2):161-168.
[5]于柳,王哲,武志强,等.药对荆芥-防风的现代研究现状[J].中药药理与临床,2013,29(05):150-155.
[6]罗瑞静,刘杰,彭勇,等.上海市嘉定区儿童特应性皮炎中医证候分布规律的临床流行病学调查[J].中国皮肤性病学杂志.2019.33(8):943-948.
[7]Sybilski Adam J,Raciborski Filip,Lipiec Agnieszka,et al. Epidemiology of atopic dermatitis in Poland according to the Epidemiology of Allergic Disorders in Poland (ECAP) study[J].J Dermatol,2015,42(2):140-147.
[8]康润芳,金浩然,杨恩品.特应性皮炎的中西医治疗进展[J].云南中医中药杂志,2015,36(4):82-83.
[9]黄晓婵,朱明芳.朱明芳教授运用消風散治疗皮肤病验案举隅[J].云南中医中药杂志,2020,41(5):1-3.
[10]谢筱多,李忻红.《医宗金鉴》中经方在治疗湿疹中的应用[J].云南中医中药杂志,2011,32(11):49-50.
[11]Yasui Masahiro,Matsushima Miyoko,Omura Aya,et al. The Suppressive Effect of Quercetin on Toll-Like Receptor 7-Mediated Activation in Alveolar Macrophages[J].Pharmacology,2015,96(5-6):201-209.
[12]Li Ruipeng,Zhao Di,Qu Rong,et al. The effects of apigenin on lipopolysaccharide-induced depressive-like behavior in mice[J].Neurosci Lett,2015(594):17-22.
[13]Lee Yonghyeon,Choi Hyeon Kyeong,Ndeh Kaudjhis Patrick Ulrich,et al. Inhibitory Effect of Centella asiatica Extract on DNCB-Induced Atopic Dermatitis in HaCaT Cells and BALB/c Mice[J].Nutrients,2020,12(2):90.
[14]Ma Lei,Xue Hai-Bo,Guan Xiu-Hao,et al. Possible role of Th17 cells and IL-17 in the pathogenesis of atopic dermatitis in northern China[J].J Dermatol Sci,2012,68(1):66-68.
[15]Lee Kyu-Shik,Chun So-Young,Lee Min-Gu,et al. The prevention of TNF-α/IFN-γ mixture-induced inflammation in human keratinocyte and atopic dermatitis-like skin lesions in Nc/Nga mice by mineral-balanced deep sea water[J].Biomed Pharmacother,2018(97):1331-1340.
[16]Sgnotto Fábio D R,de Oliveira Marilia G,Lira Aline A L,et al. IgG from atopic dermatitis patients induces IL-17 and IL-10 production in infant intrathymic TCD4 and TCD8 cells[J].Int J Dermatol,2018,57(4):434-440.
[17]Santos Ludimila S,Sgnotto Fabio da Ressurei??o,Sousa Thamires R,et al. IgG from atopic dermatitis patients induces non-atopic infant thymic invariant natural killer T (iNKT) cells to produce IL-4, IL-17, and IL-10[J].Int J Dermatol,2020,59(3):359-364.
[18]Spidale Nicholas A,Malhotra Nidhi,Frascoli Michela,et al. Neonatal-derived IL-17 producing dermal γδ T cells are required to prevent spontaneous atopic dermatitis[J].Elife,2020(9):50.
[19]Hijnen Dirkjan,Knol Edward F,Gent Yoony Y,et al. CD8(+) T cells in the lesional skin of atopic dermatitis and psoriasis patients are an important source of IFN-γ, IL-13, IL-17, and IL-22[J].J Invest Dermatol,2013,133(4):973-979.
[20]Loft N D,Vaengebjerg S,Halling A-S,et al. Adverse events with IL-17 and IL-23 inhibitors for psoriasis and psoriatic arthritis: a systematic review and meta-analysis of phase III studies[J].J Eur Acad Dermatol Venereol,2020(34):1151-1160.
[21]Chaudhary Sujeet K,Singh Shanker K,Kumari Priyambada,et al. Alterations in circulating concentrations of IL-17, IL-31 and total IgE in dogs with atopic dermatitis[J].Vet Dermatol,2019,30(5):383-383.
[22]Lesiak A,Smolewski P,Sobolewska-Sztychny D,et al. The role of T-regulatory cells and Toll-like receptors 2 and 4 in atopic dermatitis[J].Scand J Immunol,2012,76(4):405-410.
[23]Danso Mogbekeloluwa O,van Drongelen Vincent,Mulder Aat,et al. TNF-α and Th2 cytokines induce atopic dermatitis-like features on epidermal differentiation proteins and stratum corneum lipids in human skin equivalents[J].J Invest Dermatol,2014,134(7):1941-1950.
[24]Byrne A M,Goleva E,Chouiali F,et al. Induction of GITRL expression in human keratinocytes by Th2 cytokines and TNF-α: implications for atopic dermatitis[J].Clin Exp Allergy,2012,42(4):550-559.
(收稿日期:2020-11-02)
